Chaque année, Nature Methods passe en revue les technologies et les approches qui ont permis à l’industrie des sciences de la vie de progresser au cours de l’année écoulée, puis choisit les plus prisées et les plus influentes parmi la liste dressée. En 2017, Nature Methods a désigné les organoïdes comme méthode de l’année. Depuis lors, les études menées sur les organoïdes ont été fructueuses grâce aux efforts sans relâche fournis par de nombreux chercheurs.
En résumé, les organoïdes sont des cultures tissulaires tridimensionnelles (3D) dérivées de tissus ou de cellules souches. Les organoïdes sont utilisés dans un large éventail d’études puisqu’il s’agit de versions miniatures et simplifiées des tissus ou organes humains. Ils simulent de manière très fidèle la structure et les fonctions physiologiques des tissus in situ et conservent leur patrimoine génétique passage après passage.
Grâce à leur aptitude à simuler différents éléments du corps humain, les chercheurs peuvent utiliser les organoïdes pour :
- avoir une meilleure compréhension de l’organogenèse ;
- examiner l’action des médicaments ;
- développer des traitements régénératifs.
Cet article permettra de passer en revue quelques-unes des dernières études réalisées sur les organoïdes et d’expliquer en quoi les systèmes d’imagerie microscopique font progresser la recherche dans ce domaine essentiel.
Progrès réalisés grâce à la recherche sur les organoïdes
Les chercheurs continuent de mener de nouvelles études à l’aide d’organoïdes. Voici quelques-unes des études les plus importantes :
1. Patient-Derived Glioblastoma Organoid Model and Biobank Recapitulates Inter- and Intra-tumoral Heterogeneity
En 2019, des chercheurs de l’université de Pennsylvanie ont publié un article intitulé « A Patient-Derived Glioblastoma Organoid Model and Biobank Recapitulates Inter- and Intra-tumoral Heterogeneity » dans Cell. Cet article décrit l’établissement d’un modèle et d’une biobanque d’organoïdes de glioblastomes (GBO) dérivés de patients.
Cette étude a permis de montrer que le GBO conserve les caractéristiques clés du glioblastome, ce qui permet de l’utiliser immédiatement pour mettre au point des stratégies thérapeutiques pour les patients. La biobanque établie par les chercheurs fournit des ressources utiles pour les études de recherche fondamentale et translationnelle menées sur le glioblastome.
Les chercheurs ont documenté le processus de développement et les modifications morphologiques de l’organoïde par observation au microscope. Ils ont également observé l’expression de certains marqueurs protéiques au sein de l’organoïde par microscopie confocale à balayage laser.
Ce travail a permis de montrer l’hétérogénéité apparente quant à la morphologie et aux caractéristiques des cellules des organoïdes, ainsi que leur composition cellulaire hautement similaire à celle de la tumeur mère.
2. Chromatin Accessibility Dynamics in a Model of Human Forebrain Development
En 2020, l’article « Chromatin accessibility dynamics in a model of human forebrain development » a été publié dans Science. Dans cet article, les chercheurs ont décrit la procédure de culture utilisée pour générer un organoïde de cerveau antérieur humain et l’utilisation prévue de cet organoïde. Ils ont montré de quelle manière les organoïdes de cerveau antérieur humain peuvent s’assembler spontanément pour former différentes parties du cerveau antérieur.
Plus intéressant encore, les chercheurs ont également trouvé un moyen de prolonger la durée de vie des organoïdes de cerveau antérieur humain de presque 300 jours. Cela est suffisant pour observer le développement des organoïdes du cerveau antérieur en structures plus complexes.
3. Amplification of Human Interneuron Progenitors Promotes Brain Tumors and Neurological Defects
En 2022, l’article « Amplification of human interneuron progenitors promotes brain tumors and neurological defects » a été publié dans Science. Cette étude a permis d’identifier les mécanismes développementaux à l’origine des malformations du développement cortical (MDC) chez l’Homme, qui peuvent conduire à des retards du développement et à l’épilepsie chez les enfants.
Les chercheurs ont établi un modèle d’organoïde de cerveau humain pour l’étude de la sclérose tubéreuse de Bourneville (STB) et ont identifié un type de cellules souches neuronales, les progéniteurs des interneurones tardifs caudaux (CLIP). Dans le cas de la STB, les cellules CLIP prolifèrent de manière excessive, ce qui entraîne le développement d’un nombre d’interneurones trop importants, de tumeurs cérébrales et de malformations corticales.
Les organoïdes constituent des modèles prometteurs pour l’étude du développement, des maladies et des médicaments. Ils peuvent également être utilisés dans de nombreux autres domaines, comme la médecine régénérative. Cependant, il existe encore de nombreux défis en matière de culture, d’observation et d’analyse des données quantitatives des organoïdes étant donné que leurs conditions de culture et leurs structures sont plus complexes que celles des cellules adhérentes.
Trois moyens de faire progresser la recherche sur les organoïdes grâce à l’imagerie microscopique
Heureusement, les systèmes d’imagerie microscopique peuvent contribuer à surmonter ces défis. Voici trois moyens de faire progresser la recherche sur les organoïdes grâce aux logiciels et aux systèmes d’imagerie microscopique :
1. Contrôle de la qualité lors de la culture d’organoïdes
La méthode de préparation habituelle des organoïdes consiste à isoler des cellules embryonnaires ou des cellules souches pluripotentes induites, puis à les mettre en culture dans un milieu adéquat (comme la matrice Matrigel) afin de permettre leur développement en trois dimensions.
Des cytokines, des facteurs de croissance et des petites molécules sont ajoutés au milieu pour activer ou inhiber les voies de signalisation impliquées dans la formation des organoïdes. Les voies de signalisation sont les mêmes que celles impliquées dans le développement et le maintien de l’homéostasie des organes équivalents in vivo.
D’après les travaux de recherche du Dr Takanori Takebe du Tokyo Medical and Dental University Institute of Research, l’efficacité de la différenciation subséquente en organoïdes est grandement affectée par les différences observées lors des premiers stades de prolifération lors de la culture de maintien. Le Dr Takanori Takebe a constaté que dans les lignées de cellules souches pluripotentes induites capables de se différencier, les colonies se forment à partir de la plupart des cellules individuelles qui ont adhéré au support de culture après le passage de la culture au stade précoce de prolifération.
Le Dr Takebe a émis l’hypothèse qu’une fréquence de mort cellulaire plus élevée lors des premiers stades de la culture de maintien des lignées de cellules souches pluripotentes induites résistantes à la différenciation pouvait être la cause du nombre moins important de colonies de cellules souches pluripotentes induites observées dans ces lignées et, donc, de la moins bonne efficacité de leur différenciation en organoïdes hépatiques. Par conséquent, la formation reproductible d’organoïdes requiert de mettre au point les meilleurs protocoles possible pour la différenciation des organoïdes et d’optimiser la culture des cellules souches pluripotentes induites non différenciées. Pour acquérir de nouvelles informations et améliorer les protocoles expérimentaux, le Dr Takebe utilise notre système de surveillance de l’incubation.
Le système CM30 peut acquérir et analyser les données à intervalle régulier des échantillons mis en culture, ce qui permet aux chercheurs de comprendre l’état des cellules souches pluripotentes induites au cours de la culture cellulaire et d’identifier les facteurs clés permettant d’optimiser l’efficacité de la différenciation pour améliorer encore davantage les protocoles expérimentaux.
À cause de la longue durée de culture des organoïdes et du coût élevé des milieux et des additifs nécessaires pour assurer leur croissance, les chercheurs doivent faire particulièrement attention au processus de culture des organoïdes et à leur croissance et éviter toute contamination.
Grâce aux capacités de surveillance à distance du système CM30, il n’est pas nécessaire de pénétrer dans la salle blanche pour sortir les échantillons de l’incubateur pour les examiner au microscope. Cela accroît fortement l’efficacité des expériences et réduit les risques de contamination.
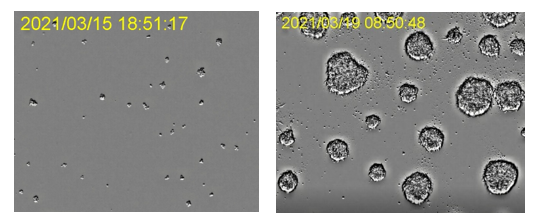
Développement des organoïdes dans un incubateur. Images acquises à l’aide du système de surveillance de l’incubation CM. Données d’images reproduites avec l’aimable autorisation de ACEL, Inc.
2. L’imagerie microscopique des organoïdes
Étant donné que les organoïdes sont des cultures cellulaires 3D présentant un volume précis, il est préférable d’utiliser des systèmes d’imagerie microscopiques capables d’acquérir une image 3D multicouches sur l’axe Z. Cette capacité vous permet d’acquérir toutes les informations relatives aux caractéristiques morphologiques et aux structures cellulaires internes des organoïdes en imagerie.
La microscopie confocale à balayage laser pour l’imagerie des organoïdes
Les microscopes confocaux à balayage laser sont idéals pour l’acquisition d’images volumétriques 3D d’un organoïde. Grâce au sténopé situé à l’avant du détecteur qui bloque la lumière en dehors du plan focal, seules les informations situées à la profondeur d’intérêt sont acquises avec une haute résolution axiale.
Associé à notre détecteur SilVIR™, notre microscope confocal à balayage laser FLUOVIEW™ FV4000 assure un rapport signal sur bruit élevé, une imagerie plus précise et une haute résolution spectrale et spatiale. Le détecteur SilVIR fait appel à notre technologie brevetée* pour compter les photons sur une plage dynamique étendue et vous permettre ainsi d’acquérir des données d’imagerie 3D précises. La technologie permet également de reconstruire des images 3D précises, ce qui est idéal pour mener des travaux de recherche sur des organoïdes.
* Brevet n° US11237047.
Le système FV4000 fournit également une solution en proche infrarouge (NIR) éprouvée. L’imagerie proche infrarouge permet une pénétration en profondeur, une faible phototoxicité et une faible interférence de l’autofluorescence des tissus. Par conséquent, ce système peut être utilisé avec différents fluorophores dans le spectre de la lumière visible pour faire de l’imagerie de fluorescence multicolore sans diaphonie des organoïdes, avec la possibilité d’effectuer une surveillance à long terme de l’activité des organoïdes.
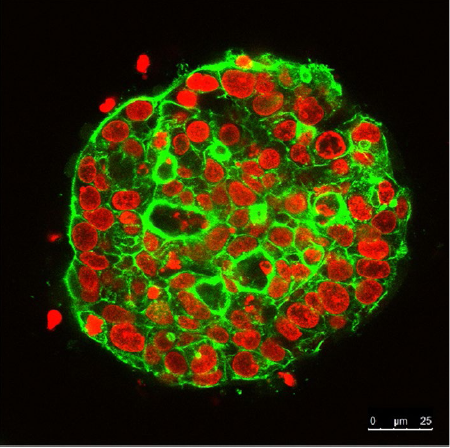
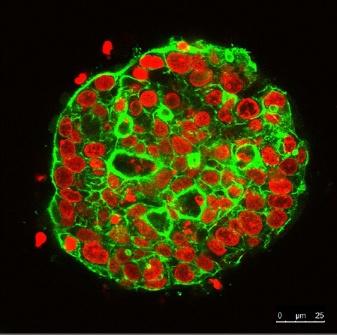
Observation continue de sphères de cellules en culture 3D pendant 21 jours à l’aide du microscope confocal à balayage laser FLUOVIEW. Les noyaux sont marqués avec du SYTOX Orange (rouge). Le cytosquelette est marqué avec de l’Alexa Fluor 488 (vert).
La microscopie multiphotonique pour l’imagerie des organoïdes
Pour obtenir une image complète d’un organoïde volumineux, il est primordial de pouvoir prendre des images en profondeur. Les microscopes multiphotoniques sont des systèmes d’imagerie microscopique idéals pour l’imagerie des organoïdes en profondeur.
Voici comment ces systèmes peuvent vous aider à faire de l’imagerie d’organoïdes en profondeur :
Notre microscope multiphotonique FV4000MPE possède un système optique avancé afin d’optimiser la sensibilité et la résolution de l’imagerie en profondeur. Grâce à sa plage de longueurs d’onde de 400 à 1600 nm, ce microscope permet une excitation par infrarouge efficace sans compromettre la détection des longueurs d’onde visibles.
Avec son trajet optique de détection doté d’une grande ouverture dégagée et sa grande efficacité, ce microscope permet de capter plus de signaux d’émission, notamment des photons dispersés selon des angles d’incidence importants. En outre, le détecteur SilVIR au cœur du système assure un bruit exceptionnellement faible et une haute sensibilité avec un rapport signal sur bruit élevé sur la plage de longueurs d’onde allant du visible à l’infrarouge.
Ces capacités optiques vous permettent d’acquérir des informations plus en profondeur dans un organoïde. Les objectifs TruResolution™ améliorent la luminosité et la résolution de l’imagerie en profondeur avec une compensation automatique des aberrations sphériques. Ces composants optiques à haute performance permettent d’acquérir plus d’informations détaillées à tous les niveaux d’une image 3D.
La microscopie à super-résolution pour l’imagerie des organoïdes
La demande en système d’imagerie pour les organoïdes volumineux ne cesse d’augmenter. Le système d’imagerie doit acquérir des images sur l’axe Z et les assembler, ce qui nécessite une grande vitesse d’acquisition des images. C’est là que la microscopie confocale à disque rotatif entre en jeu.
Contrairement aux microscopes à balayage laser qui sont équipés d’un seul sténopé, les microscopes confocaux à disque rotatif utilisent un disque opaque avec des centaines de sténopés qui tourne à grandes vitesses. L’image de l’échantillon tout entier est acquise en une seule fois, plutôt que point par point, ce qui améliore considérablement la vitesse d’imagerie et réduit les photodommages.
Notre microscope à super-résolution IXplore™ SpinSR est un système confocal à disque rotatif qui assure une imagerie rapide, une haute sensibilité et une faible phototoxicité et est doté de modules à super-résolution évolutifs à des résolutions aussi fines que 120 nm. Ces capacités permettent une imagerie rapide des organoïdes par prise d’images empilées sur l’axe Z et assemblage des images.

Système de microscope à super-résolution IXplore SpinSR.
Le système IXplore SpinSR fonctionne également avec notre gamme d’objectifs à huile de silicone. Ces objectifs permettent d’acquérir des images contrastées en super-résolution avec moins de flou, même en profondeur dans les organoïdes.

Objectifs à immersion dans l’huile de silicone idéals pour l’imagerie des organoïdes en profondeurs.
Nos objectifs à immersion dans l’huile de silicone doivent être utilisés avec une huile de silicone spécifique ayant un indice de réfraction de 1,40. Cette association remplit les conditions nécessaires à l’acquisition d’images à haute résolution (supérieure à celles des objectifs à immersion dans l’eau) et à l’observation des échantillons diffusant fortement la lumière, comme les organoïdes et les autres spécimens épais.
3. L’analyse quantitative des images d’organoïdes
Jusqu’à présent, nous avons discuté de la manière d’acquérir des images micro et macro nettes des organoïdes à l’aide d’un équipement d’imagerie microscopique de pointe, comme un microscope confocal à balayage laser, un microscope multiphotonique ou un microscope à super-résolution. Ces images permettent aux chercheurs d’observer la structure fine de chaque cellule, voire même le niveau subcellulaire d’un échantillon 3D.
Pour la recherche en sciences de la vie, il n’est cependant pas suffisant d’observer uniquement les détails d’un échantillon. Lors d’expériences utilisant des modèles d’organoïdes pour la validation de l’efficacité et l’analyse toxicologique de médicaments, des analyses qualitatives et quantitatives de la morphologie de l’organoïde et de ses cellules internes sont également nécessaires. Par exemple, la comparaison des différences entre plusieurs organoïdes à différentes concentrations en médicament dans une plaque multipuits peut permettre d’obtenir des données statistiques plus convaincantes.
Pour répondre aux besoins de ces applications, nous avons développé le logiciel d’analyse cellulaire NoviSight™ qui permet d’identifier et d’analyser les cellules d’échantillons 3D complexes comme les sphéroïdes ou les organoïdes cultivés dans des plaques multipuits.
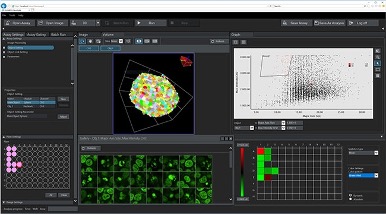
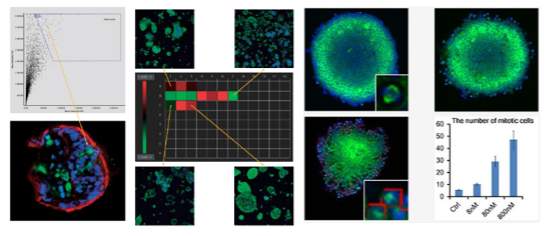
Interface d’utilisation du logiciel NoviSight. Cet exemple illustre une analyse quantitative des cellules en mitose à l’intérieur de sphéroïdes traités avec du paclitaxel à différentes concentrations.
Voici quelques-unes des fonctionnalités utiles du logiciel pour la recherche sur les organoïdes :
- La technologie unique d’analyse cellulaire True 3D permet de reproduire de manière réaliser la morphologie spatiale de vos échantillons
- Le module de mesure de nombreux paramètres peut vous aider à identifier rapidement l’organoïde et les composants cellulaires et à acquérir des données utiles, notamment le volume, la surface, la distance spatiale et l’intensité de la fluorescence
- L’interface d’utilisation interactive vous permet d’associer facilement les images des cellules à leurs données statistiques pour une analyse statistique précise des données
Les organoïdes pouvant être utilisés pour simuler de manière fidèle les tissus humains, aussi bien au niveau génétique qu’au niveau morphologique, ils offrent de grandes perspectives d’applications, notamment dans des domaines tels que la simulation des processus de développement, la recherche médicale, l’immunité clinique, la sensibilité des tumeurs aux médicaments, la médecine régénérative et médecine de précision.
Malgré cela, il est important de rappeler que les organoïdes sont encore considérés comme une technologie émergente. En effet, la culture, le contrôle qualité et la reproductibilité expérimentale des organoïdes limitent toujours leur utilisation. Il reste encore un long chemin à parcourir en matière de recherche fondamentale, d’applications et de translation des organoïdes.
Grâce à sa longue expérience en matière de microscopie et de composants optiques, Evident s’engage à accompagner les chercheurs tout au long de leur processus expérimental sur les organoïdes. Grâce à nos solutions complètes dédiées à la recherche sur les organoïdes, de la préparation des échantillons à l’acquisition et l’analyse de données 3D, nous poursuivons notre mission visant à contribuer à un monde plus sain et plus sûrs.
Contenu connexe
E-book : Imagerie et analyse des modèles cellulaires 3D avancés
Imagerie automatisée d’organoïdes et analyse 3D à haut débit