How to select objectives - Immersion liquid (Japanese text only)
こだわりの対物レンズ選び ~浸液にこだわる~
対物レンズの選択によって、蛍光像の見え方は大きく変わってきます。
前回は、「開口数(N.A.)が大きいほど、蛍光像が明るくシャープになる」ことに注目し、その意味と「対物レンズの選択によって実際の蛍光像に変化が現れる」ことをご紹介しました。
今回は、開口数が1.0以上の、より明るくシャープな蛍光像を得ることができる、「液浸対物レンズ」についてご紹介します。
「浸液」の役割
対物レンズの開口数(N.A.)を大きくするために、対物レンズとカバーガラスの間に入れる液体(=媒質)のことを「浸液」と呼びます。
この「浸液」を使って観察するための対物レンズを「液浸(系)対物レンズ」と呼び、よく使われるものとしてオイルを使う「油浸対物レンズ」と、水を使う「水浸対物レンズ」があります。
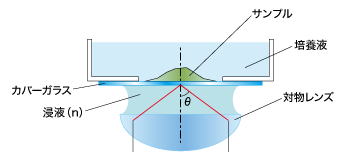
図1
そもそも、なぜ「浸液」を入れることで開口数が大きくなるのでしょうか?
前回ご紹介した、開口数(N.A.)を求める式を再度ご覧ください。
N. A.=n sinθ
n:サンプルと対物レンズの間にある、媒質の屈折率
θ:サンプルから対物レンズに入射する光の最大角
(sinθの最大値は1)
媒質が空気だった場合、その屈折率はn=1.0ですが、媒質がオイルの場合は、屈折率n=1.52、水の場合は、屈折率n=1.33です。つまり「油浸対物レンズ」や「水浸対物レンズ」では、媒質の屈折率が空気 n=1.0よりも高いため、開口数を1.0より大きくできるのです。
油浸?水浸?対物レンズ選択のコツ
開口数だけでいうと、開口数が大きく高分解能な 「油浸対物レンズ」の方が、明るくシャープな蛍光像が得られます。しかし、すべての場合にそうなるわけではありません。明るくシャープな蛍光像を得るための「液浸対物レンズ」選びのポイントは、下表のようになります。
※ここでは、サンプルの屈折率が、水の屈折率n=1.33に近い場合を想定しています。
油浸対物レンズ N.A. 1.42
|
水浸対物レンズ N.A. 1.2
| |
|---|---|---|
薄いサンプル | ◎ 大変適している | ○ 適している |
厚いサンプル | △ あまり適していない | ○ 適している |
それでは、上記表について、もう少し詳しく見ていきましょう。
1.薄いサンプル、または観察したい部分がカバーガラスに密着している場合
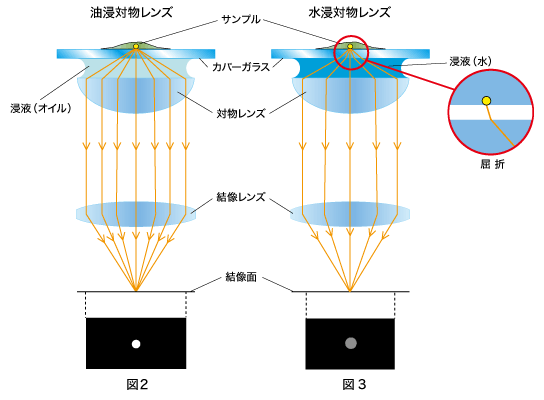
まず、図2の「油浸対物レンズ」の方をご覧ください。
カバーガラスの屈折率はn=1.52程度で、オイル(浸液)の屈折率 n=
1.52とほぼ同じです。そのため、サンプルから発する蛍光は、カバーガラスとオイル(浸液)との境界面でほとんど屈折することなく対物レンズに入ります。これにより「油浸対物レンズ」は、サンプルから発する蛍光を、設計値のNAで結像することができます。
一方、図3の「水浸対物レンズ」の場合はどうでしょう。
この場合、カバーガラスの屈性率 n=1.52と水(浸液)の屈折率
n=1.33が異なるため、サンプルから発する蛍光は、カバーガラスと水(浸液)との境界面で屈折します(図3)。しかし「水浸対物レンズ」は水の屈折率を考慮しているので、「水浸対物レンズ」でもサンプルから発する蛍光を、設計値のNAで結像することができます。
したがって、薄く、カバーガラスに密着しているサンプルを観察する場合は、開口数が大きい「油浸対物レンズ」の方が、明るくシャープな蛍光像を得られることになります。
下の写真は、カバーガラスに密着したPtK2という培養細胞の微小管を、「油浸対物レンズ」と「水浸対物レンズ」とで撮り比べたものですが、開口数の大きい「油浸対物レンズ」(図4)の方が鮮明な像になっていることが見てとれます。
![培養細胞の微小管(カバーガラスに密着したPtk2[表面から約1μm]) 培養細胞の微小管(カバーガラスに密着したPtk2[表面から約1μm])](https://static2.olympus-lifescience.com/data/Image/Learn/04/013/img_03.gif?rev=6B3E) 培養細胞の微小管(カバーガラスに密着したPtk2[表面から約1μm]) | |
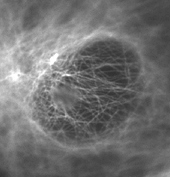 図4 油浸対物レンズ NA 1.42 | 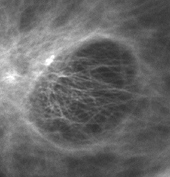 図5 水浸対物レンズ NA 1.2 |
2.厚いサンプルの深部、または観察したい部分がカバーガラスから離れている場合※1
※1 ここでは、サンプルの屈折率が水の屈折率 n=1.33に近い場合を想定しています。
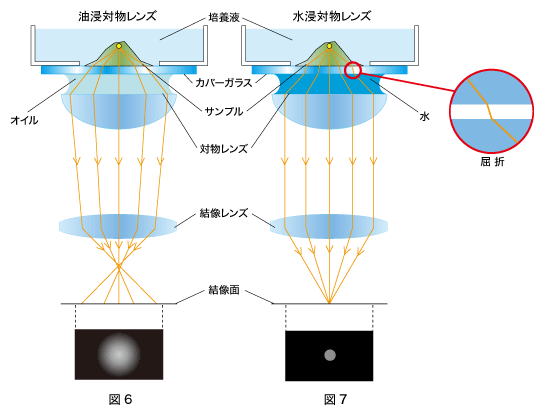
図6の「油浸対物レンズ」の方をご覧ください。
サンプル内部(細胞質など)の屈折率 n=1.33は、カバーガラスの屈折率
n=1.52と異なるため、サンプル内部とカバーガラスの屈折率差により対物レンズに入射する光の条件が設計値より変化し、対物レンズによる球面収差※2が発生してしまいます。その結果、サンプルから発する蛍光は結像面に集まらず、ぼけた像になってしまいます(図6)。
※2 球面収差については、以降の回で説明いたします。
一方、図7の「水浸対物レンズ」の場合はどうでしょう。
サンプルから発する蛍光は、カバーガラスの前後(サンプルとカバーガラス、カバーガラスと浸液(水)の境界面)で屈折を起こしますが、サンプル、カバーガラス、浸液(水)全体を通して見ると、対物レンズに入射する光は、サンプルと対物レンズの間にあるカバーガラスの位置が異なるだけで、光が対物レンズに入射する条件は図3と同じになります。そのため球面収差は発生せず、光は結像面で結像し、はっきりした蛍光像を得ることができます(図7)。
このように、厚いサンプルの深部を観察する場合には、浸液の屈折率がサンプルの屈折率に近い「水浸対物レンズ」の方がボケのないシャープな蛍光像が得られるのです。
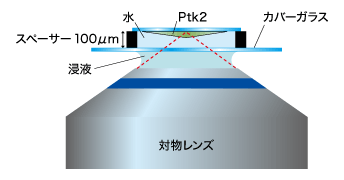
下の写真は、「油浸対物レンズ」と「水浸対物レンズ」の深部観察を比べるため、PtK2という培養細胞とカバーガラスの間にスペーサーを配置し、意図的にカバーガラスからサンプルまでの距離を作って撮り比べたものです。
図9の「水浸対物レンズ」の方が、ボケのないシャープな像になっているのが見てとれます。
 培養細胞の微小管(カバーガラスより100μm離れた位置でのPtk2) | |
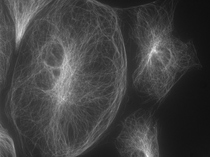 図8 油浸対物レンズ NA 1.42 | 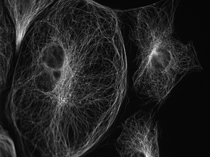 図9 水浸対物レンズ NA 1.2 |
まとめ
薄く広がる培養細胞サンプルなど、見たい部分がカバーガラスに密着している場合は、開口数(NA)が大きい「油浸対物レンズ」が適しており、逆に、厚みのある生細胞サンプル(屈折率が水に近い細胞や胚、線虫など)で、見たい部分がカバーガラスから離れている(サンプル深部)の場合には、そのサンプルの屈折率に近い「水浸対物レンズ」が適していることになります。
以上のように、「油浸対物レンズ」と「水浸対物レンズ」、単純に開口数の大きさだけでは比較することはできないことがお分かりいただけたでしょうか。説得力のある蛍光像を得るためには、見たいサンプルの厚さや深さ、屈折率によって適切に対物レンズを使い分けることも重要なのです。
補足:液浸対物レンズについて
液浸対物レンズの使い方
(1)低倍率の対物レンズから順に高倍率まで標本にピントを合わせていきます。
(2)液浸対物レンズを光路に入れる前に、標本の観察部位上に付属のイマージョンオイル※を点着します。
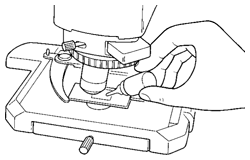
(3)レボルバを回し、液浸対物レンズを光路に入れ、微動ハンドルでピントを合わせます。
(4)使用後、レンズ先端に付着しているイマージョンオイルは極く少量の無水アルコールをガーゼに含ませて入念に拭き取ってください。
※ イマージョンオイル使用上の注意
イマージョンオイルは、必ずメーカー指定のものをご使用ください
揮発性の有機溶剤アニソールは、レンズを構成している部材を侵すことがあるので絶対に使用しないでください
オイルに気泡が入っていると像の見えが悪化しますので、気泡が入らないように注意してください
気泡の有無は接眼レンズを取外して、視野絞りと開口絞りを全開にし、鏡筒内部の対物レンズの瞳(円形に明るく見える)を見ると気泡が見えます
気泡の除去はレボルバを少し回して、液浸対物レンズを1~2回往復させます眼に入ったり、皮膚に付着した場合には早急に以下の処置を行ってください
眼:きれいな水で洗眼(15分以上)
皮膚:水および石けんで洗い流す外観に変化があるか、痛みが続く場合は、ただちに医師の診断を受けてください
本記事で紹介されている製品の関連情報はこちら
对不起,此内容在您的国家不适用。