使用共聚焦显微镜对血管化肿瘤细胞球芯片进行观察研究
研究显示,肿瘤可通过诱导血管生长来支持其旺盛的活性。这些血管作为肿瘤的生命线,在肿瘤微环境(TME)中对于其活性起到了非常重要的作用。到目前为止,对肿瘤在生化和生物力学刺激的反应,大多是在静态条件下进行评估,并没有考虑到血流对肿瘤的影响。本研究中,我们提供了一个肿瘤-芯片平台,通过流经可灌注血管网络的介质流来评估肿瘤微环境,并测量血流中的给药效应。
肿瘤细胞球在微流控设备中的三维观察结果
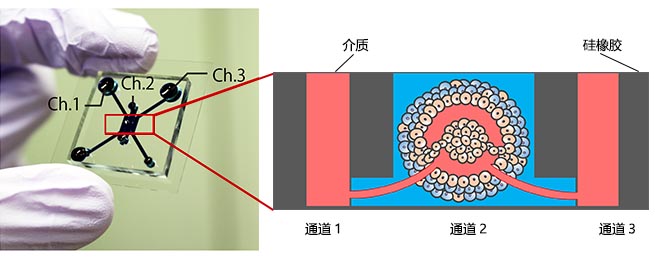
图1.微流控设备和肿瘤模型。
(左)微流控设备图;(右)具有可灌注血管网络的肿瘤模型。
本研究中,我们在微流控设备中将人脐静脉内皮细胞(HUVEC)与含有人乳腺癌细胞(MCF-7)的肿瘤细胞球进行共同培养,以重现包括血管网络在内的肿瘤微环境。为了确认微流控设备中血管网络的可灌注性,我们使用FV3000RS激光扫描共聚焦显微镜观察荧光微球(绿色)是否能够连续通过血管网络和球细胞。因细胞球较厚,我们很难获得培养样本的三维图像。通常需要较高的激发光强度才能产生足以能够检测到的荧光信号强度。但是,较高的激发光强度也会增大光毒性,从而导致细胞损伤。为了解决这一问题,我们使用集成奥林巴斯TruSpectral全真光谱检测技术和高灵敏度GaAsP检测器的FV3000激光扫描共聚焦显微镜,捕获微弱的荧光信号,同时最大程度降低激光器的功率。
(a)
| (b)
|
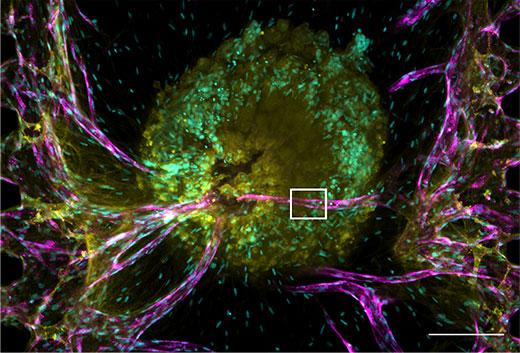
图2.肿瘤细胞球及其血管网络。
细胞核:青色(405 nm,Hoechst 33342);RFP-HUVEC(RFP荧光标记的人脐静脉内皮细胞):magenta(561 nm,RFP);E-钙粘蛋白:黄色(640 nm,Alexa Fluor 633)。
(a) 肿瘤细胞球的投影图。比例尺:200 μm,物镜:UPLSAPO10X2。
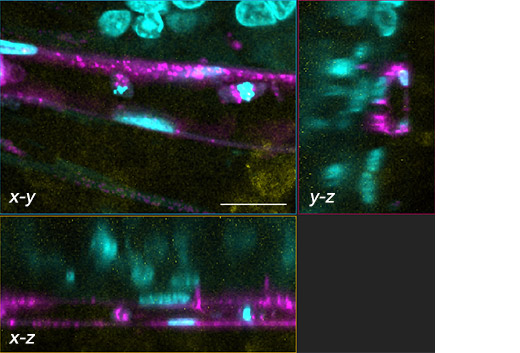
(b) (a)中白框的三平面图像(x-y、x-z、y-z)。比例尺:20 μm,物镜:UPLSAPO40X2。
使用共振扫描振镜进行血流快速成像
我们还利用荧光微球(绿色,直径3.1 μm)检查了肿瘤细胞球血管网络内的血流。在观察快速血流时,常规扫描振镜的扫描速度可能不够。本实验中,我们使用配有高速共振扫描振镜的奥林巴斯FV3000RS共聚焦显微镜采集图像。结果表明,在将荧光微球注入到微流控设备的通道3时,微球流经肿瘤细胞球的中空腔并到达通道1,说明我们所设计的血管网络可接受灌注。确认人工肿瘤细胞球模型用于研究血流对TME影响的有效性后,我们在随后的实验中明确了,在包括血管网络的TME中,药物的疗效因血管内是否存在血流而异。我们希望这款三维模型能够在今后被用作经血管给药模型,以协助药物的开发。
视频:微流控设备上人造血管和肿瘤细胞球内荧光微球的流动。
成像条件:65 ms/帧。比例尺:100 μm
由Yokokawa博士发表评论
这项研究的新颖之处在于,在肿瘤细胞球内,人工构建的可灌注血管网络。可视化血管网络如何连接细胞球和微流控通道非常重要。此外,可以同时观察血管管腔和流经血管结构的血流,对于证明其可灌注性来说也很关键。FV3000共聚焦显微镜上安装的高速共振扫描振镜,能够对血管网络(RFP标记)和微球(绿色)动态流进行成像。
RyujiYokokawa博士1 |
RyujiYuji Nashimoto博士2 |
致谢
本应用说明由以下研究人员协助完成:
京都大学微工程系1
,东北大学跨学科科学前沿研究所(FRIS)2
FV3000共聚焦显微镜为我们的实验提供了哪些帮助
高效GaAsP检测器,全光谱范围支持高灵敏度的活细胞成像
Related Videos |
|
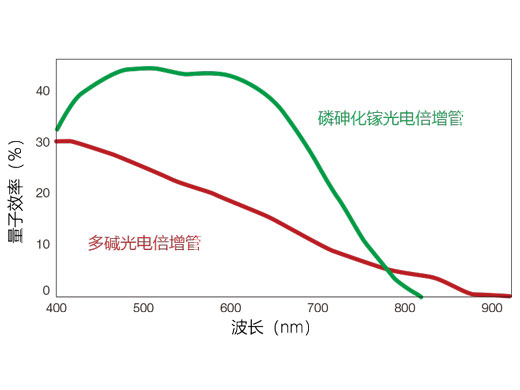
FV3000共聚焦显微镜系列,采用奥林巴斯的TruSpectral全真光谱检测技术,通过一个透射型体相位全息装置光栅对光进行衍射。与传统的反射光栅相比,这一技术支持更高的光通量。FV3000共聚焦显微镜的双通道高灵敏度光谱检测器(HSD)采用TruSpectral及Peltier(固态半导体)制冷的GaAsP PMT检测器,可在较高的信噪比下实现45%的高量子效率。这两种检测技术的组合不仅支持强大的高灵敏度检测,而且最大程度地降低了观察活组织时所需的激光器功率。
两个(高分辨率和高速成像)扫描单元选项
视频:小鼠血管内的血小板凝结成血栓。使用带双通道GaAsP PMT检测器和共振扫描振镜以30帧/秒速度,采集的全画幅图像。 图像数据提供方:Takuya Hiratsuka博士和Michiyuki Matsuda博士,京都大学生物研究研究生院。 | 在两个扫描单元可选:传统常规高分辨扫描振镜(FV3000)或混合常规高分辨扫描振镜/高速共振扫描振镜(FV3000RS)。共振扫描振镜可在512 × 512分辨率的全视场下达到每秒30帧的采集速度,或者在512 × 32分辨率下达到最高每秒438帧的采集速度,从而可拍摄钙离子流等关键的活细胞生理活动。 |
适于这类应用的产品
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
对不起,此内容在您的国家不适用。