使用CM20细胞培养监控系统Part 1比较人类iPS细胞系:观察至iPS细胞衍生肝类器官的分化
简介
在诸如细胞分化和器官形成等胚胎学基础研究中,诱导多能干(iPS)细胞被用于药物发现研究和开发疾病诊断方法。迄今为止,在全球范围已经获得许多iPS细胞系,但不同细胞株之间诸如分化潜力和生长速度等特性各有不同。尽管已经认识到这些差异,但从未使用在相同环境条件下生长的细胞对其进行量化。这样就很难确定这些差异是由实验室之间环境和程序的差异所致,还是源自于细胞系本身的固有特性。即使衍生自iPS细胞的分化细胞特性存在差异,也要等到培养完成后才能够发现,而此时已经被诱导分化的细胞可能会出现异常。在这种背景下,拥有能够对iPS细胞进行长期监控以及分化诱导实验之前整个过程进行有效质量控制和数据管理的工具就显得非常重要。
使用CM20细胞培养监控系统进行定量细胞培养数据分析
通过奥林巴斯CM20细胞培养监控系统提供的定量测量结果,我们分析了iPS细胞所生成类器官发生变化的控制点,并确立一种基于多标本对比的疾病基因组背景分析方法。在本研究中,使用相同过程培养了由不同供体建立的12个人类iPS细胞株,并使用奥林巴斯CM20细胞培养监控系统采集每个细胞系生长过程的数据。
培养方案
使用StemFit AK02N培养基(Ajinomoto Co., Inc.)和iMarix-511(Matrixome Inc.)板包被基质,在无饲养层的条件下在6孔板中维持人类iPS细胞培养物。将其接种到1.0–2.0×104细胞/孔内使用可分离Accutase溶液单细胞传代培养,并在添加Y-27632的StemFit AK02N培养基中培养24小时。之后,通过更换不含Y-27632的StemFit AK02N培养基增殖人类iPS细胞,然后培养其约1周,同时每两天更换一次培养基(图1)。
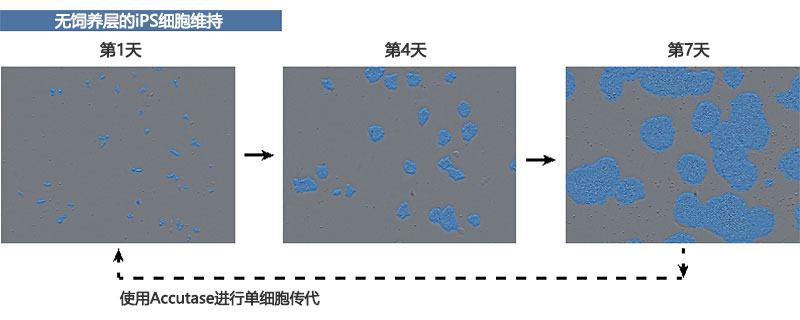
图1. 如何培养人类iPS细胞
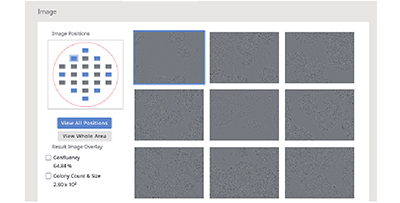
传代后第1、4和7天由CM20监控器采集的人类iPS细胞图像。蓝色区域被监控器自动菌落识别功能识别。
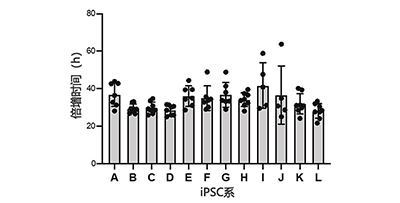
使用CM20系统连续监控12个人类iPS细胞株5到8次传代过程中的生长过程(图2 A,B)。同时对这些iPS细胞系进行了培养基更换和传代培养。我们发现每个iPS细胞在约30小时的倍增时间内增殖,并且iPS细胞系之间的增殖速度略有不同。我们还发现,人类iPS细胞系中存在两次传代之间倍增时间几乎恒定的iPS细胞系(如B株和C株)。这些可以确认诸如培养基更换和传代培养等培养过程的操作正确(图2 C)。
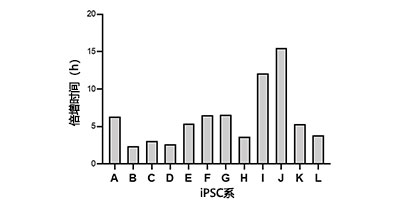
另一方面,某些iPS细胞系(如I型和J型)在每次传代的倍增时间中显示存在较大的差异(图2D)。这些结果表明12个iPS细胞系具有不同的生长特性。
A
| B
|
C
| D
|
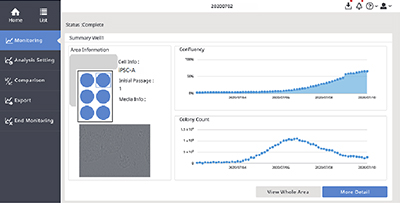
图2. 人类iPS细胞培养维持期间的定量增殖状态监控
(A)CM20监控软件界面。
(B)使用CM20监控器进行单孔观察。每3个小时采集孔内9个视场的图像,并且每天自动对所有采集孔进行扫描。
(C)为每个iPS细胞系绘制多个时间传代的倍增时间。平均值±标准偏差(SD)以条形图形式展示。
(D)每个iPS细胞系的倍增时间变化以标准偏差表示
定量分析的优势
因为CM20监控器可采集有关细胞生长过程的定量数据,所以可以使用相同标准对来自不同细胞系的数据进行测量和比较。使用该监控器可轻松采集单个研究人员在同一过程维持的多个细胞株以及多位研究人员的数据。通过比较细胞图像和生长情况,可以轻松检查该过程是否正确操作。
在过去,当细胞质量发生变化时,很难确定是由于单个细胞系的特性差异所致,还是培养过程中的错误操作造成的。特别是,许多使用iPS细胞的研究需要大量工作才能获得相应的分化细胞。很难测量在iPS培养维持期间可能发生的变化会对分化细胞的评估结果产生怎样的影响。
奥林巴斯将继续研究使用CM20开发有效的质量控制和数据管理方法。
Takebe博士和Yoneyama博士的评论
Takanori Takebe博士(左) | 利用可永久安装在培养箱中的CM20监控器,只需将培养容器或培养皿放在监控器上即可连续监控6至12个iPS细胞株。不必从培养箱中取出细胞即可采集和记录生长数据。这些对于采集有关细胞系之间差异的数据非常有用。此外,随着时间推移,手动拍摄多个细胞株的照片需要花费大量精力,而CM20监控器其中一项功能就是可以自动存储和整理照片。 |
相关内容
适于这类应用的产品
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
对不起,此内容在您的国家不适用。