利用活体多光子显微镜观察流感病毒感染小鼠气道内中性粒细胞与单核细胞/巨噬细胞间的动态相互作用。
体内的先天免疫系统是抵抗病毒感染的第一道防线。其主要功能之一就是将几种类型的白细胞或白血球募集到感染部位(如气道)。包括中性粒细胞和单核细胞/巨噬细胞在内的白细胞均协同强化人体对病毒的防御能力。深入了解这种先天免疫的过程的作用机制,将有助于研究人员开发和提高疫苗和临床治疗方法的有效性。
在本应用指南中,Minsoo Kim博士及其同事使用活体多光子显微镜研究了流感病毒感染小鼠气管内中性粒细胞和单核细胞/巨噬细胞后的体内动力学。3D观察和图像分析展示了此前无法确认的中性粒细胞与单核细胞/巨噬细胞之间相互作用的运动模式。
图像的3D重建揭示了中性粒细胞在流感病毒感染小鼠气管中的迁移。红色,中性粒细胞;白色,血管。比例尺,50μm。tdTomato荧光使用975 nm激发,并在红色通道(575–630 nm)检测。Alexa Fluor 647荧光使用1200 nm激发,并在远红色通道(645–685 nm)检测。(数据来自参考文献[1])
中性粒细胞在流感病毒感染小鼠气管中的迁移
为了可视化受流感病毒感染小鼠气管内的中性粒细胞,使Ly6G-Cre/ROSA-tdTomato小鼠感染流感病毒。感染后3至6天内,出现中性粒细胞和单核细胞的大规模浸润进入气管现象。为了标记血管,成像之前为小鼠静脉注射Alexa Fluor 647偶联的CD31抗体。对麻醉小鼠的经手术插管气管进行活体多光子显微镜检查。如视频1所示,tdTomato +中性粒细胞(红色)和血管(白色)展示了中性粒细胞在流感病毒感染小鼠气管内邻近血管周围的迁移。
中性粒细胞与单核细胞/巨噬细胞之间相互作用的运动模式
为了观察到受流感病毒感染小鼠气管内的中性粒细胞和单核细胞/巨噬细胞,将Ly6G-Cre/ROSA-tdTomato/Csf1r-EGFP小鼠感染流感病毒。中性粒细胞同时表达GFP和tdTomato(显示红色/橙色荧光),而单核细胞/巨噬细胞仅表达GFP(显示绿色荧光)。如视频2所示,在受流感病毒感染小鼠气管内可以看到GFP +/tdTomato +中性粒细胞(红色/橙色)、GFP +单核细胞/巨噬细胞(绿色)和血管(白色)。感染后第五天,大多数单核细胞/巨噬细胞变得不具有运动性,而大多数中性粒细胞仍保持高度运动性,并不断移动到周围的单核细胞/巨噬细胞附近。
中性粒细胞与单核细胞/巨噬细胞在流感病毒感染小鼠气管内的迁移和相互作用。红色/橙色,中性粒细胞;绿色,单核细胞/巨噬细胞;白色,血管。比例尺, 50 μm.GFP和tdTomato荧光均使用975 nm激发,然后分别在绿色通道(495–540 nm)和红色通道(575–630 nm)检测。Alexa Fluor 647荧光使用1200 nm激发,并在远红色通道(645–685 nm)检测。(数据来自参考文献[1])
通过更高倍率的观察,可以发现中性粒细胞与单核细胞/巨噬细胞之间相互作用的更多细节。视频3显示了感染后第六天,小鼠气管内单核细胞/巨噬细胞之间中性粒细胞迁移的3D重建。该视频显示,运动性较强的中性粒细胞(红色)主动接触并进入非迁移状态,周围围绕着单核细胞/巨噬细胞(绿色)。频繁的接触导致单核细胞/巨噬细胞开始吞噬中性粒细胞,揭示了从感染气管内去除死亡中性粒细胞的机制。
图像的3D重建展示了流感病毒感染小鼠气管(感染后第6天)体内中性粒细胞与单核细胞/巨噬细胞之间的相互作用细节。红色,中性粒细胞;绿色,单核细胞/巨噬细胞。GFP和tdTomato荧光均使用975 nm激发,然后分别在绿色通道(495–540 nm)和红色通道(575–630 nm)检测。(数据来自参考文献[1])
FVMPE-RS多光子显微镜如何为实验助力
同时进行多波长多光子成像的FVMPE-RS双激光系统
FVMPE-RS多光子显微镜支持两台独立多光子激发激光器同时进行多波长多光子成像。可在不必重复调谐激光器的情况下同时对每个荧光团使用最佳激发波长。每台激光器的独立功率控制功能能够采集不同荧光团的亮度接近的图像。 |  |
|---|
用于体内小鼠成像的龙门架显微镜系统
龙门架具备适应不同样品的高度灵活性。显微镜下的大尺寸样品空间(640×520×350 mm)特别适合小型动物的体内/活体成像以及此类实验所使用的自制设备。 |  |
|---|
多光子激发专用物镜XLPLN25XWMP2
| 多光子激发专用物镜针对组织深层的多光子成像进行了优化。光学涂层可实现400 nm到1600 nm的良好透射率,从而确保了高效的近红外激发和可见荧光采集。奥林巴斯水浸XLPLN25XWMP2物镜的较高数值孔径(NA 1.05)、较长工作距离(2.0 mm)和宽视场(FN 18 mm)在体内/活体多光子成像中发挥了出色性能。 | 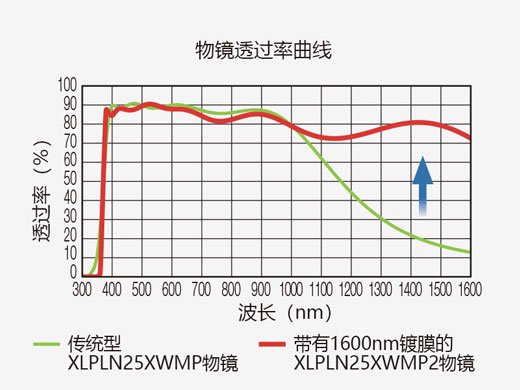 |
|---|
Minsoo Kim博士简介
Minsoo Kim博士是威尔莫特癌症研究所微生物与免疫学系主任兼肿瘤免疫治疗研究计划主任,也是David H. Smith疫苗生物学和免疫学中心成员。他的主要研究领域为先天性和适应性免疫反应以及癌症免疫疗法。在开发可在活细胞和活动物模型中实时观察和控制动态免疫应答的先进成像技术过程中,他为之做了开拓性贡献。 |  |
|---|
致谢
本应用指南的编写得到以下研究人员的协助:美国纽约州罗切斯特大学戴维·H·史密斯疫苗生物学和免疫学中心微生物学和免疫学系的Minsoo Kim博士和Kihong Lim博士。
参考文献
适于这类应用的产品
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
对不起,此内容在您的国家不适用。