Compreendendo a ligação entre dados de imagens digitais e amostras biológicas
Este artigo explora a ligação entre os sinais em amostras biológicas e os dados digitais das câmeras do microscópio. A compreensão desta relação pode ajudá-lo a definir as condições ideais de aquisição de imagens para obter imagens e dados da mais alta qualidade.
Os fundamentos da imagem digital
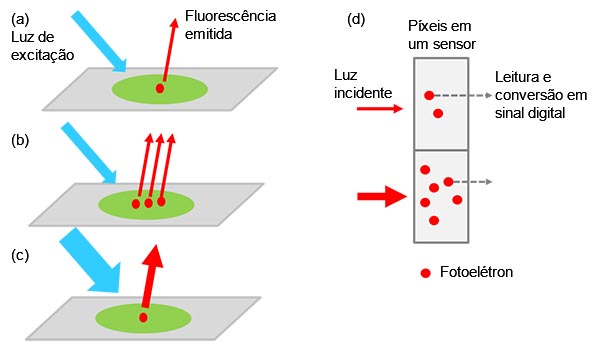
Uma câmera monocromática para microscópio é um dispositivo que detecta e visualiza a luz de amostras biológicas. O microscópio observa a luz de fluorescência emitida pelos corantes ou proteínas de fluorescência; a câmera detecta essa luz e a converte em fotoelétrons para serem detectados como um sinal digital.
O valor do sinal detectado é um multiplicador complexo do número de alvos marcados (por exemplo, proteínas alvo), intensidade da luz de excitação e eficiências de excitação e emissão/detecção de fluorescência, incluindo a eficiência de conversão da câmera de sinal digital em luz (Figura 1).
Quando você usa as mesmas configurações de aquisição de sistema e imagem para amostras diferentes em uma experiência, todos os componentes, exceto a quantidade do alvo, tornam-se valores constantes, tornando o valor do sinal detectado proporcional à quantidade do alvo. Isso significa, por exemplo, que você pode comparar quantitativamente uma amostra editada por genes com seu tipo não alterado.
Figura 1 — Da amostra ao sinal digital: (a) um alvo marcado excitado emite luz de fluorescência. |
A anatomia do sinal e do ruído de fundo
Esta seção explica os principais fatores que contribuem para a qualidade da imagem e destaca a importância de capturar imagens cuidadosamente durante um experimento.
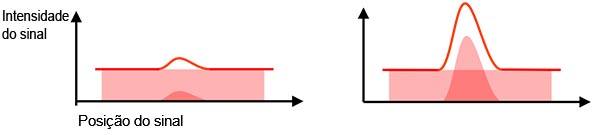
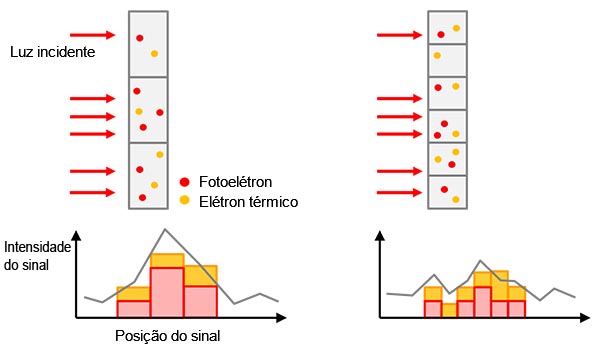
Sinal real versus sinal de fundo: O sinal detectado contém sinal real e sinal de fundo (ruído de fundo). Para detectar seu alvo, identificando-o a partir de sinais de fundo, você precisa de uma proporção alta o suficiente da intensidade real do sinal versus o sinal de fundo (Figura 2). Isso é chamado de relação sinal-ruído (SNR). O objetivo de um SNR mais alto proporciona melhor qualidade de imagem e análises quantitativas.
Em geral, maximizar o sinal real (por exemplo, com uma objetiva de AN mais alta) e minimizar os sinais de fundo (por exemplo, em uma sala escura, um resfriamento mais profundo ou uma câmera de alta eficiência quântica) são maneiras comuns de melhorar o SNR.
Observe que a configuração de ganho, que define o fator de amplificação em uma câmera para sinais, não melhora o SNR porque afeta o sinal real e o sinal de fundo.
Figura 2 — Esquerda: SNR baixo: o ruído de fundo dificulta a identificação do sinal real. |
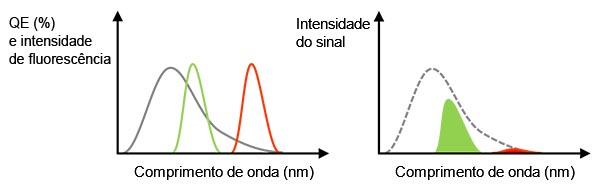
Sinal real: Como mencionamos anteriormente, o uso de uma objetiva de alta abertura numérica pode ajudar a melhorar o SNR. Outro fator importante para obter um sinal mais forte é uma alta eficiência quântica (QE). A QE indica a eficiência de conversão de luz incidente em fotoelétron. Lembre-se de que uma câmera não pode detectar a luz se seu QE for igual zero por cento em um determinado comprimento de onda. Por exemplo, devemos escolher uma câmera com sensibilidade acima de 720 nm para usar corantes de infravermelho próximo (NIR) como Cy7 para uma janela NIR em tecidos biológicos ou para evitar interferência durante a multiplexação.
Figura 3 — Esquerda: a linha cinza é a QE de uma câmera. Linhas verdes e vermelhas indicam espectro de emissão de fluorescência.Direita: o valor do sinal detectado é igual ao tamanho da área, que é um multiplicador dos espectros de QE e fluorescência na figura esquerda.Nesse caso, mesmo que a luz da fluorescência tenha intensidade suficiente, o sinal detectado pode ser fraco para a fluorescência vermelha devido ao baixo QE. |
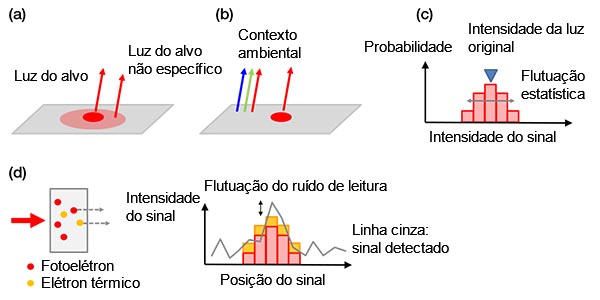
Ruído de fundo: Os sinais de fundo podem ser classificados como:
a) sinais biológicos do fundo
b) sinais não biológicos do fundo
c) flutuação estatística de um fotoelétron (ruído de disparo)
d) ruídos na câmera
O ruído de disparo é único e pode ser comparado a um sorteio. Assim como uma probabilidade de 50% de aparecer “cara” pode levar a “coroa” em dois lançamentos de moedas, qualquer tentativa com o número N tem uma flutuação estatística de ± √ (N). O número detectado de fotoelétrons segue a mesma regra.
Todos os exemplos de ruído de fundo são mostrados na Figura 4 abaixo.
Figura 4 — Exemplos de ruídos de fundo: (a) fundo biológico de uma mancha ou autofluorescência inespecífica, (b) luz ambiente da sala refletida em uma lâmina, (c) ruído de disparo, (d) ruídos em uma câmera que contém elétrons térmicos gerados em um sensor (à esquerda) e ruído de leitura (à direita). Os elétrons térmicos podem ser reduzidos resfriando o sensor. |
Resolução: Um tamanho de píxel maior ou a aquisição de imagens binning podem capturar mais luz e fornecer um SNR mais alto, mas o tamanho maior de píxel diminui a resolução (Figura 5). Considere o melhor tamanho de píxel que se alinha à resolução óptica.
Figura 5 — Esquerda: um tamanho de pixel maior fornece uma sensibilidade mais alta, mas menor resolução. |
Práticas recomendadas para o uso de câmeras de microscópio
Embora as configurações ideais de aquisição de imagens variem dependendo da aplicação e da amostra, dois parâmetros comuns são a intensidade da luz de excitação e o tempo de exposição. Um tempo de exposição mais longo ou uma luz de excitação mais forte fornecem uma fluorescência mais brilhante, levando a um SNR mais alto. No entanto, isso também piora a fototoxicidade. Isso levanta uma questão importante: como você define o melhor parâmetro de aquisição de imagem para obter experiências mais longas de geração de imagens de células vivas enquanto reduz os danos às células causados pela excitação da luz.
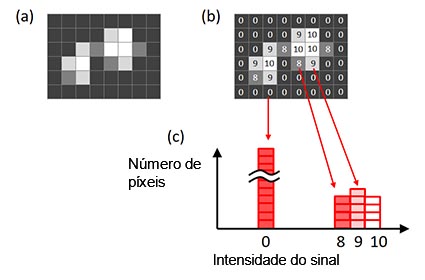
Para determinar o tempo de exposição ideal, use um histograma de imagem. O eixo X do histograma é a intensidade do sinal. A altura do histograma em cada valor X mostra o número de píxeis para a intensidade do sinal (Figura 6).
Figura 6 — Um histograma de uma imagem. (a) Imagem original, (b) intensidade do sinal de cada píxel mostrado na imagem original, |
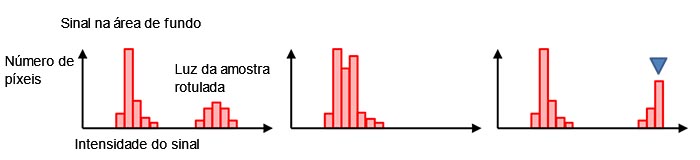
Geralmente, os píxeis de fundo preto têm um valor de sinal digital diferente de zero, mesmo sem luz de fundo (Figura 7, esquerda). Isso ajuda a evitar um sinal de valor negativo causado pela flutuação do ruído de leitura mencionada na Figura 4 (d). A forma e a distribuição do histograma nos dizem se o tempo de exposição atual é apropriado. Se o histograma estiver muito cheio em uma faixa de sinal baixa, o tempo de exposição será muito curto (Figura 7, meio). Se houver uma queda acentuada no nível máximo do sinal, o valor do sinal será saturado (Figura 7, à direita). Nesse caso, você pode reduzir a intensidade da excitação ou diminuir o tempo de exposição.
Figura 7 — Um histograma na exposição normal (esquerda), sob exposição (meio), |
Alguns softwares de aquisição de imagens possuem um recurso de ajuste de exibição automatizado que fornece melhor visibilidade enquanto mantém os dados da imagem original. Na maioria dos casos, o alcance dinâmico do sinal de uma câmera monocromática (por exemplo, 16 bits = 65.536 níveis) é maior que o alcance dinâmico de uma tela, que geralmente é de 8 bits (= 256 níveis).
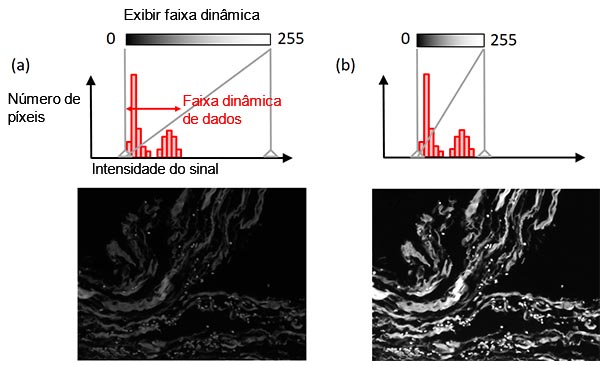
O recurso de ajuste da tela define o link entre a intensidade do sinal e o brilho da tela. Normalmente, a intensidade do sinal mais brilhante em sua amostra é muito menor que a intensidade máxima que a câmera pode suportar. Nesse caso, combinar o intervalo dinâmico da tela com o intervalo dinâmico de dados (o nível do plano de fundo no sinal mais claro) permite obter melhor visibilidade enquanto mantém os dados da imagem original (Figura 8). Um histograma ajuda a ilustrar esse ajuste.
Figura 8 — Ajuste da tela: (em cima) um histograma com o indicador de configuração da tela em uma linha vertical sólida cinza, (no meio) a relação entre o brilho da tela e a intensidade do sinal, (abaixo) a imagem de exemplo. Imagem de exemplo esquerda: configuração original da tela. Imagem de exemplo correta: condição de exibição ajustada enquanto mantém os dados da imagem original. |
6 passos para configurar os parâmetros de aquisição de uma câmera de microscópio
Para resumir, aqui estão seis passos gerais para configurar corretamente uma câmera de microscópio para um experimento. Observe que o melhor procedimento depende da sua aplicação e amostras específicas.
- Determine a ampliação da observação.
- Ajuste o foco na sua amostra e encontre o alvo da observação. Considere o uso de um modo de ganho ou escaneamento mais alto na câmera para reduzir o processo e minimizar a fototoxicidade. Também recomendamos que você use um ajuste de exibição automático ou manual para observar o sinal nas melhores condições e fechar o obturador da luz de excitação sempre que não estiver observando a imagem.
- Defina novamente o modo de ganho e binning para aquisição de imagens.
- Tente a intensidade de luz de excitação mais suave e verifique se consegue observar o sinal em um tempo de exposição realista. Se você não conseguir identificar o sinal ou se o SNR estiver muito baixo, tente um tempo de exposição mais longo.
- Se o tempo de exposição for extremamente longo ou maior que o tempo máximo de exposição permitido para a velocidade de aquisição da imagem, tente uma intensidade de excitação um pouco maior, passo a passo.
- Verifique o histograma para confirmar que não há saturação.
Conclusão
Embora muitos fatores complexos contribuam para a qualidade da imagem e dos dados no processo de microscopia, conhecer essas dicas e conceitos básicos de imagem digital pode ajudá-lo a determinar a melhor configuração de aquisição para cada experimento. Maximizar o sinal, minimizar o fundo e otimizar a condição da amostra são elementos essenciais para melhorar a qualidade dos dados para qualquer aplicação e experimento.
Autor
 |
Takeo Ogama
Divisão de soluções científicas OLYMPUS CORPORATION OF THE AMERICAS |
Sorry, this page is not
available in your country.