Conor L. Evans, PhD é professor, pesquisador e especialista em microscopia que aplica seus conhecimentos e habilidades de resolução de problemas para desenvolver novas ferramentas ópticas e de formação de imagem para atendimento de pacientes. Sentamos com Conor para discutir sua trajetória como pesquisador clínico, a importância da microscopia em seu trabalho e como ele usa os sistemas para resolver desafios em medicina e biologia. Saiba mais sobre Conor e leia sua entrevista abaixo.
Sobre Conor L. Evans
O Dr. Conor Evans é bacharel em física química pela Brown University e PhD em química pela Harvard University. Ele é professor associado da Harvard Medical School, membro do corpo docente afiliado do Harvard University Biophysics Program e membro do corpo docente do Laser Biomedical Research Center.
Conor lidera o Evans Lab no Wellman Center for Photomedicine no Massachusetts General Hospital (MGH). O laboratório desenvolve e usa uma variedade de ferramentas e métodos de microscopia para detectar, medir e quantificar informações ocultas para atender às necessidades não atendidas no tratamento de pacientes. As pesquisas e inovações no laboratório lhe renderam inúmeros prêmios e patentes enquanto ele trabalha para traduzir suas tecnologias para a clínica.
P: Sua formação acadêmica é em físico-química e química. Como a sua trajetória o levou a se focar na pesquisa relacionada ao tratamento de pacientes? E como você aprendeu tanto sobre microscopia?
Conor: Sempre me interessei por biomedicina e estava pensando em me formar em neurociência antes de me apaixonar por química e físico-química. Quando comecei meu doutorado, eu queria trabalhar em pesquisa aplicada e interdisciplinar, onde a físico-química pudesse ser uma ponte para resolver problemas maiores.
Juntei-me ao laboratório de Sunney Xie em Harvard, onde tive a incrível oportunidade de trabalhar como parte da sua equipe desenvolvendo o efeito coerente anti-Stokes Raman (CARS) em uma técnica de microscopia robusta para biomedicina. No laboratório de Sunney, tive a sorte de trabalhar de perto com Eric Potma enquanto ele fazia o seu pós-doutorado, que me ensinou praticamente tudo o que sei sobre microscopia. Devo ter construído, demolido e reconstruído cerca de 15 microscópios com o Eric durante um período de três anos!
Eu poderia ter continuado em mais pesquisas acadêmicas em química se não fosse por duas coisas. Primeiro, Sunney viu meu interesse em pesquisa aplicada e me encorajou a explorar as aplicações médicas da microscopia CARS. Quando comecei a ver todas as oportunidades, fiquei viciado! Segundo, fui inspirado pelo meu irmão, que se tornou médico de atendimento de emergência. Sua paixão pelo atendimento aos pacientes me levou a dar um voto de confiança em um pós-doutorado no Massachusetts General Hospital (MGH), onde tive a chance de trabalhar em pesquisa focada no paciente pela primeira vez.
P: Você pode nos contar quais são as áreas de foco do seu laboratório? O que você espera realizar através de cada programa de pesquisa?
1. Sensores de oxigênio
Conor: O trabalho do meu laboratório em sensores de oxigênio está focado no desenvolvimento de novos kits de ferramentas para medir quantitativamente a concentração de oxigênio nos tecidos, mais conhecido como pO2. Embora este programa de pesquisa tenha começado em resposta aos desafios da terapia do câncer, nosso foco mudou depois que tive a oportunidade de visitar o Center for the Intrepid no San Antonio Medical Center.
Conhecer soldados feridos e conhecer a miríade de desafios do tratamento deles levou minha equipe e eu a lançar um programa de pesquisa para desenvolver sensores moleculares de oxigênio que pudessem ser aplicados diretamente ao tratamento de pacientes. Junto com Manolis Rousakis, um instrutor da minha equipe, criamos uma família de sensores de oxigênio porfirina ultrabrilhantes e aprendemos a incorporar e conjugar esses sensores em uma ampla variedade de materiais e fatores de forma para ver e quantificar diretamente o oxigênio dos tecidos.
Criamos filmes, bandagens pintáveis e pulverizáveis, materiais para bandagens de hidrogel, sensores vestíveis e, mais recentemente, sensores baseados em agulhas e cateteres, cada um visando diferentes necessidades de assistência médica militar e de pacientes. Agora estamos trabalhando com parceiros comerciais para traduzir essas tecnologias em produtos reais para melhorar a saúde do paciente.
2. Ferramentas para visualizar e medir a absorção de medicamentos e efeitos terapêuticos in vivo
Conor: Um dos maiores desafios no desenvolvimento de medicamentos é garantir que eles realmente atinjam seus alvos celulares e subcelulares. Embora moléculas maiores, como as biológicas, possam ser prontamente marcadas, isso pode ser um desafio para medicamentos de moléculas pequenas, pois os marcadores tradicionais podem ser maiores do que a própria molécula e alterar completamente sua farmacocinética. Abordagens como marcação radiográfica e métodos espectrais de massa oferecem informações sobre a absorção de medicamentos, mas essas abordagens não são compatíveis com a pesquisa clínica ou exigem biópsia.
Estamos interessados em abordagens que permitem formações de imagens e quantificação de medicamentos com base nas propriedades intrínsecas da molécula, como parâmetros de fluorescência e vibrações químicas. Estamos desenvolvendo abordagens de formação de imagem que usam a vida útil fluorescente e abordagens de formação de imagem Raman coerentes com aplicações atuais na quantificação da tópica da pele. Trabalhando em estreita colaboração com parceiros comerciais e com a Food and Drug Administration (FDA) dos Estados Unidos, estamos criando novas abordagens de imagem Raman coerentes para medir a biodisponibilidade de medicamentos, bem como a bioequivalência, sendo que esta última pode ser uma ferramenta importante para o desenvolvimento de medicamentos tópicos genéricos.
Para mover essas ferramentas do laboratório para a clínica, construímos um sistema Raman coerente baseado em carrinho que deve ser usado nos primeiros estudos clínicos em humanos nos próximos meses. Nosso objetivo é emparelhar a observação da absorção de medicamentos com os efeitos terapêuticos a jusante para construir uma compreensão abrangente do nível celular para o tecido da resposta ao tratamento farmacológico. Vemos essa abordagem de formação de imagem clínica como o primeiro passo para avaliar diretamente a absorção de medicamentos em indivíduos saudáveis e em pacientes doentes para construir melhores terapias e intervenções.
3. Análise de imagem de aprendizado profundo
Conor: O aprendizado profundo tem sido uma ferramenta fantástica para superar alguns de nossos maiores desafios tanto na análise de imagens quanto na análise de sinais. Nossos microscópios e sensores geram enormes quantidades de dados, às vezes centenas de gigabytes por dia, que exigem análises automatizadas.
Simplesmente não há como uma pessoa, ou mesmo uma equipe de cientistas, classificar manualmente tantos dados de imagem. Era frustrante trabalhar com a visão da máquina e métodos de análise computacional que, embora eficazes, podiam falhar ou introduzir vieses na análise, principalmente quando eu podia apenas olhar para uma imagem e saber instantaneamente o que deu certo ou o que deu errado.
O aprendizado profundo nos permitiu levar nossa experiência e intuição e transferir esse conhecimento para um computador, permitindo a automação total de nossas complexas tarefas analíticas. Conseguimos aplicar o aprendizado profundo no nosso trabalho em farmacocinética, bem como em novas áreas, como nossos sensores de oxigênio vestíveis. Estamos empolgados em buscar avanços na computação de ponta, onde modelos de aprendizado profundo podem ser usados diretamente em dispositivos em aplicações que vão desde o desenvolvimento de medicamentos até sensores vestíveis na medicina.
P: Qual é um tópico de pesquisa que o revigora ou uma questão importante que você adoraria resolver?
Conor: Eu diria que um tema recorrente na minha pesquisa é tornar o "invisível" visível e quantificável. Sempre me interessei em capturar informações que normalmente estão ocultas ou fora de alcance. É uma espécie de curiosidade profissional. Minha equipe e eu trabalhamos para criar métodos, ferramentas e sensores para descobrir esses parâmetros e torná-los quantificáveis, sejam eles a concentração de oxigênio nos tecidos, a quantidade de medicamento que atinge um alvo ou o status de uma célula em terapia.
P: O que o inspirou a procurar informações ocultas ou "invisíveis"?
Conor: Durante meu doutorado, trabalhei em um problema desafiador em formação de imagens Raman coerentes, que era a supressão da contribuição não ressonante na microscopia CARS. A formação de imagem CARS sofre com essa contribuição quimicamente inespecífica que foi uma grande barreira para aplicações em biologia e medicina.
Uma maneira pela qual supusemos que esse histórico poderia ser identificado e eliminado era por fase: a contribuição não ressonante era matematicamente "real", enquanto a contribuição ressonante quimicamente específica tinha contribuições matematicamente "reais" e "imaginárias". Encontramos uma maneira de isolar esses dois componentes (em particular, o componente de imagens do campo CARS) e suprimir a contribuição não ressonante por meio da interferometria. Brian Saar, então aluno do laboratório de Sunney, brincou dizendo que eu havia "tornado o imaginário real", o que eu amei e levei a sério conforme continuei a minha carreira.
P: O que você está procurando aprender com a sua pesquisa? Como a microscopia entra nisso?
Conor: Há tanta coisa que eu quero aprender! Um dos aspectos empolgantes e desafiadores de trabalhar tão perto com médicos todos os dias é que você se sente infinitamente pequeno pelo o que simplesmente não é conhecido ou compreendido na medicina e na biologia. Há um poço sem fundo de problemas a serem resolvidos. Espero continuar focando na solução de problemas na saúde e medicina humanas, aproveitando tanto a fotoquímica quanto a fotônica (dois kits de ferramentas complementares que são eminentemente traduzíveis).
A microscopia está na interseção da fotoquímica e da fotônica. O primeiro fornece contraste molecular. O segundo oferece os meios para ver, detectar e quantificar. Para mim, a microscopia é o eixo da minha pesquisa, pois nos dá a oportunidade de entender diretamente os processos espaço-temporal, sejam eles em tecidos ou em células.
Muitos de nossos objetivos de pesquisa de curto e longo prazo são impulsionados por avanços contínuos em técnicas microscópicas, como nossos esforços em farmacologia e biologia do câncer. Esses benefícios vão além dos microscópios no nosso trabalho em bandagens e sensores vestíveis. Muitas vezes recorremos à imagem e à microscopia para entender os métodos de fabricação, as propriedades do material e afins. Isso torna a microscopia um recurso central em nossos esforços de pesquisa orientados a problemas.
P: Como você usa a formação de imagens multifótons e confocais no seu trabalho?
Conor: Eu diria que a formação de imagem multifóton tem sido o principal aspecto da minha pesquisa, com a confocal desempenhando um importante papel de apoio. A formação de imagem Raman coerente, uma ferramenta central no nosso trabalho, é uma técnica multifóton que fornece muitas das principais vantagens da formação de imagem de dois e três fótons: excitação de luz infravermelha próxima, formação de imagem de tecido profundo e seccionamento automático de profundidade. Desenvolvemos formação de imagens Raman coerentes (CARS e efeito Raman estimulado (SRS)) como ferramentas de pesquisa biomédica que agora estão à beira de aplicações clínicas diretas em humanos.
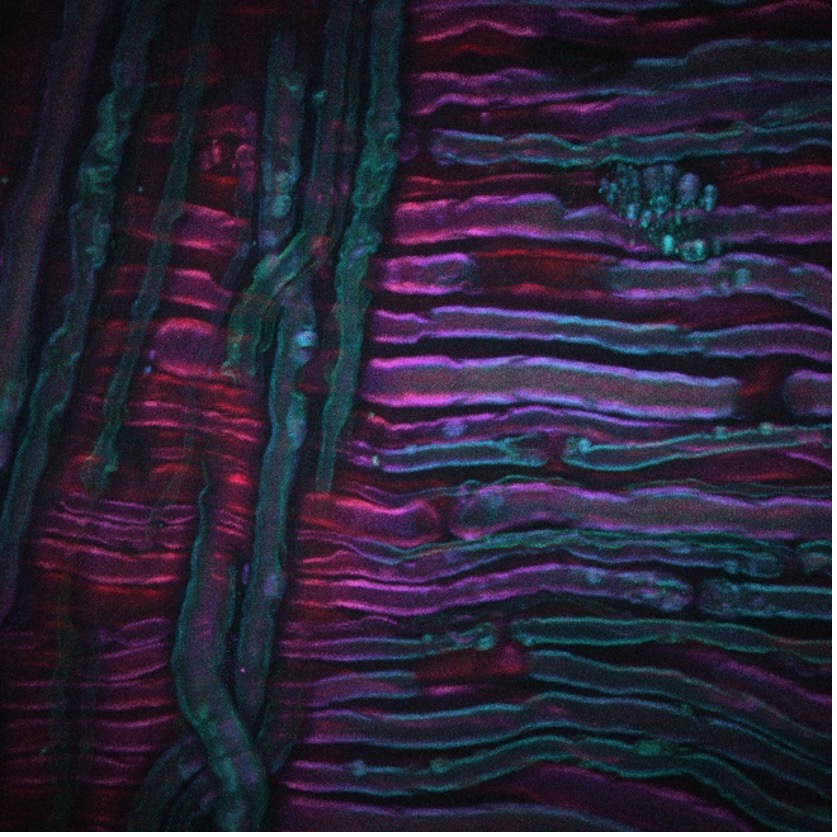
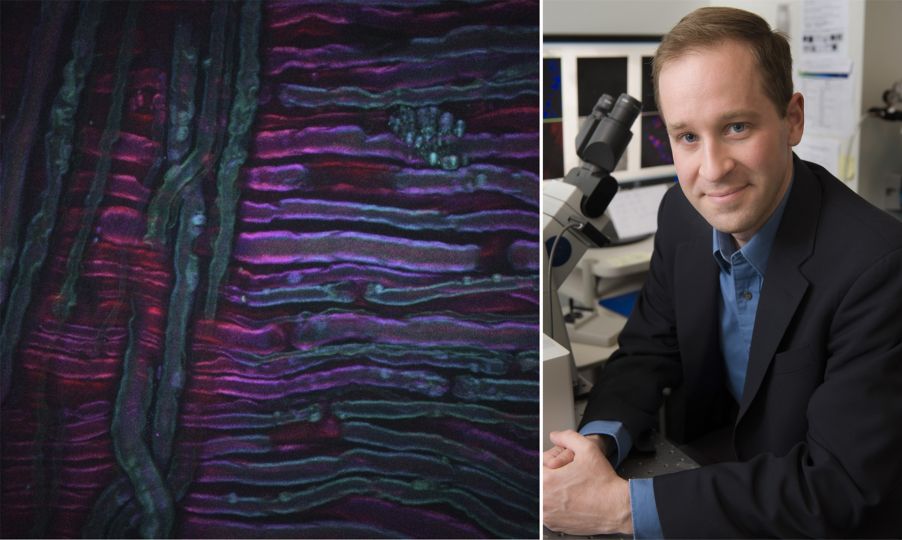
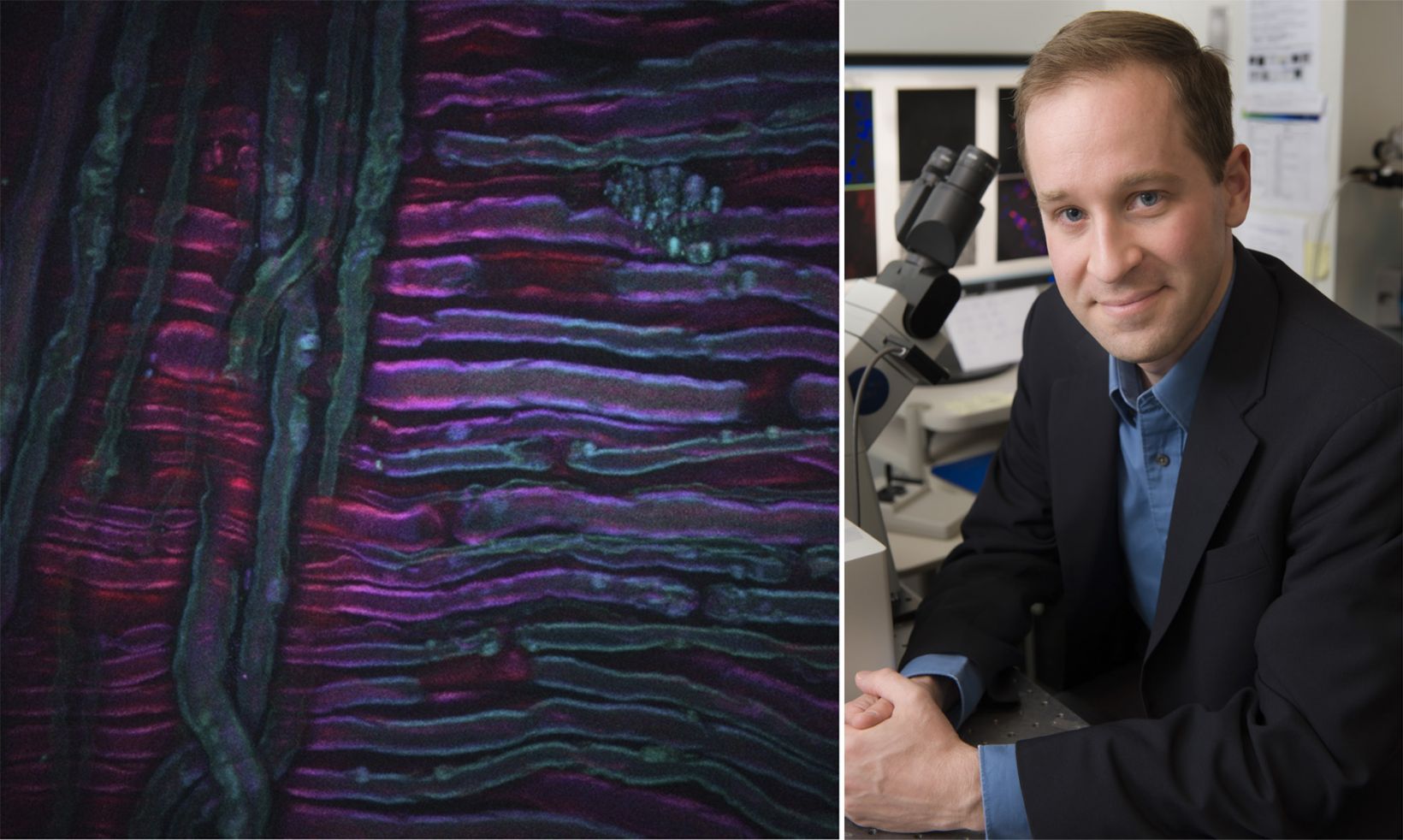
Como exemplo, a imagem acima mostra uma imagem CARS adquirida do nervo ciático de um rato que passou por terapia a frio, uma nova técnica para o tratamento da dor que está sendo desenvolvida por nossas colaboradoras Lilit Garibyan e Rox Anderson aqui no MGH. O sistema de formação de imagem CARS foi ajustado no trecho simétrico CH2 de lipídios insaturados, revelando a distribuição da mielina. O crédito da imagem vai para Isaac Pence, PhD, pesquisador da minha equipe, e a imagem não teria sido possível sem Sara Moradi Tuchayi, MD.
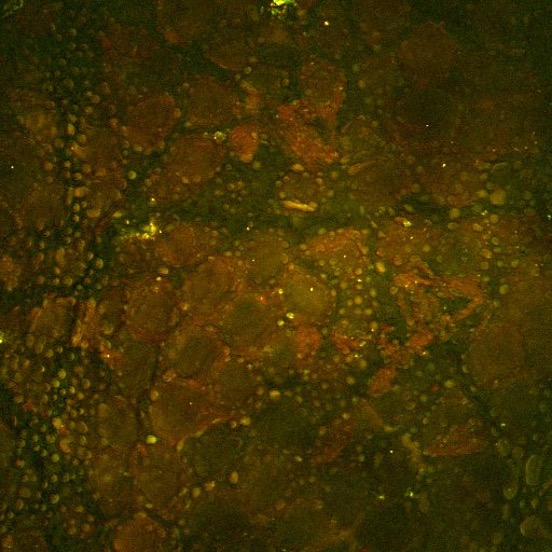
Este segundo exemplo, mostrado acima, é uma imagem SRS do medicamento ruxolitinib (verde, SRS ajustado na banda vibracional nitrílica) administrado em etanol na superfície da pele do camundongo. Aqui, o medicamento pode ser visto acumulado dentro das características ricas em lipídios do estrato córneo do camundongo via SRS ajustado na vibração de alongamento simétrico CH2 (vermelho). O crédito da imagem vai para Amin Feizpour, PhD, que foi um dos pesquisadores da minha equipe.
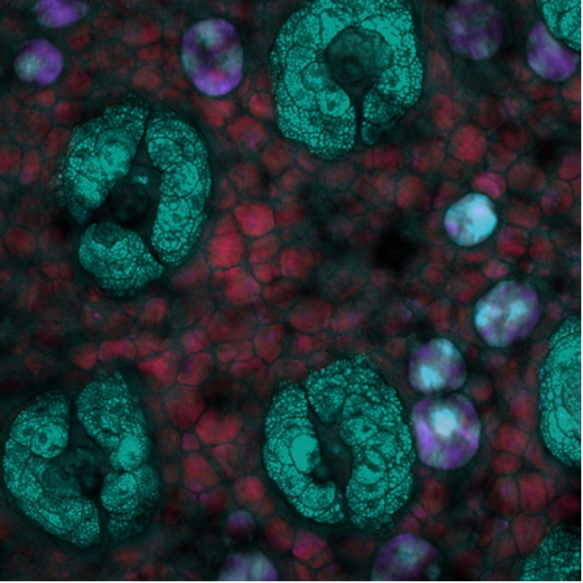
Por último, esta imagem de profundidade SRS foi adquirida na pele do camundongo onde a profundidade é codificada por cores. Aqui, estruturas únicas ricas em lipídios dentro da pele do camundongo podem ser vistas em diferentes profundidades com o sistema ajustado na vibração de alongamento simétrico CH2. O crédito da imagem vai para Isaac Pence, PhD.
P: Você pode compartilhar algum marco notável?
Conor: Este ano marcará alguns grandes marcos para nossa equipe, tanto em nossos programas de microscopia quanto em nossos estudos de sensoriamento. Publicamos nosso primeiro estudo em humanos do nosso kit de ferramentas de detecção de oxigênio na Science Advances e agora estamos realizando três estudos humanos adicionais dessa nova plataforma de detecção. Iniciamos uma nova colaboração com a 3M para traduzir essas ferramentas do nosso laboratório para produtos.
No lado da microscopia, estamos empolgados em publicar nossa nova abordagem chamada efeito Raman estimulada por amostragem espectral dispersa (S4RS), que supera muitas das barreiras que enfrentamos em formação de imagens Raman coerentes nos últimos anos. Essa abordagem usa uma fibra laser rapidamente sintonizável para saltar para bandas Raman específicas em todo o espectro Raman, em vez de sintonizar toda a extensão. Isso permite a aquisição espectral rápida e quimicamente específica em todo o espectro Raman e abre as portas para a formação de imagens e quantificação de uma ampla variedade de espécies moleculares, como medicamentos e metabólitos. Paralelamente, usamos esse sistema de laser para construir um sistema de formação de imagem Raman clínico coerente, que será lançado nos primeiros estudos em humanos este ano.
Apesar dos desafios causados pelo COVID-19, minha equipe fez um trabalho extraordinário na tradução das nossas tecnologias. Estou muito orgulhoso do que eles realizaram.
P: Qual você acha que será a próxima revolução na microscopia?
Conor: Do meu ponto de vista, um grande problema na microscopia é a enxurrada de dados que recebemos. Os microscópios multicanais automatizados são fantásticos para coletar grandes quantidades de dados. Desenvolvemos protocolos de formação de imagem que permitem que várias colorações, fluoróforos, canais espectrais e outros pontos de dados sejam coletados de forma rápida e eficiente.
Entretanto, isso traz consigo o desafio de extrair informações reais dos enormes conjuntos de dados que adquirimos. Os dados de microscopia são repletos de informações. Coletar conjuntos de dados de cinco dimensões é relativamente simples e esses dados são espaciais, espectrais e temporais. Embora às vezes seja possível classificar esses dados manualmente, insights profundos e rigor estatístico exigem análise computacional desses dados multidimensionais complexos.
Acredito que a próxima revolução na microscopia superará esses problemas de big data e isso já está acontecendo agora. Avanços na visualização de dados, nos algoritmos de análise de imagens e no aprendizado de máquina estão desempenhando um grande papel ao enfrentar os desafios de dados médios a grandes de microscopia. Vejo trabalhos de neurocientistas guiando esta trajetória com projetos de conectomas e atlas cerebrais que mostram o que pode ser feito.
No entanto, esses programas são grandes esforços com uma infinidade de pesquisadores interdisciplinares, cientistas de dados e programadores que auxiliam e impulsionam o progresso. Porém, neste momento, esses recursos não estão disponíveis para laboratórios menores. Isso é agravado pelo fato de que a trajetória tradicional de treinamento de pesquisadores em microscopia ainda não ensina universalmente as habilidades necessárias para lidar com conjuntos de dados de formação de imagens grandes e complexos. Embora essa revolução já esteja acontecendo, ela terá novas perspectivas em como treinamos nossos alunos e colegas, bem como abordamos os dados de microscopia para proporcionar esses avanços a todos que trabalham em microscopia.
Essa revolução é particularmente importante para o futuro translacional da microscopia, onde a formação de imagem em microescala desempenhará um papel cada vez mais importante em tudo, desde diagnóstico de doenças até terapias personalizadas. Já temos as "pílulas" habilitadas para microscopia de Gary Tearney que podem ser engolidas para fornecer diagnóstico in-situ, análise por citometria de fluxo de formação de imagem de células derivadas de pacientes e triagem terapêutica de células CAR-T de alto rendimento.
À medida que essas plataformas baseadas em microscopia se expandem para ainda mais aplicações em pacientes, a enxurrada de dados só aumentará e a necessidade de domar e lidar bem com esses conjuntos de dados se tornará cada vez mais importante.