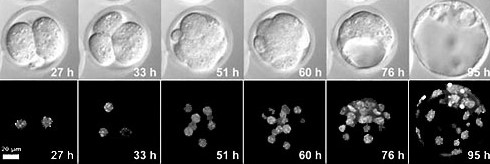
Como as instituições de pesquisa limitam o tempo gasto no laboratório para praticar o distanciamento social e ajudar a manter a equipe segura, ter a capacidade de automatizar e agilizar tarefas por meio de imagens de células vivas é mais importante do que nunca para permanecer produtivo.
Ainda assim, há muitas considerações a se levar em conta para otimizar seu equipamento e evitar situações inesperadas que possam exigir o retorno ao laboratório.
Aqui estão 4 dicas a serem consideradas:
1. Mantenha as amostras saudáveis em um ambiente aquecido e estável.
Um dos maiores desafios durante a geração de imagens de células vivas é o de manter suas amostras saudáveis e se comportando normalmente na platina do microscópio — fora de sua incubadora quente e confortável.
Embora isso possa ser complicado, você pode manter suas amostras o mais confortável possível usando incubadoras na parte superior da platina do microscópio ou incubadoras fechadas que podem fornecer temperatura, umidade e densidade de CO2 estáveis para as células.
E não se esqueça de aquecer sua objetiva — esta é uma fonte comum de contato frio para as amostras que podem prejudicar a saúde delas.
Lembre-se também de que a região periférica das microplacas pode ter um risco maior de flutuação ambiental do que a região central, portanto, certifique-se de usar os poços centrais e evite os poços ao redor da borda para melhorar a estabilidade. Por exemplo, se você estiver usando uma placa de 96 poços (12 × 8 poços), use apenas os 60 poços centrais (10 × 6 poços) para o experimento.

Figura 1. Incubadora na parte superior da platina.
2. Proporcione uma temperatura ambiente estável para melhorar o foco.
Outro fator a ser considerado é a temperatura da sala, pois uma pequena mudança pode afetar o desempenho da imagem.
A estabilidade da temperatura ambiente para o seu microscópio é especialmente crítica para a observação de alta ampliação de células vivas. Como a observação de alto AN tem uma profundidade de campo rasa, seu sistema pode perder o foco mesmo com um pequeno desvio Z causado pela mudança de temperatura.
Para otimizar o ambiente, certifique-se de que seu ar-condicionado esteja funcionando e que a temperatura ambiente esteja estável antes de iniciar o experimento. Além disso, evite o fluxo de ar direto do ar-condicionado para o microscópio para melhorar a estabilidade.
3. Defina o foco e o colar de correção com precisão para aprimorar a qualidade da imagem.
Outra maneira de lidar com a flutuação temporal, como o desvio Z, é começar o experimento com células vivas definindo o foco e o colar de correção da forma mais precisa possível.
Frequentemente, os pesquisadores ajustam o foco com cuidado, mas esquecem o colar de correção. Ainda, o colar de correção pode melhorar significativamente a qualidade da imagem, particularmente durante a observação de tecido profundo ou ao usar uma objetiva de alta NA*.
A posição ideal do colar de correção depende de muitos fatores, como o índice de refração da amostra, a profundidade do plano de observação e a espessura da tampa de vidro. Mesmo que a maioria das lamínulas e pratos com fundo de vidro tenham uma espessura de 170 µm (#1,5), isso pode flutuar e, mais importante, não podemos assumir esses valores com recipientes de plástico.
Por isso, sempre ajuste o colar de correção com precisão verificando o contraste da imagem, principalmente quando se utiliza microplacas ou pratos de plástico.
Normalmente, a correção do colar deve ser feita no local. Para experimentos que precisam de ajustes proativos de colar de correção, como observação profunda com um microscópio multifóton, isso pode significar mais tempo no laboratório. A boa notícia é que você pode automatizar esses ajustes com um colar de correção motorizado.

Figura 2. Colar de correção em uma objetiva com o indicador de espessura de lamínula.
Para saber mais sobre sistemas de lentes motorizadas para imagens profundas, leia nossa postagem no blog: Como melhorar a profundidade em imagens na microscopia microscópio multifóton.
4. Use um módulo de foco dedicado para manter as amostras em foco.
Mas e se ocorrer desvio Z?
Mesmo fazendo tudo isso, sua imagem às vezes pode estar desfocada. Afinal, muitos fatores podem causar o desvio Z. Ele pode ser causado por uma mudança proativa e intencional, como a adição de regentes, bem como pela vibração física por que alguém entrou na sala ou por causa da mudança de temperatura ambiente.
E embora a maioria dos microscópios motorizados contenha um recurso de foco automático baseado em contraste de imagem, eles têm suas limitações:
- Faixa limitada de capacidade de ajuste
- A luz de excitação para focagem baseada em contrato causa fototoxicidade
Uma maneira de ajudar a garantir o foco durante os experimentos com células vivas é usar um módulo de foco dedicado como nosso compensador TruFocus de desvio Z baseado em laser infravermelho próximo (NIR). A luz NIR também pode ajudar a minimizar a fototoxicidade e a interferência no comprimento de onda da imagem durante a observação prolongada.
Enquanto o modo de foco automático (AF) de disparo único do módulo evita iluminação desnecessária, o modo AF contínuo pode ser usado para observação ao vivo ou aquisição de imagem contínua de fenômenos rápidos.

Figura 3. Mantenha suas amostras em foco nítido usando o compensador Olympus TruFocus Z-drift.
Você pode ver como a compensação de desvio Z funciona nas imagens de longo prazo, assistindo ao breve vídeo abaixo:
Mantenha a produtividade executando experimentos eficientes com células vivas
Sempre tem algum trabalho a ser feito — portanto, esperamos que essas dicas ajudem você a se manter produtivo, obter imagens de células vivas por mais tempo e continuar sua ciência. E se você tiver alguma dúvida sobre como automatizar seu laboratório, não hesite em dirimi-la!
Conteúdo relacionado
Como melhorar a formação de imagem em profundidade na microscopia multifóton
Seis dicas para formação de imagem de fluorescência de células vivas