Observação de um esferóide tumoral vascularizado em um chip com um microscópio confocal
Estudos mostram que os tumores induzem o crescimento dos vasos sanguíneos para apoiar a atividade tumoral vigorosa. Esses vasos sanguíneos servem como linhas de vida do tumor e desempenham um papel importante no microambiente tumoral (TME) para apoiar essa atividade. Até agora, as respostas do tumor a estímulos bioquímicos e biomecânicos foram avaliadas em condições estáticas e não conseguiram incorporar os efeitos do fluxo sanguíneo aos tumores. Neste estudo, apresentamos uma plataforma tumor-on-a-chip que permite a avaliação de um microambiente tumoral com fluxo de mídia através de uma rede vascular perfusável e medir os efeitos da administração de medicamentos incorporados ao fluxo sanguíneo.
Observação 3D do esferóide tumoral no dispositivo microfluídico
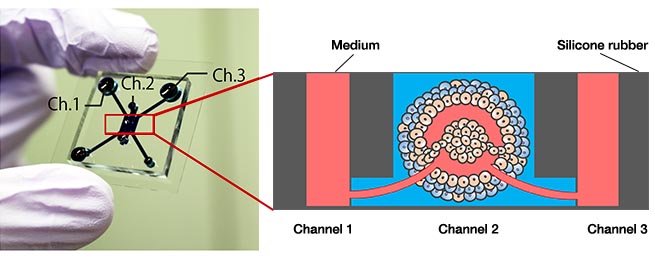
Figura 1. Dispositivo microfluídico e modelo de tumor.
(Esquerda) Imagem do dispositivo microfluídico, (direita) modelo de tumor com uma rede vascular perfusável.
Neste estudo, recapitulamos o microambiente tumoral, incluindo a rede vascular, pela cocultura de células endoteliais da veia umbilical humana (HUVEC) com esferóides contendo células de adenocarcinoma de mama humano (MCF-7) em dispositivos microfluídicos. Para confirmar a perfusabilidade de uma rede vascular no dispositivo microfluídico, observamos se esferas fluorescentes (verdes) passaram continuamente pela rede vascular e esferóide usando o microscópio confocal FV3000RS. As amostras de cultura 3D são difíceis de visualizar devido à espessura da massa. Normalmente, é necessária uma intensidade de luz de excitação mais alta para produzir um sinal fluorescente suficientemente forte para detecção. Contudo, uma luz de excitação mais alta também aumenta a fototoxicidade, resultando em danos nas células. Para superar isso, usamos o microscópio confocal FV3000, que incorpora a tecnologia de detecção TruSpectral da Olympus e detectores GaAsP de alta sensibilidade, para capturar sinais fluorescentes fracos e minimizar a potência do laser.
(a)
| (b)
|
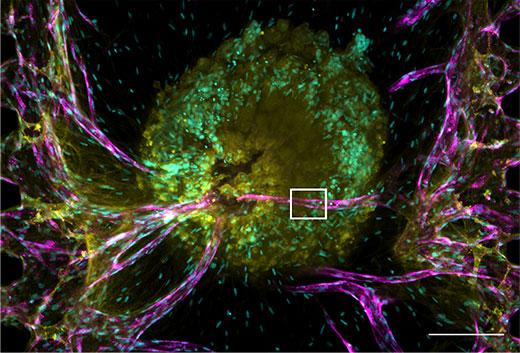
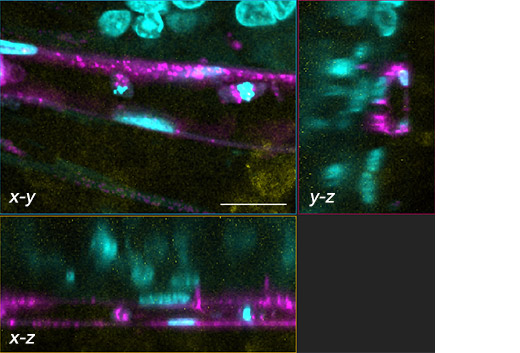
Figura 2. O esferóide tumoral e sua rede vascular.
Nuclear: ciano (405 nm, Hoechst 33342), RFP-HUVEC: magenta (561 nm, RFP), E-caderina: amarelo (640 nm, Alexa Fluor 633).
(a) Imagem de projeção do esferóide tumoral. Barra de escala: 200 μm, objetiva: UPLSAPO10X2.
(b) imagem em 3 planos (xy, xz, yz) da moldura branca em (a). Barra de escala: 20 μm, objetiva: UPLSAPO40X2.
Imagem rápida do fluxo sanguíneo usando o escâner ressonante
Também examinamos o fluxo na rede vascular do esferóide tumoral usando microesferas fluorescentes (verde, diâmetro: 3,1 μm). Ao observar o fluxo sanguíneo rápido, a velocidade de varredura do escâner galvanômetro normal pode não ser suficiente. Neste experimento, as imagens foram capturadas usando o microscópio confocal Olympus FV3000RS equipado com um escâner ressonante de alta velocidade. Confirmamos que, quando microesferas fluorescentes foram injetadas no canal 3 do dispositivo microfluídico, as microesferas passaram pelas estruturas luminais do esferóide e alcançaram o canal 1, indicando a perfusabilidade da rede vascular projetada. Ao confirmar a validade deste modelo de esferóide de tumor projetado para estudar os efeitos do fluxo sanguíneo no TME, foi esclarecido em experimentos subsequentes que a eficácia dos medicamentos no TME, incluindo a rede de vasos sanguíneos, varia dependendo da presença ou ausência de fluxo intravascular. Esperamos que nosso modelo tridimensional possa contribuir para o desenvolvimento de medicamentos como um modelo de administração de medicamentos transvascular no futuro.
Vídeo: fluxo de contas fluorescentes dentro de vasos sanguíneos e esferóides tumorais construídos em um dispositivo microfluídico
Condição de imagem: 65 msec/quadro. Barra de escalas: 100 μm
Comentário da Dra. Yokokawa
A novidade deste estudo foi uma rede vascular perfusável construída em um esferóide tumoral. Era importante visualizar como a rede vascular conectava os canais esferóide e microfluídico. Além disso, era essencial observar simultaneamente a luz vascular e o fluxo através da vasculatura para demonstrar a perfusabilidade. O escâner ressonante de alta velocidade instalado no microscópio confocal FV3000 possibilitou a geração de imagens da rede vascular (etiquetada com RFP) e o fluxo dinâmico de microesferas (verde).
Dr. Ryuji Yokokawa1 |
Dr. Yuji Nashimoto2 |
Agradecimentos
Esta nota de aplicação foi preparada com a ajuda dos seguintes pesquisadores:
Departamento de Microengenharia, Universidade de Quioto1
Frontier Research Institute for Interdisciplinary Sciences (FRIS), Tohoku University2
Como o microscópio confocal FV3000 facilitou nosso experimento
O sistema totalmente espectral com detectores GaAsP de alta eficiência proporciona alta sensibilidade para aquisição de imagens de células vivas
Vídeos relacionados |
|
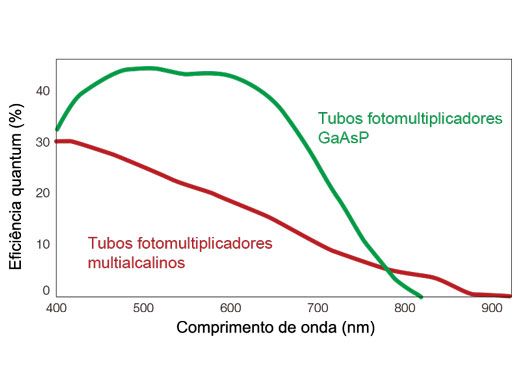
A série do microscópio FV3000 usa a tecnologia de detecção TruSpectral da Olympus que difrata a luz por transmissão, por meio de uma unidade de holograma de fase volumétrica. Essa tecnologia permite um rendimento de luz muito superior, quando comparada a unidades de detecção espectral convencionais com grades de tipo refletivo. O detector espectral de alta sensibilidade (HSD) de dois canais do microscópio FV3000 usa tecnologia TruSpectral com PMTs GaAsP e resfriamento Peltier para obter uma alta eficiência quântica de 45% com uma alta relação sinal-ruído. Essa combinação de tecnologias de detecção permite uma detecção potente de alta sensibilidade e minimiza a potência do laser necessária para observação de tecido vivo.
Duas opções de unidades de varredura
Vídeos relacionadosPlaquetas ligadas a uma trombose nos vasos sanguíneos de um rato. Imagens feitas com 30 fps em fotograma completo com o escâner ressonante com 2 CH GaAsP PMTs. Imagem: cortesia do: Dr. Takuya Hiratsuka, Dr. Michiyuki Matsuda, Escola de Pós-graduação de Estudos Biológicos, Universidade de Quioto. | Escolha entre duas unidades de escâner: um escâner galvanômetro tradicional (FV3000) ou um escâner híbrido galvanômetro/ressonante (FV3000RS). O escâner ressonante possibilita capturar 30 quadros por segundo com campo de visão completo a 512 × 512 píxeis ou até 438 quadros por segundo recortando o eixo Y para capturar eventos fisiológicos vivos essenciais, como fluxo de íons de cálcio |
Produtos usados nesta aplicação
foi adicionado com sucesso aos seus favoritos
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.