Fluxo de trabalho de análise para ensaios de células vivas/mortas em 3D
Resumo
O software de análise de células NoviSight 3D fornece dados estatísticos sobre esferoides e outros objetos 3D medindo parâmetros como volume, esfericidade e número de células. Esta nota de aplicação apresentará o processo de trabalho de análise de células NoviSight 3D para um ensaio de esferoides vivos/mortos.
Introdução
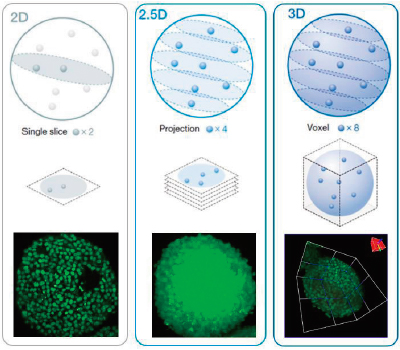
A análise 3D de alto conteúdo (HCA — High-Content Analisys) usando esferoides ou organoides pode ser difícil. Idealmente, podemos analisar amostras 3D tridimensionalmente para obter informações sobre sua morfologia e condição interna. A verdadeira análise 3D do software NoviSight pode simplificar esse processo medindo o volume, o número de células e a condição da célula de amostras 3D com base em imagens fluorescentes de pilha Z sequenciais. Por outro lado, a análise convencional usa uma única fatia de imagem (Figura 1, esquerda, análise 2D) ou usa uma imagem de projeção (Figura 1, centro, análise 2,5D). Ambas as técnicas perdem muitos dados da amostra 3D, como as informações espaciais, morfológicas e volumétricas (Figura 1). Nesta nota de aplicação, demonstramos como analisar quantitativamente amostras 3D com o software NoviSight usando um ensaio de esferoides vivos/mortos. |
Figure 1 (left to right): 2D, 2.5D, and 3D analysis schematic. |
Métodos
Preparação de amostra
Cultivamos 500 células HT-29/poço em uma placa PrimeSurface® 96U (Sumitomo Bakelite) por oito dias para formar esferoides e, em seguida, aplicamos várias concentrações de estaurosporina (STS) com NucView® 550 (Biotium) no dia seguinte. NucView 550 é uma sonda fluorescente caspase-3, e os núcleos das células mortas foram tingidos fluorescentemente com vermelho. Após o tratamento com STS e NucView 550, os esferoides HT-29 foram fixados com paraformaldeído a 4% e permeabilizados com Triton X-100/PBS (-) a 0,5%. Os núcleos dos esferoides foram tingidos com Hoechst 33342 a 4 °C (39,2 °F) durante a noite. Após a coloração, os esferoides foram limpos com SCALEVIEW-S4.
Produção de imagens e análise
Fizemos imagens das amostras em três dimensões usando o microscópio confocal FV3000 e uma lente objetiva semiapocromática (LUCPLFLN20X). Você pode ver as condições de aquisição abaixo. O tamanho da etapa Z foi de 2 μm. Um laser de 405 nm foi usado para Hoechst 33342 (fluorescência azul), e um laser de 561 nm foi usado para NucView 550 (fluorescência magenta). A Figura 2 mostra imagens volumétricas de esferoides não tratados e
tratados com STS adquiridas usando o microscópio. O centro de um esferoide de cultura de 8 dias não tratado provavelmente estava morto devido à baixa nutrição ou devido à hipóxia. No geral, o STS induziu a morte celular dos esferoides HT-29.
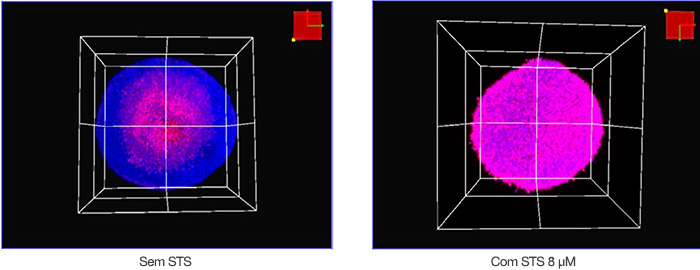
Figura 2: Visualização volumétrica dos esferoides HT-29 com (direita) e sem (esquerda) STS.
Benefícios
- Realize facilmente um teste de viabilidade 3D vivos/mortos
- A interface de usuário intuitiva ajuda a transformar imagens de pilha Z em dados quantitativos reproduzíveis
Estratégia de análise 3D vivos/mortos
As etapas descritas na Tabela 1 são necessárias para analisar quantitativamente esferoides vivos/mortos usando o software NoviSight™. Para que o software NoviSight reconheça tridimensionalmente os núcleos das imagens do plano Z, defina o tamanho da etapa da seção Z em 3 μm — a maior medição para detectar um único núcleo.
| Etapa | Detalhes |
| Preparação da amostra |
Cultura de células e coloração fluorescente
Opção: fixação e limpeza se você quiser analisar o número de células, você deve colorir o núcleo ↓ |
| Formação de imagens |
Aquisição de várias imagens da pilha Z
ex. microscopia confocal, microscopia multifotônica ↓ |
| Análise |
1. Reconhecer objetos que você está interessado em exemplos: núcleo, volume, organela
2. Definir parâmetros de análise 3. Análise gráfica pela geração de gráficos 4. Análise estatística |
Tabela 1: Fluxo de trabalho de análise 3D desde a preparação da amostra até a análise.
Etapas de análise do software NoviSight
Reconhecimento do objeto principal
O ensaio de células vivas/mortas foi avaliado pelo número de células vivas/mortas. O software NoviSight pode detectar o número de células das manchas nucleares. Para reconhecer o núcleo da célula, usamos um módulo NoviSight especializado para detecção nuclear: NuclearL. Quando você insere o tamanho de célula apropriado, intensidade do fundo e a proporção Z/XY (alongamento do eixo Z do núcleo), o software NoviSight pode detectar automaticamente os núcleos do esferoide no espaço 3D (Figura 3A).
Configuração dos parâmetros de análise
Para todos os núcleos tingidos com Hoechst 33342, aqueles com uma alta intensidade de sinal NucView 550 eram células mortas. Como resultado, o software NoviSight pode classificar as células vivas/mortas pelos níveis de intensidade CH2 (NucView 550) nos objetos nucleares reconhecidos (Figura 3B). Isso significa que o software NoviSight pode classificar células esferoides vivas/mortas usando apenas a configuração de reconhecimento do núcleo.
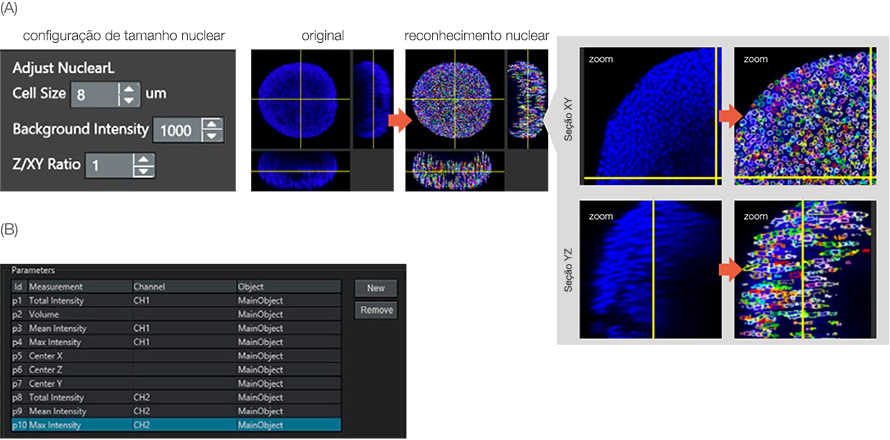
Figura 3: Reconhecimento de objetos parentais. (A) Os núcleos foram reconhecidos pelo módulo NuclearL. Cada núcleo reconhecido foi envolvido por um círculo colorido. (B) Os parâmetros de análise foram definidos. Por exemplo, o parâmetro 10 é CH2 (sinal morto) intensidade máxima no objeto principal (núcleo).
Assim que o reconhecimento do núcleo é finalizado, os núcleos reconhecidos podem ser representados graficamente como dados do objeto em um gráfico de dispersão ou histograma. O eixo X ou Y do gráfico de dispersão pode ser ajustado a partir dos parâmetros de análise. Quando você os define no centro X/Y respectivamente, o centro X/Y dos objetos principais são representados no gráfico (Figura 4A). Quando você clica em um ponto no
gráfico, o software NoviSight pode apontar para a mesma posição na imagem original (Figura 4B).
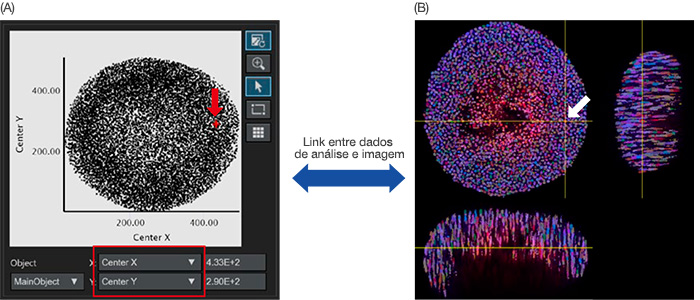
Figura 4: Imagem de análise quantitativa de um esferoide. (A) Quando os parâmetros de análise de centro X e Y (definidos na Figura 3B) foram definidos no eixo X e Y, respectivamente, cada núcleo reconhecido foi representado no gráfico. Os parâmetros de análise no eixo X/Y podem ser ajustados quando necessário (quadrado vermelho). (A/B) O software NoviSight pode vincular visualmente os dados de análise às imagens originais. Quando você clica
no gráfico nuclear reconhecido no gráfico (A, seta vermelha), a mesma posição é exibida automaticamente na imagem original (seta branca).
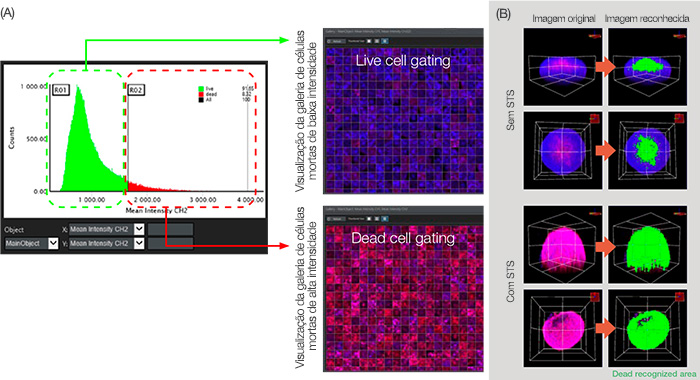
Figura 5: Análise gráfica para classificação das células.
(A) Quando o parâmetro de análise de intensidade média CH2 (definido na Figura 3B) foi definido nos eixos X e Y, respectivamente, o gráfico mostra contagens do objeto principal (núcleo) na ordem da intensidade média do CH2 (sinal morto). Através da geração do gráfico de intensidade de CH2, podemos dividir células vivas e mortas. (B) Visualização volumétrica da área morta reconhecida exibida em verde.
Análise estatística
O software NoviSight pode analisar várias amostras simultaneamente. Os dados quantitativos da análise podem ser exibidos como um mapa de calor (Figura 6A) ou exportados como um arquivo CSV para análise posterior. Os dados também podem ser produzidos em cada geração de gráfico. Aqui, os dados mostram que STS induziu apoptose de células HT-29 de uma maneira dependente da dose quando as várias concentrações de STS foram tratadas em esferoides HT-29 (Figura 6B).
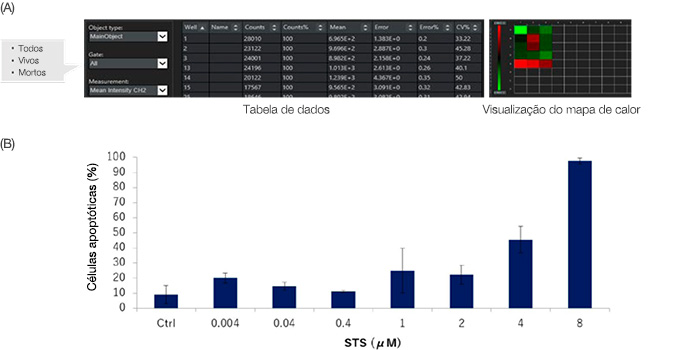
Figura 6: Resultados de quantificação da análise de células vivas/mortas para esferoides HT-29 com ou sem STS. (A) O software NoviSight emite dados de quantificação para cada gate.
Os dados também podem ser exibidos em um mapa de calor. (B) STS aumentou a morte de células HT-29 de uma maneira dependente da dose.
Conectando dados e imagens
A ligação entre dados e imagens é um benefício importante da análise de alto conteúdo. Ao contrário de um leitor de placas, o HCA pode fazer referência à imagem original para confirmar visualmente a morfologia, a posição e a intensidade das células. O software NoviSight™ aproveita ao máximo esse recurso. Por exemplo, o software pode mostrar a imagem correspondente quando você clica em um ponto de dados ou objeto específico (Figura 7), como:
- Um ponto em um gráfico de dispersão
- Uma imagem de objeto na visualização da galeria
- Um poço em um mapa de calor
- Um número em uma tabela
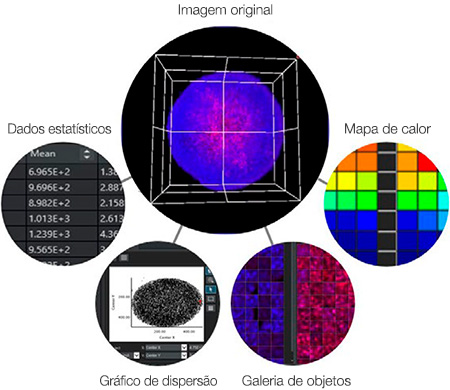
Figura 7: O software NoviSight pode exibir o mesmo ponto na imagem correspondente quando você clica em um ponto de dados ou objeto.
Conclusão
A análise quantitativa 3D de amostras 3D pode parecer complicada, mas o software NoviSight pode agilizar seu processo de trabalho do início ao fim. Por exemplo, o reconhecimento nuclear é o único parâmetro necessário para a análise de esferoides vivos/mortos. Este processo de trabalho simplificado também pode ser aplicado a modelos 3D relevantes.
Autor
Mayu Ogawa (Olympus)
Produtos usados nesta aplicação
foi adicionado com sucesso aos seus favoritos
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.