Comparando linhas de células iPS humanas usando o sistema de monitoramento de incubação CM20: variações na eficiência da diferenciação organoide de fígado entre linhas de células iPS
Introdução
As células-tronco pluripotentes induzidas (iPS) são amplamente utilizadas não apenas para pesquisa básica, como biologia do desenvolvimento, com foco na diferenciação celular e formação de órgãos, mas para pesquisa translacional, incluindo descoberta de drogas e desenvolvimento de ferramentas de diagnóstico. A tecnologia de construção de minitecidos/órgãos derivados de células iPS humanas — chamados de organoides — progrediu rapidamente a tal ponto que os tecidos tridimensionais podem ser utilizados como um avatar de órgãos humanos. Até o momento, muitas linhagens celulares iPS estabelecidas tanto de indivíduos saudáveis quanto de pacientes em todo o mundo podem ser utilizadas para estudos organoides, que visam esclarecer o contexto genômico de doenças e a predisposição a doenças para cada paciente, avaliando as diferenças funcionais e individuais dos organoides gerados. No entanto, o processo de geração de organoides dos órgãos-alvo geralmente demora mais de um mês e é caro. A estabilidade e reprodutibilidade da geração organoide ainda é um grande desafio devido à variabilidade na capacidade de diferenciação e taxa de proliferação entre as linhas de células iPSC utilizadas. Esta é uma das barreiras para o desenvolvimento da pesquisa de organoide baseada na comparação de múltiplas amostras derivadas de diferentes células iPS.
Para resolver este problema, nós monitoramos quantitativamente as células iPS por um longo período para dissecar melhor as diferenças no estado indiferenciado e sua relação com a variação dependente da linha celular na diferenciação organoide.
Entre as linhas de células iPS humanas derivadas de 12 doadores, certas linhas muitas vezes não conseguiram se diferenciar em organoides do fígado, apesar do mesmo protocolo de diferenciação aplicado em todas as linhas de células testadas. Nesta nota de aplicação, conduzimos um experimento para entender melhor a relação das linhas de células iPS entre as propriedades em estados indiferenciados antes da indução da diferenciação e do potencial de diferenciação em organoides do fígado.
Usando dados de monitoramento de células iPS do sistema CM20 para avaliar a diferenciação de organoide
O sistema de monitoramento de incubação CM20 da Olympus nos permitiu medir quantitativamente o status da cultura e adquirir dados de medição que poderiam ser facilmente comparados com resultados anteriores. O número da colônia de células iPS e os dados de densidade podem ser facilmente exportados para um arquivo CSV para uma análise mais detalhada.
Neste estudo, monitoramos o crescimento de linhas de células iPS humanas de 12 doadores durante sua manutenção e, em seguida, exportamos dados de densidade e número de colônias dependentes do tempo para cada linha de células. Em seguida, aplicamos o protocolo de diferenciação que desenvolvemos recentemente (*1) para obter organoides do fígado. Após cerca de um mês, contamos o número de organoides gerados e medimos o nível de secreção de albumina em função do organoide do fígado. Também comparamos os dados de crescimento de células iPS obtidos antes da diferenciação com os dados de seus organoides hepáticos correspondentes para cada linha celular.
Protocolo de cultura e análise de dados
Doze linhas de células iPS humanas foram mantidas em uma placa de 6 poços em condições sem alimentador. Aproximadamente uma semana após a passagem, as células foram dissociadas em células individuais com Accutase e, em seguida, semeadas em uma nova placa. Eles foram estimulados com Activina A e BMP4 para diferenciar de estados indiferenciados em endodermos definitivos. Em seguida, os tratamos com FGF4 e agonista de Wnt para obter esferoides do intestino anterior posterior. Para mudar para uma cultura tridimensional, incorporamos esses esferoides em Matrigel, uma matriz de membrana basal, seguida por pulso de ácido retinóico (AR) durante o estágio inicial da formação de organoide. As células foram posteriormente cultivadas em um meio de diferenciação hepática por cerca de um mês, resultando na geração de organoides do fígado (Figura 1A).
Em seguida, contamos o número de organoides e medimos os níveis de secreção de albumina com um ELISA das amostras de meio coletadas. Integramos os dados indiferenciados de proliferação de células iPS que foram obtidos usando o monitor CM20 e analisamos a correlação entre as características durante a cultura de manutenção e a eficiência de diferenciação organoide de cada linha celular iPS (Figura 1B).
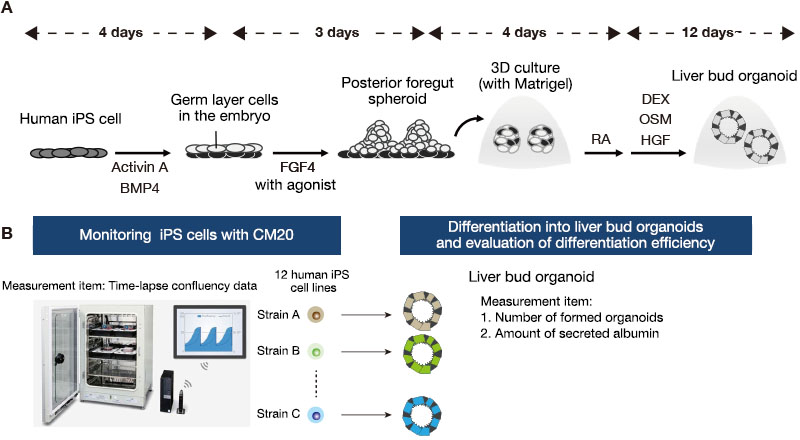
Figura 1. Monitoramento de células iPS humanas durante a cultura de manutenção e avaliação da eficiência de diferenciação de organoides do fígado.
(A) O protocolo de cultura usado para diferenciar células iPS humanas em organoides do fígado.
(B) Resumo da análise comparativa das características durante a manutenção das células iPS e eficiência de diferenciação organoide do fígado em 12 linhas de células iPS derivadas de diferentes doadores.
Ao longo de várias tentativas de induzir 12 linhas de células iPS humanas a se diferenciarem em organoides do fígado, fomos capazes de obter organoides da maioria das linhas de células. No entanto, a linha de células iPS I e J muitas vezes não foi possível diferenciá-las (Figura 2A). Embora a secreção de albumina (a quantidade de secreção por organoide) varie dependendo do lote de indução diferencial, os organoides do fígado derivados de linhas celulares iPS I e J — que têm eficiência de formação de organoide extremamente baixa — também mostraram baixos níveis de secreção de albumina (Figura 2B ). Dentre as linhagens celulares com alta eficiência de formação de organoides, notamos algumas linhagens celulares iPS, como a linha C, apresentando secreção de albumina relativamente baixa. Para validar ainda mais a diferenciação, confirmamos que os organoides do fígado derivados de linhas de células iPS diferentes de I e J expressaram marcadores específicos de hepatócitos (dados não mostrados). Esses dados sugerem que, entre as 12 linhas de células testadas, as linhas de células iPS I e J têm capacidade restrita de se diferenciar na linhagem do fígado.
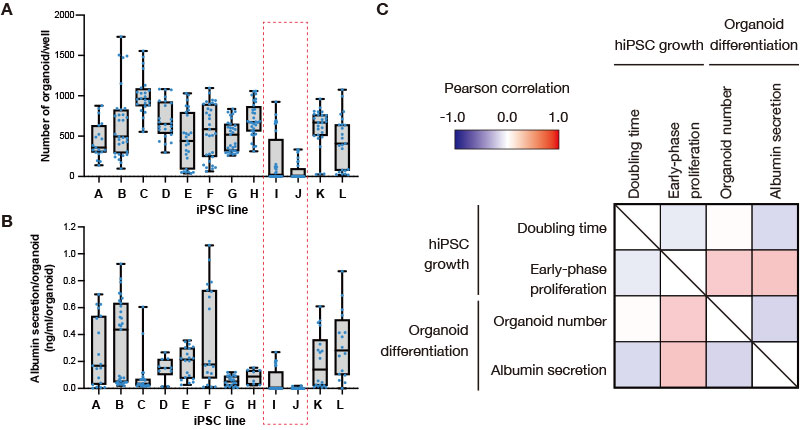
Figura 2. Análise de correlação da proliferação celular antes da indução da diferenciação e a eficiência da diferenciação de organoide do fígado em linhas de células iPS humanas.
(A, B) A quantidade de organóides hepáticos formados durante os experimentos de indução de diferenciação múltipla (A) e o nível de secreção de albumina (B) foram plotados em um gráfico de caixa para cada linha de células iPS. Os pontos azuis correspondem à quantidade de poços medidos durante vários experimentos independentes.
(C) O mapa de correlação mostrando os parâmetros de crescimento de células iPS humanas durante a manutenção (tempo de duplicação e proliferação de fase inicial) e diferenciação organoide do fígado (número de organoide e secreção de albumina).
Em seguida, para investigar se o estado das células iPS antes da etapa de indução de diferenciação afeta a eficiência de diferenciação organoide do fígado, analisamos a correlação dos parâmetros de proliferação adquiridos pelo monitor CM20, o número de organoides formados e a secreção de albumina correspondente a cada indução de diferenciação experimentar. Calculamos os coeficientes de correlação entre o tempo de duplicação das células iPS antes da indução da diferenciação (calculado usando dados de confluência fornecidos pelo monitor CM20) e a eficiência de crescimento no estágio inicial de proliferação (calculado a partir de uma fórmula definida pelo Dr. Takebe), a quantidade de organoides hepáticos gerados e os níveis de secreção de albumina para cada experimento. Levamos em consideração as variações dependentes de lote, analisando o conjunto de dados de cada experimento (Figura 2C). Enquanto a quantidade de organoides do fígado gerados e os níveis de secreção de albumina quase não mostraram correlação com o tempo de duplicação das células iPS, eles foram positivamente correlacionados com os parâmetros de eficiência de proliferação no estágio inicial da proliferação de células iPS. Isso indica que, embora as diferenças simples no tempo de duplicação entre as linhas de células iPS não possam ser usadas para determinar se os organoides do fígado gerados são bons ou ruins em suas qualidades, é possível que algumas diferenças nos estágios iniciais da proliferação de células iPS observadas entre as linhas de células afetem a eficiência da subsequente diferenciação organoide do fígado.
Conclusão
Os dados quantitativos do monitor CM20 nos permitiram ver as informações de culturas de células anteriores até e mesmo após a diferenciação em organoides. As imagens e dados são fáceis de exportar, permitindo uma variedade de análises que podem levar a novos insights durante o processo de cultura.
Neste estudo, descobrimos que as eficiências variáveis da diferenciação organoide do fígado através das linhas de células iPS podem ser significativamente afetadas pela eficiência de crescimento das células iPS durante sua manutenção, particularmente no estágio inicial de crescimento. Isso sugere que, para gerar organoides hepáticos mais estáveis e de melhor qualidade, é importante monitorar o estado das células iPS imediatamente após a passagem para saber se elas estão prontas para a indução de diferenciação. Com base nesta correlação, também é possível prever quando uma linha de células terá uma eficiência de diferenciação boa ou ruim monitorando o estado proliferativo de linhas de células iPS.
A Olympus continuará a pesquisa usando o monitor CM20 para desenvolver métodos de controle de qualidade e gerenciamento de dados eficientes.
Comentários do Dr. Takebe e do Dr. Yoneyama
Dr. Takanori Takebe (à esquerda)
| Ao lidar com várias linhas de células iPS derivadas de diferentes doadores e avaliar as diferenças entre os doadores usando organoides derivados de células iPS, frequentemente encontramos o problema de que a eficiência de diferenciação varia entre as linhas de células iPS. As vantagens do monitor CM20, incluindo o monitoramento estável dos estados de proliferação e a capacidade de exportar os dados, foram muito úteis para realizarmos a análise de correlação entre a proliferação de linhas de células iPS e a eficiência de diferenciação dos organoides gerados em 12 linhas de células testadas simultaneamente. |
Referências:
*1) Ouchi R, Togo S, Kimura M, Shinozawa T, Koido M, Koike H, Thompson W, Karns RA, Mayhew CN, McGrath PS, McCauley HA, Zhang RR, Lewis K, Hakozaki S, Ferguson A, Saiki N , Yoneyama Y, Takeuchi I, Mabuchi Y, Akazawa C, Yoshikawa HY, Wells JM, Takebe T. Modeling Steatohepatitis in Humans with Pluripotent Stem Cell-Derived Organoids. Cell Metabolism, 30 (2): 374-384 (2019)
Produtos usados nesta aplicação
foi adicionado com sucesso aos seus favoritos
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.
