두꺼운 샘플의 선명한 이미징을 위한 SILA 광학 절단 방법
슬라이드 스캐너는 컴팩트한 구성과 다양한 용도 덕분에 연구자들 사이에서 인기를 얻었습니다. 이 스캐너의 우수한 이점 중 하나는 광시야(WF) 형광 현미경 검사와 함께 사용할 경우 얇은 표본의 형광을 감지할 수 있다는 것입니다. 두꺼운 표본을 사용할 경우, 우수한 이미징 솔루션은 SILA(speckle illumination acquisition)입니다. SLIDEVIEW™ VS200 연구용 슬라이드 스캐너와 함께 사용할 경우 SILA 이미징은 디지털 슬라이드 이미지를 위한 빠른 광학 절단 기능을 제공합니다. 이 방법으로 초점이 맞지 않은 빛을 두꺼운 샘플에서 제거하여 대비를 크게 향상할 수 있습니다.
광시야 형광 현미경 검사의 한계
WF 현미경 검사는 특정 (여기) 파장의 빛을 샘플에서 상대적으로 큰 영역에 조사하는 이미징 기법입니다. 형광 활성 분자는 샘플 볼륨 내에서 분산되고 형광 염색이라는 프로세스를 통해 특정 영역과 묶입니다. 이러한 분자는 여기 파장을 흡수하고 그 후 더 긴 파장의 빛을 방출합니다. 그리고 이 빛을 카메라가 감지합니다.
카메라가 수집한 방출된 신호는 여기광의 파워가 충분히 높은 전체 샘플 벌크의 여기광이 도달하는 모든 분자로부터 나옵니다. 따라서, 초점면에서 미세하게 형광 염색된 구조물은 초점이 맞지 않은 빛 때문에 흐릿해집니다. 이 문제에 대한 해결책은 흐릿함 없는 선명한 이미지를 만드는 광학 절단 방법을 사용하는 것입니다.
빠른 광학 절단을 위한 SPARQ 기술 소개
SILA 이미징은 HiLo 알고리즘1과 스페클 스크램블러를 함께 사용하여 빠른 광학 절단 기능을 제공하는 SPARQ 기술(Bliq Photonics가 개발함)을 사용합니다. 이 기술은 광시야 이미지의 초점이 맞지 않는 빛을 제거함으로써 컨포컬 현미경과 유사한 성능을 달성합니다. 1-3
이 기술은 샘플의 두 가지 이미지를 획득합니다. 하나는 균일한 조명의 이미지이고 다른 하나는 샘플에서 확률적 레이저 스페클에 의해 도입된 공간 구조화 조명의 이미지입니다. 두 이미지가 모두 획득되면, 이들을 컴퓨터 기술로 결합하여 흐릿함 없는 이미지를 만듭니다. 그림 1에서 볼 수 있듯이 이 두 가지 이미징 상태 간의 전환은 스페클 스크램블러를 사용하여 이루어집니다.

그림 1. SILA 이미지 획득.
1. 균일한 조명
균일한 조명이 사용된 이미지에는 초점이 맞은 물체와 초점이 맞지 않은 물체에서 오는 신호가 포함되어 있습니다. 초점이 맞지 않은 콘텐츠는 흐릿하게 보이므로 낮은 공간 주파수의 구성 요소만 포함합니다. 균일한 이미지에 단순한 고역 필터를 적용하면 초점이 맞지 않은 콘텐츠를 걸러내고 초점이 맞은 균일한 고주파수 이미지를 남겨둘 수 있습니다. 그러나 이럴 경우 초점면에 존재하는 낮은 공간 주파수 요소를 억제하는 바람직하지 않는 결과가 나타납니다.
초점면에서 샘플의 저주파수 콘텐츠를 복구하기 위해, 고주파수 구조화 조명(스페클에 의해 생성됨)이 획득 및 처리됩니다. 이런 방식으로 저주파수 신호를 복구하고 관심 평면의 신호만 구별할 수 있습니다.
2. 스페클 조명
스페클은 레이저와 같은 간섭성 광원에 특징적으로 나타나는 매체의 불규칙성으로 인한 난반사 또는 산란 이벤트 때문에 발생하는 무작위적 변동입니다. 이러한 반사 또는 산란 이벤트의 간섭으로 인해 샘플에 미세한 확률적 패턴이 투사됩니다.4
스페클 조명은 고주파수 공간 변조를 샘플에 적용합니다. 이러한 유형의 조명의 중요한 특징은 변조 대비가 현미경 시스템의 초점면으로 제한된다는 것입니다. 따라서, 이미지 변조의 로컬 대비를 측정하면 물체가 어느 정도 초점이 맞았는지 또는 초점이 맞은 기여가 있는지 결정할 수 있습니다.
3. 두 이미지 결합
균일한 조명 이미지에서 고역 필터를 사용하면 초점면의 높은 주파수가 추출됩니다. 스페클 조명 이미지에서 물체가 어느 정도 초점이 맞았는지 또는 초점이 맞은 기여가 있는지는 로컬 대비 측정에 의해 결정됩니다. 로컬 대비 측정 이미지에 저역 필터를 적용하면 초점이 맞은 저주파수 신호를 얻을 수 있습니다.
이처럼 고역 및 저역 필터를 적절히 조정하여 스페클 조명 이미지에서 얻은 초점이 맞은 저주파수 콘텐츠로 균일한 조명 이미지에서 얻은 초점이 맞은 고주파수 이미지를 보완할 수 있습니다. 고주파수 및 저주파수 이미지 콘텐츠를 병합하면 이미징 시스템의 주파수 대역 내의 모든 주파수의 구성 요소를 포함한 완전한 해상도의 초점이 맞은 이미지를 얻을 수 있습니다(그림 2).1-3

그림 2. SILA 처리에 관한 다이어그램.
절단 두께(ST) 매개변수라는 설정을 바꾸기만 해도 광학 절단 정도를 조정할 수 있습니다. ST 매개변수를 높이는 것은 컨포컬 현미경의 핀홀 크기를 늘리는 것과 유사합니다.
ST 값을 증가시키면 SILA 이미지 처리 동안 다양한 스페클 대비로부터 기여가 가능해집니다(즉, 더 큰 신호 볼륨). 전체적인 강도가 증가하며, 그에 따라 신호 대 잡음비(SNR)도 변합니다. 그러나 신호 게인이 초점면 밖의 수집 때문에 발생한다는 핀홀 비유에서처럼 ST의 증가로 인해 광학적으로 부족하게 절단된 SILA 이미지가 생기게 됩니다.
SILA 광학 절단 방법을 사용한 실험적 결과의 예
생쥐 신장으로 만든 16µm의 크라이오스탯 절편(FluoCells 준비 슬라이드 #3, F24630)에 WF 및 SILA 이미징 조명을 비췄습니다. ST 매개변수는 2로 설정했습니다(VS200 스캐너, UPLSAPO40XS 대물렌즈, 1.25 NA, 300µm WD, Hamamatsu ORCA-Fusion 카메라). 샘플 두께를 고려하여 이것을 최적의 조명 매개변수로 선택했습니다. ST 매개변수가 너무 작으면 스페클의 내재적인 확률적 특성 때문에 생성된 SILA 이미지에서 입자성이 발생할 수 있습니다.5
획득에 사용된 여기 파장은 488nm이었습니다. 다중 대역 다이크로익 미러(DAPI, FITC, Cy3 및 Cy5용)와 FITC(fluorescein isothiocyanate)용 단일 방출 필터가 사용되었습니다. 카메라의 노출 시간은 60ms로 설정되었습니다. 그림 3a는 WF 이미지를 보여주고, 그림 3b는 동일한 Z 위치에서 ST가 2로 설정된 SILA 이미징으로 스캔한 동일한 영역을 보여줍니다. 전체 샘플에 걸쳐 대비 향상이 관찰됩니다. 영역 1~4를 보면, SILA 이미지가 WF 방법보다 시각적으로 더 많은 디테일을 보여주는 것을 알 수 있습니다.
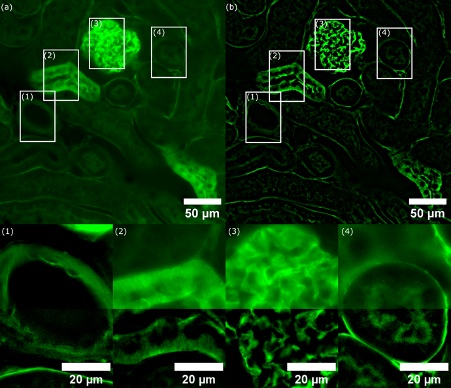
그림 3. (a) Alexa Fluor 488 맥아응집소(W-11261)로 염색한 생쥐 신장의 WF 이미지. 흰색 직사각형은 비교된 구조물의 관심 영역(ROI 1~4)을 표시합니다. (b) ST 매개변수가 2로 설정되고 6.803µm에 해당되는 SILA 광학 절단 이미지. 삽화는 WF 및 SILA 이미징을 위한 병합된 채널과 함께 확대된 ROI(1~4)를 보여줍니다.(상단: WF, 하단: SILA). SILA 이미징의 이미지 대비가 크게 향상된 것을 볼 수 있습니다. WF 이미지의 일부 구조물은 비교 시 거의 눈에 띄지 않습니다. 상세한 ROI가 다양한 강도 스케일로 표시되어 해상된 세부 구조물을 보여준다는 점에 주목하세요.
SILA 이미징 시스템의 광학 설계
SILA 광학 절단 장치는 일반적인 형광 광원을 단일 모드 파이버와 결합된 레이저 다이오드가 생성한 간섭광원으로 대체하여 광시야 슬라이드 스캐너(당사의 VS200 시스템)를 기반으로 제작됩니다. 단일 모드 결합 레이저 광원은 구조화된 조명을 위해 샘플 평면에서 스페클을 생성하고 균일한 조명을 위해 스페클을 제거하는 스페클 스크램블러 장치를 통해 보호됩니다. 레이저 조명과 스크램블러 장치를 정밀하게 제어하여 개별 SILA 이미지를 컴퓨팅하고 스티칭하여 광학적으로 절단된 전체 슬라이드 이미지를 만듭니다.

그림 4. SILA 구성 다이어그램, 간섭광원, 균일한 조명 또는 스페클 조명을 생성하는 스페클 스크램블러, 빛을 샘플에 도입하고 방출된 빛을 수집하는 대물렌즈를 포함한 광학 경로, 광 감지기 역할을 하는 카메라 포함.
품질 측정
1. 스캔 시간
SILA 이미징의 스캔 시간은 5mm × 5mm의 작은 영역에서 테스트되었습니다. 각 카메라 시야에 대해 한 쌍의 이미지를 획득했지만, SILA 이미지의 획득 시간은 WF 이미지와 비교할 때 두 배로 증가되지 않았습니다. 예를 들면, 40배율 공기 대물렌즈를 사용한 경우 획득 시간은 53%만 증가합니다. 자세한 결과는 표 1에서 확인할 수 있습니다.
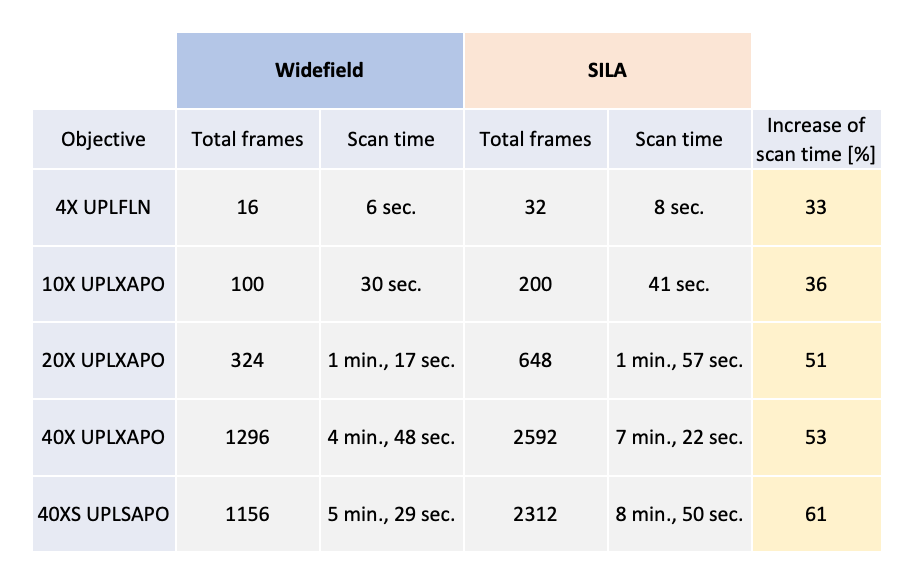
표 1. 4채널(DAPI, FITC, CY3, CY5) 및 5mm × 5mm 스캔 영역에 대한 50ms의 노출로 ORCA-Fusion 카메라(Hamamatsu Photonics)를 사용하여 획득한 WF 및 SILA 이미지의 기록된 스캔 시간 값. 스캔 시간의 증가는 각 배율에 대해 개별적으로 계산했습니다.
2. 해상도
SILA 이미지의 광학 해상도는 WF 이미지와 같습니다. 높은 개구수(NA)를 가진 대물렌즈의 이론적 해상도를 측방향으로는 0.2µm로, 축 방향으로는 0.45µm로 시뮬레이션했습니다. 실험 점 확산 함수(PSF) 값은 520nm 방출 파장으로 형광 비즈(TetraSpeck Microspheres, 0.1µm, 형광 파란색/녹색/주황색/짙은 빨간색)를 포함한 샘플에서 오일 이멀젼 대물렌즈(UPLXAPO100XO, 1.45 NA)로 측정했습니다. WF 이미지의 절반 최대 전체 너비(FWHM)는 측방향으로 0.22µm, 축방향으로 0.47µm입니다. 이론적으로 계산된 값이 매우 작은 비즈에서 실험적으로 측정된 PSF와 일치함을 확인했습니다.
3. 광학 절단 능력
SILA 이미징의 강점은 광학 절단을 수행하는 능력입니다. 그림 5a–d에서는 다른 ST 매개변수가 적용된 그림 3의 생쥐 신장의 하위 영역의 예를 볼 수 있습니다. 그리고 이에 해당되는 직교 뷰는 그림 5e–h에서 볼 수 있습니다. 전체 샘플은 Z 스페이싱이 0.34µm로 설정된 상태에서 39개 이미지의 Z 스택으로 획득되었습니다. 그림 5i에서처럼 ST가 감소하면서 구조물과 배경 사이의 대비가 증가되는 것을 볼 수 있습니다. 또한 상세 구조물을 더 쉽게 확인할 수 있습니다.
이를 보여주기 위해, 각 ST 매개변수와 WF 이미지를 위한 동일한 지점에서 하나의 Z 절편의 X 방향으로 라인 프로파일을 그렸습니다. 정규화된 라인 프로파일을 비교하면 일반적인 WF 시스템과 비교할 때 SILA 이미징의 디테일이 얼마나 더 두드러지는지 분명히 볼 수 있습니다. 구조물에 해당되는 강도 피크는 배경 강도보다 높으며 감소하는 ST 매개변수보다 좁습니다.
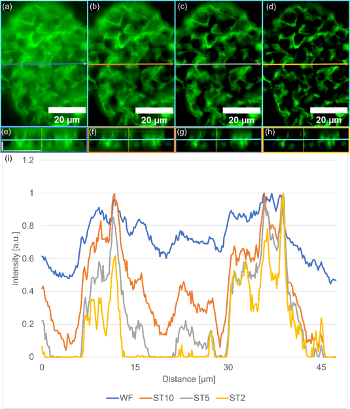
그림 5. SILA 조명으로 WF보다 개선된 광학 절단 기능 활용. (a) WF 조명, (b) ST10의 SILA 조명, (c) ST5의 SILA (d) ST2의 SILA. 각 이미지에는 라인 프로파일 측정 및 X 방향의 직교 뷰 평면(e-h)의 위치를 나타내는 화살표가 포함되어 있습니다. 서로 다른 ST 매개변수를 가진 각 SILA 이미지와 각 WF 이미지는 X 방향 직교 뷰를 포함하여 Z 스택으로 획득했습니다. 파란색 선은 a-d에서 보이는 동일한 Z 평면을 나타냅니다. 수평 스케일 바는 20µm에 해당되고, 수직 스케일 바는 5µm에 해당되며 모든 하위 그림에 적용됩니다. (i) 기록된 라인 프로파일은 a-b에 표시되어 있으며, 파란색의 WF, 주황색의 ST10의 SILA, 회색의 ST5의 SILA, 노란색의 ST2의 SILA를 비교하고 있습니다. 모든 플롯은 1로 정규화되었습니다. ST 매개변수가 감소되면 대비가 향상되는 것을 볼 수 있습니다.
4. 피사계 심도
SILA 광학 절단 방법은 두께가 몇 백 미크론이 넘는 샘플을 이미징합니다. 특히, 샘플이 투명화된 경우 SILA 이미징의 침투 깊이는 대물렌즈의 작동 거리에 의해서만 제한됩니다. 표본이 투명화되지 않은 경우, 샘플 구조에 의해 빛이 산란되어 더 깊은 세포 층까지 도달하지 못하도록 방해할 수 있습니다.6
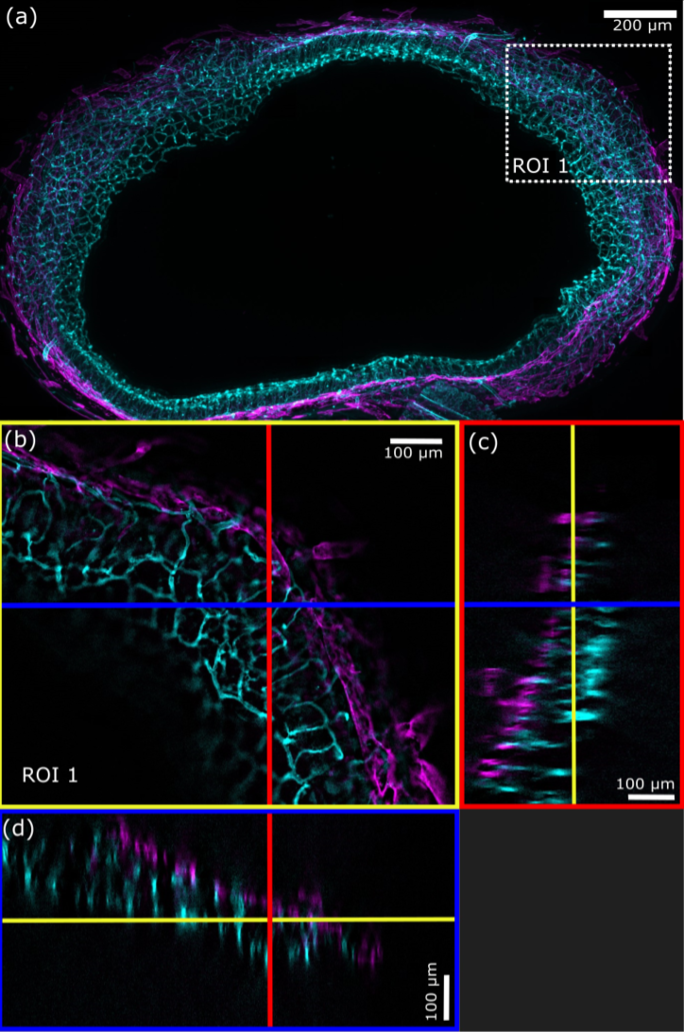
그림 6. a) 생쥐 장의 SILA(ST = 2) 이미지의 최대 강도 투사(MPI, 188개 평면, Z 스페이싱 = 2.36μm)는 혈관(청록색) 및 림프관(자홍색)을 보여줍니다. b) 흰색 점선 사각형은 (a)로부터 확대된 ROI 1을 보여줍니다. 여기서 파란색은 XZ 직교 뷰의 위치를 나타내고 빨간색 선은 YZ 직교 뷰의 위치를 나타냅니다. c) 파란색 직사각형은 YZ 방향의 직교 뷰를 보여주고, d) 빨간색 직사각형은 XZ 방향의 직교 뷰를 보여줍니다. 노란색 선은 (b)에서 볼 수 있는 Z 평면을 나타냅니다. (FluoTissue 450μm 생쥐의 장 절편, Sun Jin lab) RapiClear 1.52가 처리).
5. 반복성
SILA 이미지 처리는 균일한 이미지와 스페클 이미지의 광학 절단을 통해 이미지를 컴퓨팅할 수 있도록 합니다. 이상적으로는 스페클 구조물이 완전히 여과되어 최종 SILA 이미지에서는 관찰되지 않아야 합니다. 그러나, 현실은 그렇지 않습니다. 스페클 조명은 신호 강도의 경미한 변화를 내재적으로 유발합니다. 예를 들면, 한 이미지에서 스페클이 샘플의 디테일에 조명을 비출 수도 있지만, 다른 이미지에서는 조명을 비추지 않을 수도 있습니다. 최종 이미지에서 관찰되는 잔류 강도 변화는 이 현상에 의해 설명됩니다. 이러한 변화는 분명히 확률적이며, 이 기법의 강점(광학 절단 및 침투 깊이)이자 한계(신호 강도 변화)입니다.
신호 강도 변화를 조사하기 위해, 4가지 ST 매개변수(그림 8a 참조)에 대해 10개 스캔으로 구성된 시퀀스(그림 7 참조)를 기록했습니다. 각 샘플에 대해 스캔 시퀀스 전반의 강도 변화를 정량화하기 위해 구조물을 포함한 90개의 자의적으로 선택된 ROI를 사용하여 변이계수(CV)를 계산했습니다.
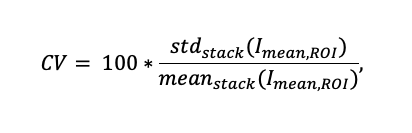
여기서 Imean,ROI는 단일 스캔의 ROI 1개의 평균 형광 강도입니다. 한편 stdstack 및 meanstack은 각각 10개의 스캔으로 구성된 시퀀스 전체의 표준 편차와 Imean,ROI,의 평균 값입니다. 그림 7c는 이러한 10개의 스캔에 걸쳐 25개의 ROI와 이들의 평균 형광 강도 프로파일의 예를 보여줍니다.
구조물을 포함한 영역의 세 가지 샘플에 대해 계산된 CV는 ST 함수로서 감소합니다(그림 8b). 절단 매개변수 값이 커질수록, 스페클 이미지의 공간 필터링 강도가 약해져 SILA 이미지의 강도 변화가 작아집니다. 90개의 감지된 ROI로 3가지 구조물에 대해 측정한 SILA 이미지의 변이계수는 평균 3.7±1.4%입니다. 비교하자면, WF 모드의 신호 강도 변화는 약 0.3%이며 시스템에 내재적입니다.
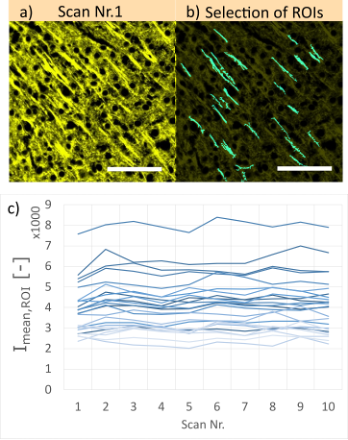
그림 7. a) 40배 배율 및 ST 10으로 SILA 이미징을 사용해 획득한 생쥐 뇌 샘플의 예(Cy3 염색, 100µm 두께). 각 영역은 동일한 초점면과 영역에서 10회 스캔했습니다. b) 청록색 관심 영역(ROI)은 평균 형광 강도(Imean,ROI) 측정을 위해 선택된 구조물을 보여줍니다. 스케일 바는 50µm에 해당됩니다. c) 이전에 표시된 선택된 ROI의 평균 강도 프로파일. 각 선은 하나의 ROI에 해당됩니다. 더 나은 해석을 위해 25개의 ROI를 포함한 이미지의 작은 절편만 표시했습니다.
다른 광학 절단 기법과의 비교
아래 그림에서는 SILA 이미징을 일반적인 광시야 현미경 검사, 디블러 알고리즘, 디콘볼루션 및 컨포컬 레이저 스캐닝 현미경 검사와 비교합니다. SILA 이미징은 디블러 알고리즘을 사용하는 일반 WF 이미징보다 크게 향상된 광학 절단 기능과 대비를 제공합니다. 디콘볼루션과 비교할 때. SILA 기술은 이미지 품질을 개선합니다. 또한, 즉흥적 광학 절단 기능으로 전체 대형 슬라이드 이미지를 캡처할 때 드는 긴 처리 시간을 단축합니다.
컨포컬 현미경 검사와 비교할 때, SILA 기술은 이미지 품질 면에서 놀라울 정도로 유사합니다. 예상대로 광시야 현미경 검사는 배경 형광 때문에 품질이 저하됩니다. 컨포컬 현미경 및 SILA 현미경 검사 모두 샘플의 산란 특성에도 불구하고 훨씬 더 높은 대비의 광학적 절단 이미지를 생성하고 세포 구조의 미세한 디테일을 보여줍니다. 이미지 디테일과 강도 분포의 공간 변화를 비교하기 위해 SILA 및 컨포컬 현미경 검사를 더 자세히 비교해야 하지만, SILA 기술의 성능만으로도 정성적 평가와 공동 국소화 연구에 충분합니다. SILA는 대량의 샘플을 상세히 살펴볼 수 있는 빠른 스캔 장치로서 기능할 수 있습니다. 그 다음, 관심 구조물이 있는 이러한 샘플들은 정량적 이미징을 위해 컨포컬 현미경으로 가져갈 수 있습니다.
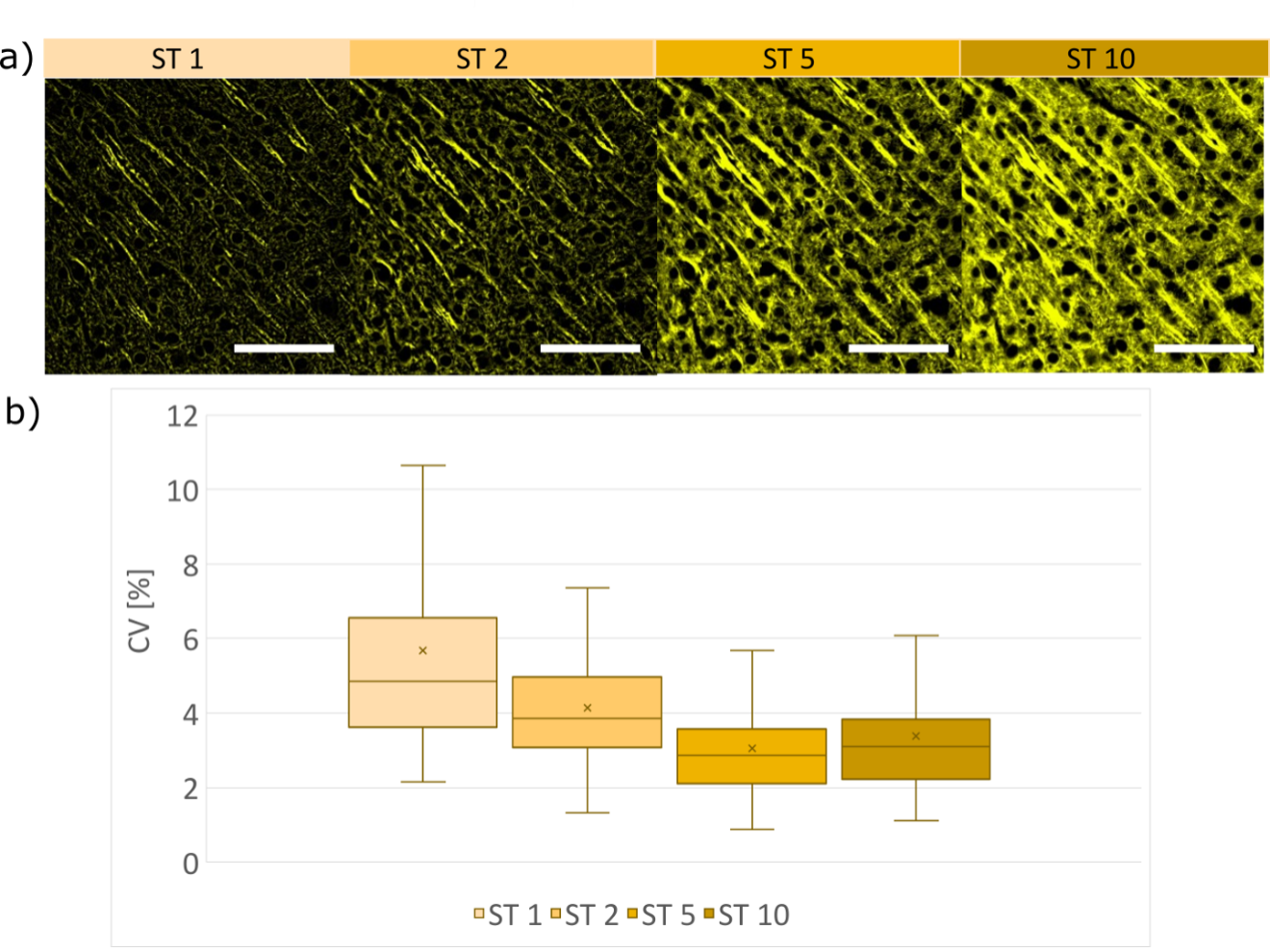
그림 9. 플라나리아 편형동물(Schmidtea Mediterranea)의 이미지(20배율 대물렌즈). 세 가지 기법을 비교했습니다. a) WF 이미지, b) 디블러 알고리즘을 사용한 WF 이미지, c) ST 매개변수가 5로 설정된 SILA 이미지. 파란색: DAPI, 녹색: 내부 장 세포, 빨간색: 외부 장 세포. 샘플 제공: 독일 괴팅겐 Max Planck 다학제과학 연구소, 조직 역학 및 재생 부서, Amrutha Palavalli. 스케일 바는 500µm에 해당되며, 모든 하위 그림에 적용됩니다.
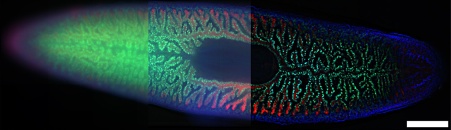
그림 10. MAP2로 염색한 두꺼운 생쥐 뇌 이미지(20배율 대물렌즈). 세 가지 기법을 비교했습니다. a) 확장 초점 이미지(EFI) 투사를 활용한 WF 이미지 b) EFI 투사 및 응응 디콘볼루션을 사용한 WF 이미지 c) EFI 투사를 사용하고 ST 매개변수를 2로 설정한 SILA 이미지. 스케일 바는 50µm에 해당합니다.
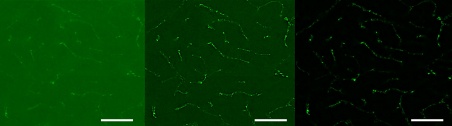
그림 11. 신경교섬유질산성단백질(GFAP)로 표지된 생쥐 뇌 샘플의 이미지, 뉴런이 보임(20배율 대물렌즈). 세 가지 기법을 비교했습니다. a) FLUOVIEW™ 현미경을 사용하여 획득한 컨포컬 이미지, b) 추가로 디콘볼루션을 사용한 동일한 컨포컬 이미지, c) ST 매개변수를 2로 설정한 SILA 이미지. 스케일 바는 50µm에 해당되며, 모든 하위 그림에 적용됩니다.
결론
VS200 스캐너용 SILA 광학 절단 장치를 사용하면 두꺼운 샘플을 위해 대비가 향상된 이미지를 촬영할 수 있습니다. WF 현미경 검사와 비교할 때, 40배율 공기 대물렌즈를 사용하면 스캔 시간이 평균 53% 증가합니다. 달성 가능한 광학적 깊이는 광학 설정의 작동 거리에 의해서만 제한됩니다. 이는 최대 500μm 두께의 매우 두꺼운 샘플을 스캔하여 확인한 결과입니다. SILA의 축 해상도는 WF 이미징과 같지만, 광학 절단은 절단 두께 매개변수를 통해 대폭 향상시키고 조절할 수 있습니다.
ST 매개변수를 큰 값으로 설정하면 스페클 이미지의 공간 필터링 강도가 약해져 SILA 이미지의 강도 변화가 작아집니다. 이러한 강도 변화는 우리가 사용한 예에서 평균 3.7±1.4%로 측정되었습니다. ST 매개변수 1로부터의 높은 강도 변화는 ST 매개변수를 증가시켜 제한할 수 있습니다. 형광 강도를 정량적으로 분석해야 하는 경우 이러한 조절을 고려해야 합니다.
이 시스템을 통해 컨포컬 현미경 검사 또는 응용 디콘볼루션을 사용한 경우와 유사한 이미지를 신속하게 얻을 수 있습니다. 우리는 이 기술을 두꺼운 샘플의 빠른 슬라이드 스캔에 적용할 수 있으며, 이 기술이 디테일에 선명하게 초점을 맞춘 깨끗한 고대비 이미지를 얻는 데 유용하다고 생각합니다.
참고 문헌
- Lim, D., Ford, T., Chu, K.K., and Mertz, J. 2011. "Optically Sectioned In Vivo Imaging with Speckle Illumination HiLo Microscopy." Journal of Biomedical Optics. 16, 016014.
- Lim, D., Chu, K.K., and Mertz, J. 2008. “Widefield Fluorescence Sectioning with Hybrid Speckle and Uniform-Illumination Microscopy.” Optical Letters. 33, 1819–1821.
- Mertz, J. and Kim, J. 2010. “Scanning Light-Sheet Microscopy in the Whole Mouse Brain with HiLo Background Rejection.” J. Biomed. Opt. 15, 016027.
- 4. Goodman, J. W. 2007. “Speckle Phenomena in Optics: Theory and Applications.” Roberts and Company Publishers.
- Schniete, J., Franssen, A., Dempster, J. et al. 2018. “Fast Optical Sectioning for Widefield Fluorescence Mesoscopy with the Mesolens based on HiLo Microscopy.” Sci Rep, 8, 16259.
- Richardson, D. S. and Lichtman, J. W. 2015. "Clarifying Tissue Clearing." Cell. 162.2: 246–257.
저자
Anna Zelená, 애플리케이션 스페셜리스트, Evident Technology Center Europe
Wei Juan Wong, 제품 관리자, Evident Technology Center Europe
Gabriel Maranon, 제품 전문가, Bliq Photonics
Alicja Gąsecka, R&D 및 프로덕션 디렉터, Bliq Photonics
Mariêve Picard, 영업 및 마케팅 디렉터, Bliq Photonics
Jeck Borne, 시스템 엔지니어, Bliq Photonics
Evident Technology Center Europe의 VS200 팀 전체에게 감사의 인사를 전합니다.
이 애플리케이션에 사용되는 제품
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.