Robert Hooke가 직접 만든 렌즈로 큐브 모양으로 분할된 세포를 처음 관찰한 것부터 Osamu Shimomura의 해파리 에쿼린과 GFP에 대한 연구, Xiaowei Zhuang의 3D 초분해능 재구성 중 새로운 깜박임 염료 분자에 이르기까지 우리는 광학 현미경으로 생명의 소우주 탐험을 멈추지 않았습니다.
4차 산업혁명의 주축인 나노기술 공학은 21세기에 처음에는 재료과학 응용 분야에서 활약했습니다. 나노기술이 생명과학과 충돌했을 때 나노물질의 빛으로 생명의 소우주를 밝히는 새로운 불꽃(형광 나노프로브)이 탄생했습니다.
형광 현미경의 출현
형광은 일종의 광발광이며 빛의 흡수에 의해 발생합니다. 자연에는 수많은 형광 현상이 있습니다. 발광 해파리에서 추출한 녹색 형광 단백질(GFP)은 살아있는 미시 세계를 탐험하기 위해 이 현상을 처음으로 실제 적용한 것입니다. 90년대 초, 연구자들은 GFP 유전자를 다른 생물체에 도입하여 발현시키면 자연적으로 형광을 발하지 않는 생물체에서 녹색 형광을 발생시킨다는 사실을 밝혀냈습니다. 그 이후로 과학자들은 GFP의 구조와 메커니즘을 분석하여 GFP의 가용 색상, 광도, 안정성 및 기타 특성을 더욱 개선했으며, 이는 바이오이미징에서 형광 단백질(FP)의 개발 및 적용을 크게 발전시켰습니다(그림 1).
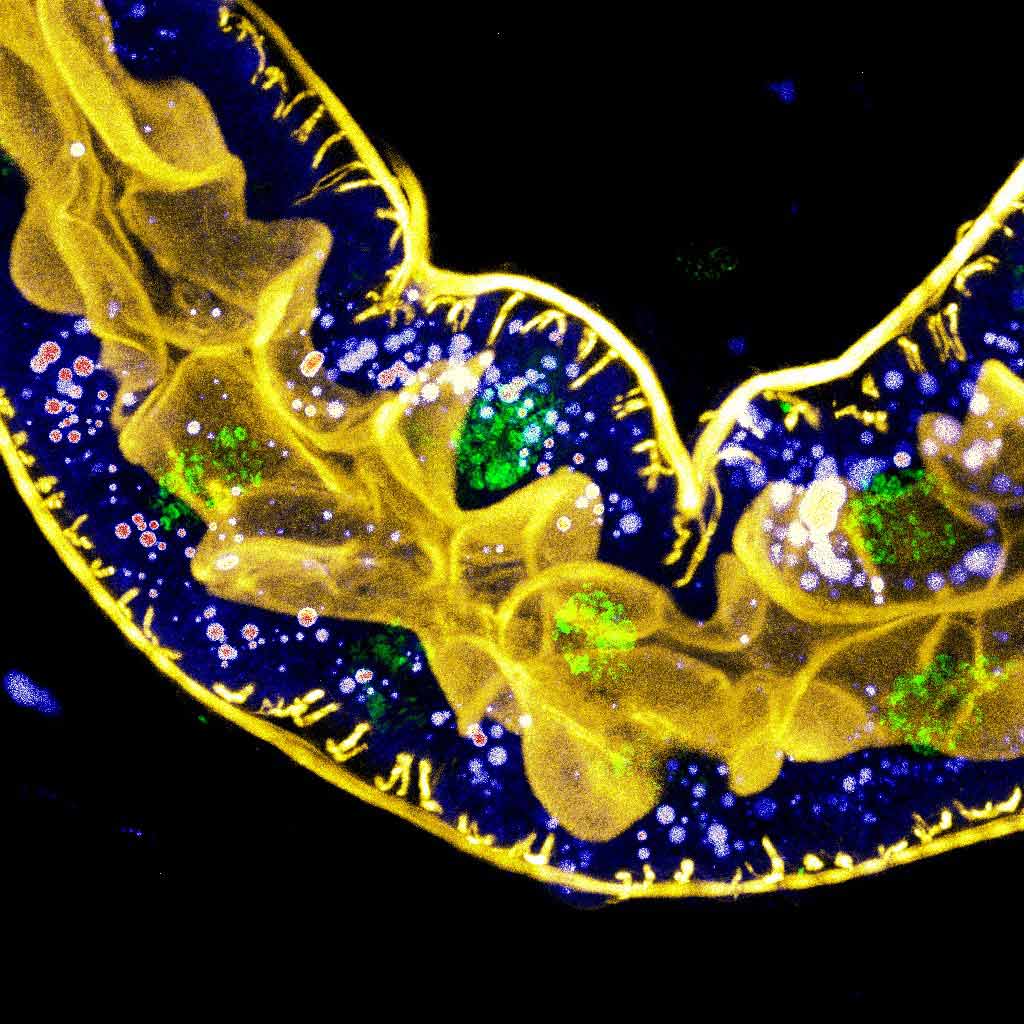
그림 1. 노란색은 F-액틴을 표시하고 녹색은 핵을 표시하고 강도 조회 테이블(LUT)은 지질 방울을 표시하는 초파리 애벌레 후장의 다색 형광 이미징입니다.
형광 단백질 계열이 점점 증가하고 있지만 적용 범위는 여전히 제한적입니다. FP의 방출 스펙트럼은 넓고 비대칭이어서 동시 다채널 이미징에서 빈번한 혼선이 발생합니다. 화학 합성의 도움으로 다양성이 풍부하고 조작이 간단한 유기 염료가 등장하여 형광 이미징의 적용 범위를 크게 확장했을 뿐 아니라 표준 상업 생산을 촉진하여 개발의 도약을 위한 견고한 기반을 마련했습니다.
나노물질, 바이오이미징의 발전 촉발
점차적으로 낮은 형광 효율과 열악한 광안정성 같은 유기 염료의 특정 단점이 형광 이미징의 발전에 걸림돌이 되었습니다. 다행히도 고유한 특수 광학 특성, 방향성 합성 및 조립 및 기타 장점 덕분에 나노물질은 형광 이미징에 새로운 활력을 불어넣고 있습니다. 현재 일반적인 형광 나노물질은 다음과 같습니다(그림 2).
- 반도체 양자점(QD)
- 상향변환 희토류 물질(상향변환 나노입자, UCNP)
- 귀금속 나노입자
다른 염료와 비교하여 형광 나노물질은 높은 양자 수율, 높은 안정성, 큰 스토크 이동, 넓은 여기 스펙트럼, 좁은 방출 스펙트럼의 장점이 있습니다. 방출 파장은 크기를 조절해 변경할 수 있습니다. 생체 적합성, 인식 및 감지 기능은 조립과 개질을 통해 개선될 수 있습니다. 통틀어서 나노물질은 형광 이미징의 미래뿐 아니라 형광 라벨링에 대한 탁월한 잠재력이 있습니다.
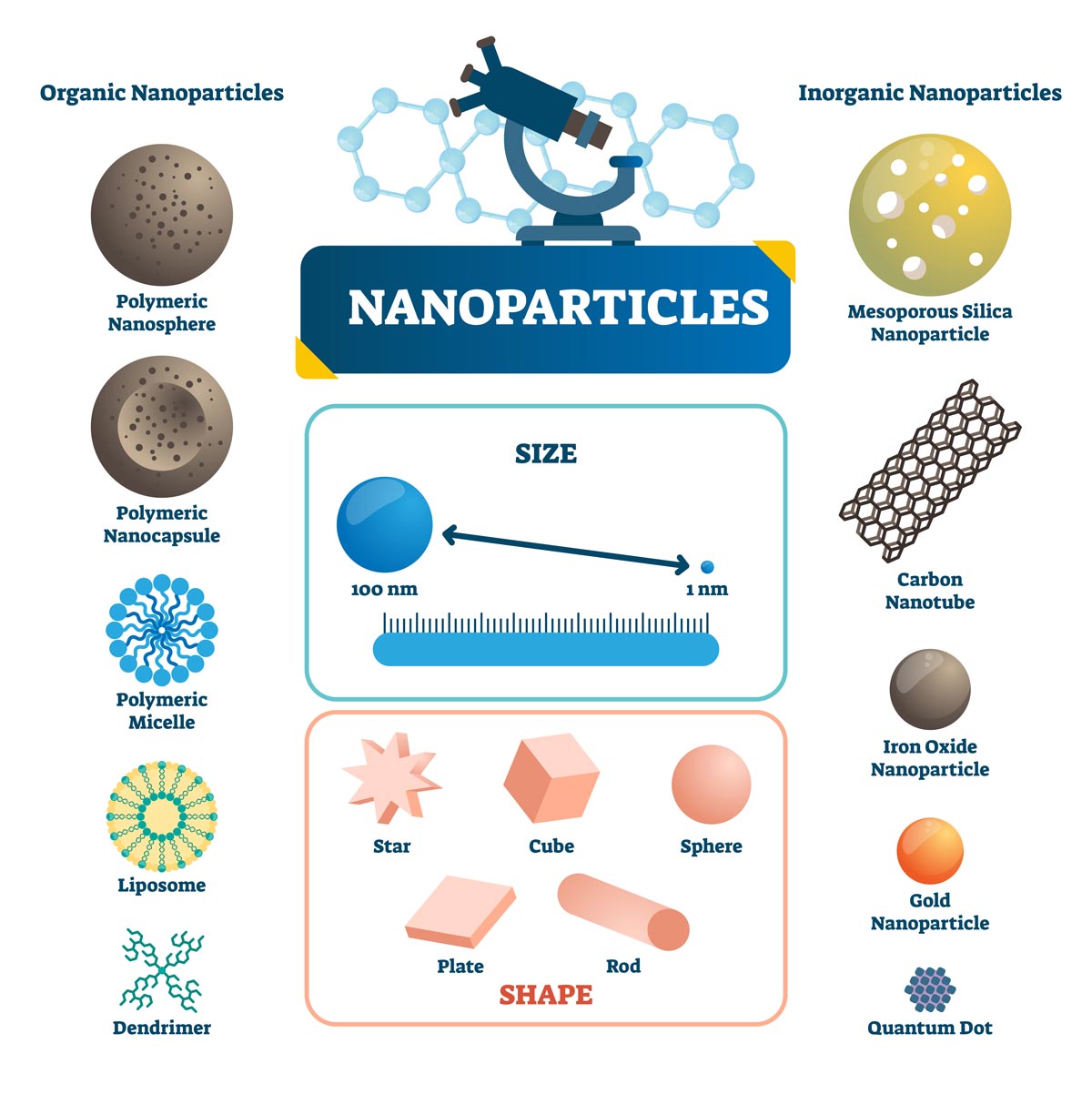
그림 2. 크기, 모양 및 재료를 나타내는 유기 및 무기 나노입자의 예시
형광 나노프로브의 기본 워크플로
나노화학과 바이오이미징을 포함하는 학제간 프로세스이기 때문에 형광 나노프로브를 설계하기 위한 워크플로는 기존 바이오이미징의 워크플로와 다릅니다. 이는 이론적 계산, 화학적 합성, 생체 이미징, 심지어 의료 테스트까지 포함하는 다단계 프로세스입니다(그림 3).
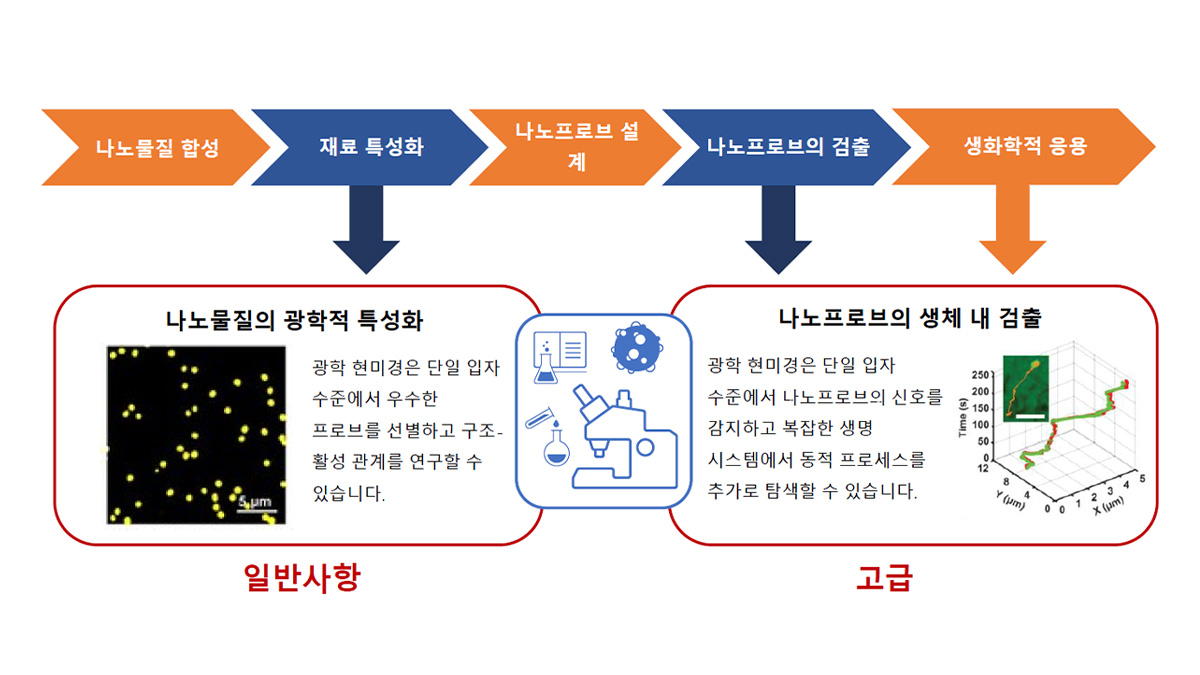
그림 3. 형광 나노프로브의 기본 워크플로
형광 나노프로브를 사용한 연구 과정은 대부분 응용 지향적입니다. 형광 나노프로브를 사용한 바이오이미징은 시험관 내 검체 이미징에서 생체 내 동적 이미징에 이르기까지 다양하며 의료 진단과 연구로 발전할 수도 있습니다. 따라서 나노프로브를 설계할 때 생물학적 응용을 고려하고, 생물학적 응용의 특정 요구에 따라 특수한 광학적 특성이나 다른 기능(예: 근적외선, 상향변환, 2광자 등)이 있는 나노물질을 선택하며, 그 다음 합성과 특성화를 거쳐 우수한 나노물질을 선별합니다. 그 후, 프로브는 생체 적합성 또는 광학 장치 조작, 약물 담지, 분자 인식 등과 같은 기능에 대한 요구를 고려하여 추가로 개질, 조립합니다(그림 4).
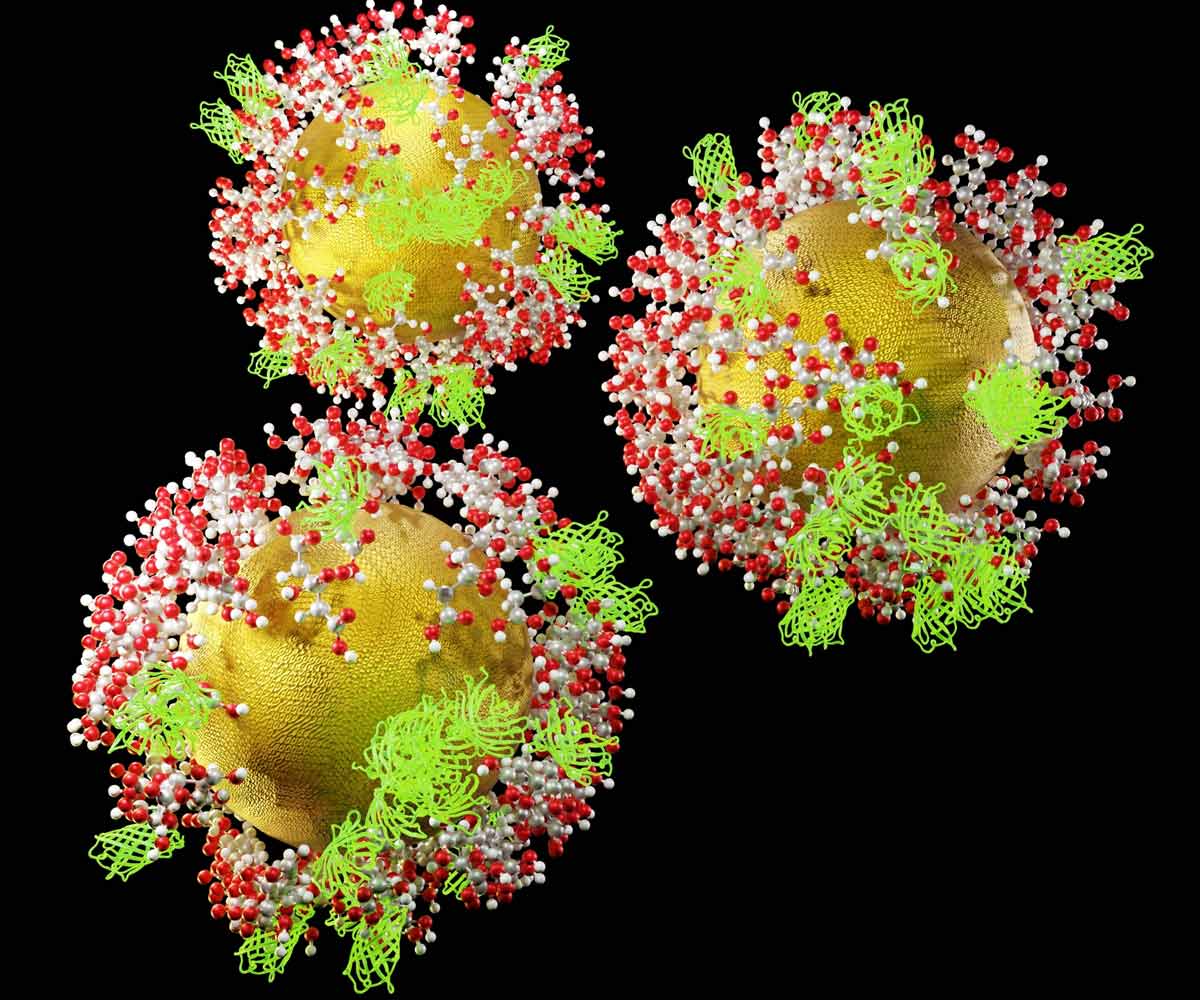
그림 4. 녹색 형광 단백질(GFP)과 시트르산 분자로 코팅된 기능화된 금 나노프로브(GNP)의 3D 렌더링
형광 나노프로브와 관련된 연구에서 광학 현미경은 주로 특성화, 우수한 나노물질 선별, 나노프로브의 생체 내 검출의 세 가지 영역에 적용됩니다.
선별 과정에서 서로 다른 입자의 특성은 고유한 구조적 이질성 때문에 가변적일 때가 많습니다. 많은 입자의 앙상블 특성에 함께 의존하는 기존
방법과 달리 광학 현미경을 사용하면 단일 입자 수준에서 우수한 프로브를 선별하고 설계 합성을 안내하기 위해 구조-기능 관계를 추가로 조사할 수
있습니다. 생체 이미징에서 광학 현미경은 생체 내에서 나노프로브의 광학 신호를 감지하여 동적 시공간 반응을 이미지화하고 추적할 수 있습니다.
형광 나노프로브 및 현미경 솔루션의 연구 응용
컨포컬 현미경으로 솔루션을 사용한 근적외선/상향변환 이미징
근적외선 이미징은 깊은 침투 능력, 낮은 광독성, 조직 자가형광의 낮은 간섭 덕분에 현재 광학 현미경의 연구 거점으로 떠올랐습니다. 양자점과 같은 형광 나노프로브는 화학적 조성, 형태 및 크기 조정을 통해 NIR 여기를 쉽게 달성할 수 있습니다. 또한 상향변환 나노물질은 NIR 이미징에 실용적인 특수 광학 특성을 가지고 있습니다. 그리고 장파장 광(NIR)에 의해 여기될 때 여기 광보다 더 짧은 파장의 광(가시광 또는 적외광)을 방출합니다. 이러한 장점 덕분에 상향변환 나노프로브는 차세대 형광 바이오마커로 각광받고 있으며, 생물의학, 에너지 및 촉매 연구 등 다양한 분야에서 중요한 역할을 할 것으로 기대됩니다.
간독성에 대한 민감성 실시간 생체 내 검출은 현재 약물 유발 간 손상 진단에 장애물이 되고 있습니다. Li Huijun 교수 연구팀이 2020년 발표한 논문에서 상향변환 나노입자(UCNP)와 금 나노막대(GNR)를 조립하여 상향변환 나노프로브가 설계되어 약물 유발 간 손상의 실시간 진단에 적용되었습니다. 이 새로운 나노프로브는 간에서 응집될 수 있고 간 손상의 표지자인 miR122에 의해 특이적으로 활성화되어 980nm에서 근적외선에 의해 여기될 때 800nm에서 형광 이미지를 생성합니다. 발광 공명 에너지 전달(LRET)과 신호 증폭 기술과 결합하여 검출 감도가 더욱 향상되어 miR122의 고감도 검출을 달성하여 약물 유발 간 손상의 실시간 임상 모니터링을 위한 새로운 접근 방식을 제공합니다.[4]
기존의 컨포컬 이미징과 달리 NIR/상향변환 나노프로브의 이미징에는 다음과 같은 특정 기능을 갖춘 장비가 필요합니다.
- 일반적으로 사용되는 기존 컨포컬 현미경의 여기 파장은 400~650nm이지만, 근적외선 이미징에는 700nm 이상의 파장을 사용하는 NIR 레이저가 필요합니다.
- 스캐닝 검류계, 대물렌즈, 회절 격자와 같이 기존 이미징에 사용되는 대부분의 광학 경로 부품은 가시 범위에서 반사 방지/보정만 지원하며 NIR의 이미징 효율성과 정확도를 제공할 수 없습니다.
- NIR 감지에는 750nm 이상의 전용 NIR 감지기가 필요합니다.
이러한 요구 사항을 충족하기 위해 FLUOVIEW™ FV4000 레이저 컨포컬 현미경은 NIR 이미징 솔루션을 제공합니다(그림 5). FV4000 시스템은 더 많은 색상으로
매우 민감하고 정확한 NIR 이미징을 전문으로 합니다.
|  |
그림 5. 모듈식 FLUOVIEW FV4000 컨포컬 레이저 스캐닝 시스템은 NIR 이미징 솔루션을 제공합니다. |
Kai Li 박사(중국 남부 과학기술대학)와 함께 준비한 이 애플리케이션 노트에서는 NIR 형광 분자, BTB 기반 나노입자의 종양 세포에 대한 표적화 능력을 알아보기 위해 FLUOVIEW NIR 솔루션을 성공적으로 사용한 사례를 확인할 수 있습니다. (그림 6) 이 연구의 연구자들은 Arg-Gly-Asp(RGD) 표적 펩타이드로 BTB 나노프로브의 표면을 개질하고 BTB-RGD NP를 주사한 생쥐가 48시간 동안 종양 부위에서 BTB 나노프로브에 비해 NIR-II 형광 신호의 유의한 증가를 보임을 관찰했습니다.
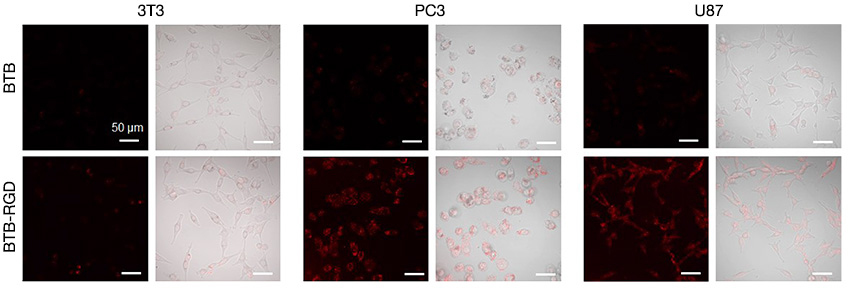
그림 6. 4시간 동안 40μg mL-1의 BTB-RGD 또는 BTB NP로 FV3000 Red를 사용하여 배양한 3T3, PC3 및 U87 세포의 컨포컬 이미지.
여기 파장: 730nm, 필터: 760~890nm, 스케일 바 = 50μm.
FLUOVIEW 다광자 현미경 심층 감지 솔루션을 사용한 종양 표지자 생체 내 이미징
암은 우리 사회의 가장 심각한 공중 보건 문제 중 하나입니다. 악성 종양의 조기 진단과 정확한 절제는 현재 의학 연구의 최우선 과제입니다. 종양 표지자의 특정 식별과 고분해능 생체 내 이미징을 위한 새로운 형광 나노프로브의 설계 및 개발은 악성 종양의 조기 임상 진단과 정확한 외과적 절제를 위한 새로운 검출 솔루션을 제공할 수 있습니다.
종양 세포에서 알칼리성 인산분해효소(ALP)와 같은 효소의 과발현은 종양의 발생, 발달, 진행에 대한 중요한 임상 지표입니다. 따라서 ALP 활성에 높은 민감도를 제공하는 신속한 검출 방법은 종양의 조기 발견과 정확한 절제에 도움이 될 수 있습니다. 2020년에 Xiaojun Peng 교수와 그 팀은 이러한 목적으로 설계된 나노프로브의 사용에 관한 논문을 발표했습니다. 이 논문은 종양 세포에서 과발현된 ALP와 상호작용한 후 응집 시 강한 형광을 방출하는 AIEgen 프로브(DQM-ALP)를 어떻게 설계하고 준비했는지 자세히 설명했습니다. 이렇게 설계한 나노프로브는 기존의 유기 염료에서 응집으로 인한 형광 소광 문제를 피함으로써 종양 세포에서 프로브의 검출 감도와 체류 시간을 증가시켰습니다. 이 연구는 나트륨 부티레이트와 코르티솔 자극에 의해 종양 세포에서 ALP 활성의 상향 조절을 발견한 최초의 연구였으며, 2광자 현미경을 사용하여 HeLa 및 HepG- 2 종양 스페로이드로 ALP 활성에 대한 높은 공간 분해능 3차원 심층 이미징을 달성했습니다. 이 논문은 1mm 미만 종양의 형광 검출 이미징에서 프로브의 유용성을 입증하여 종양의 임상 진단과 외과적 절제를 위한 강력한 지원 도구를 제공했습니다.[5]
위의 연구에서는 1광자 및 2광자 컨포컬 현미경을 사용했습니다. 그러나 독점적인 고속 공진 주사 검류계와 고감도 광학 검출 경로를 사용하여 생체 내 심층 형광 이미징을 위해 설계된 최신 FLUOVIEW 다광자 현미경은 더 정확하고 효율적인 방식으로 종양 표지자의 고분해능 3D 심층 이미징을 달성할 수 있습니다(그림 7).
Evident 다광자 시스템은 듀얼 라인/듀얼 레이저와 최대 6개 채널의 고감도 검출을 함께 활용하여 더 유연한 다색 이미징을 지원함으로써 검출 처리량과
효율성을 더욱 높입니다.
|  |
그림 7. 심층 이미징을 위한 모듈이 있는 FV4000MPE 다광자 시스템 |
IXplore™ SpinSR Rapid Super Resolution 솔루션을 사용하여 살아있는 세포에서 나노프로브로 동적 검출
살아있는 세포의 생화학적 반응과 기타 분자 사건은 종종 상당한 시공간적 동적 특성을 갖습니다. 광학 이미징 기술은 나노프로브의 움직임을 정확하게 추적하고 생체분자와의 상호작용을 연구할 수 있습니다. 이를 통해 연구자는 이러한 바이오마커를 효과적으로 모니터링하여 그 상태와 관련 세포 기능 사이의 관계를 추가로 탐색하기 위해 동적 변화를 관찰할 수 있습니다. 엔도솜, 리소좀 및 기타 세포소기관은 신호 전달과 대사 항상성의 유지에 중요한 역할을 합니다. 이러한 소기관의 pH는 세포내이입 중에 변하기 때문에 이러한 소기관의 pH 값을 신속하고 민감하게 검출하는 것은 세포내이입 과정의 동적 모니터링 및 그 상태와 세포 기능 사이의 관계 탐색에 관한 연구의 초점이 되었습니다.
2016년 베이징 대학 Yiguang Wang 교수와 텍사스 대학 사우스웨스턴 메디컬 센터 교수 Jinming Gao 연구팀은 단일 소기관 분해능에서 초고감도 pH 나노프로브(HyUPS)를 설계한 논문을 발표했습니다. 이들은 이 나노프로브를 사용하여 세포내이입 중에 엔도솜/리소좀 및 기타 세포소기관의 pH 변화를 추적하고 검출했습니다. 이 프로브는 세포내이입의 세 가지 구성 요소와 세 가지 pH 범위에 해당하는 세 가지 pH 민감성 구성 요소를 포함하며, 각각 빨간색, 녹색, 파란색 형광단으로 표시됩니다. 이 프로브는 살아있는 세포에서 세포내이입에 관여하는 세포소기관의 산성화 속도에 대한 실시간 및 다색 동적 모니터링을 성공적으로 달성하여 엔도솜/리소좀 기능 장애 질환에 대한 추가 연구를 위한 새로운 이미징 도구를 제공했습니다.[6]
살아있는 표본의 나노프로브 이미징에는 고속 이미징 장비가 필요하며 기존의 포인트 스캐닝 컨포컬 접근 방식은 요구 사항을 충족하지 못합니다. IXplore SpinSR 회전 디스크 컨포컬 초분해능 이미징 시스템은 초분해능(110nm) 품질에서 빠른(200fps) 다색 이미징을 달성할 수 있습니다(그림 8). 이러한 기능을 통해 미세 구조의 빠른 동적 프로세스를 포착할 수 있으므로 생명과학 연구자가 이미징 효율성을 쉽게 개선할 수 있는 강력한 도구가 됩니다. 독점 RTCe(실시간 컨트롤러)는 여기광이 검체에 미치는 영향을 최소화하기 위해 모든 구성 요소의 동기화된 작동을 제어합니다. 이 장점은 심층 생검을 위해 설계된 실리콘 오일 대물렌즈와 함께 살아있는 세포, 스페로이드, 오가노이드 검체의 장기적이고 정확한 심층 이미징을 가능하게 합니다.
PKMDR 염료로 염색된 상피 세포 미토콘드리아를 보여주는 그림 9에서 IXplore SpinSR 시스템의 초분해능 이미징 기능의 예를 참조하십시오. 베이징 대학의 Zhixing Chen
교수가 개발한 PKMDR은 형광 및 나노 영상 이미징에서 광독성을 최소화하는 미토콘드리아 프로브입니다.
| |
그림 8. IXplore SpinSR 회전 디스크 컨포컬 초분해능 이미징 시스템 |
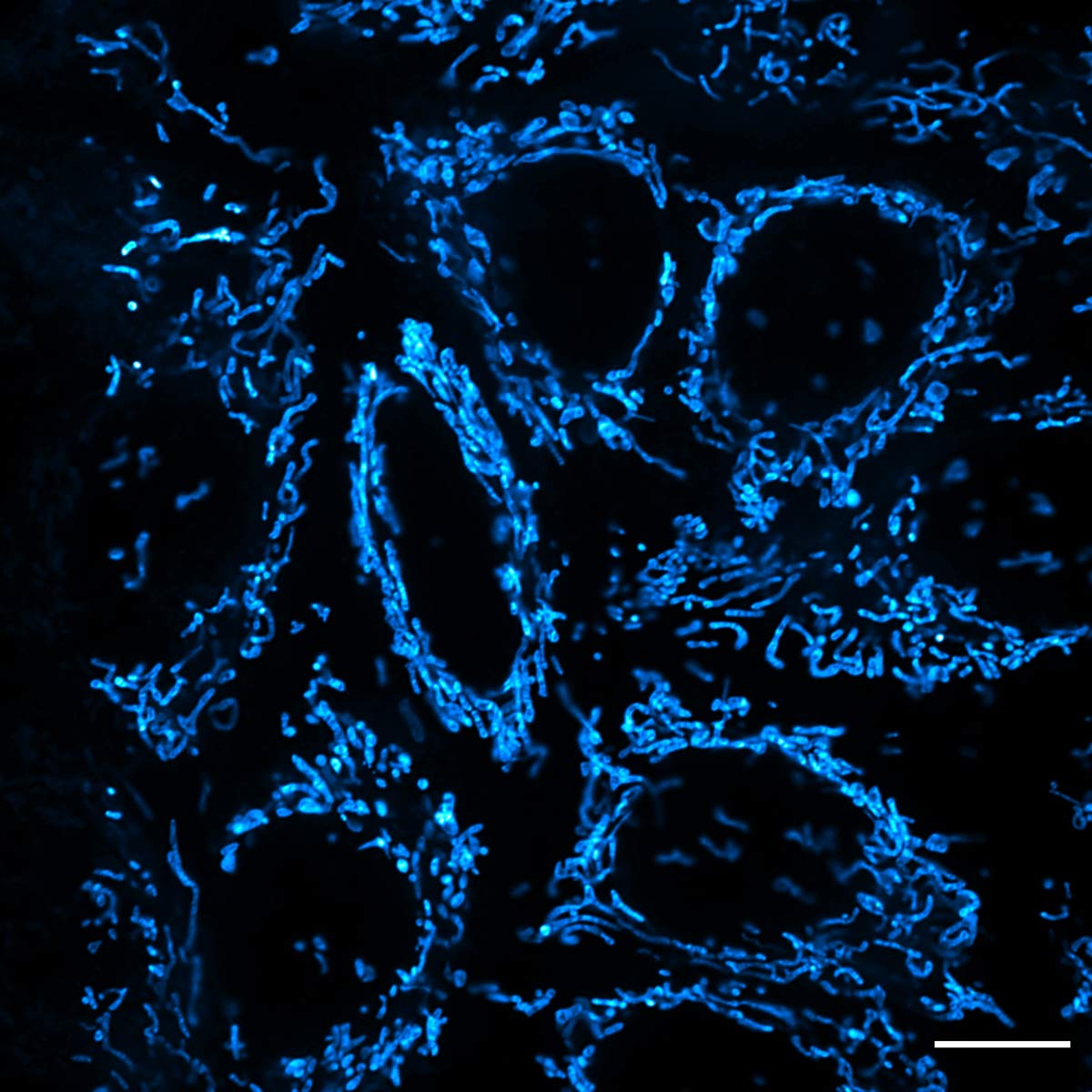
그림 9. IXplore SpinSR 시스템, UPLAPO60XOHR 대물렌즈, TruSight™ 처리를 사용하여 PKMDR 염료로 염색한 상피 세포 미토콘드리아의 초분해능 이미지. 이미지 제공: Huiwen Hao 박사, Junsheng Yang
박사, Yujie Sun 교수 및 Zhixing Chen 교수. Standard Imaging Co., Ltd. 및 베이징 대학 미래기술단과대학의 Sun Lab NanJing GenVivo Biotech Co., Ltd.
지난 10년 동안 나노기술과 광학 이미징 기술의 급속한 발전으로 형광 나노프로브를 사용하는 생화학적 이미징 응용에서 많은 중요한 발전이 이루어졌습니다. 그러나 형광 나노프로브의 적용은 생체 적합성, 형광 깜박임 동작의 존재 및 기타 단점으로 인해 여전히 제한적입니다. 나노물질과 바이오이미징 기술, 화학합성, 이론물리학, 영상분석의 지속적인 개발과 집적화로 형광 나노프로브 바이오이미징의 특이성, 정확성, 안정성, 재현성이 더욱 향상되어 더 넓은 범위의 연구 분야에서 더 중요한 역할을 할 수 있는 잠재력이 확대될 것으로 기대됩니다.
*이 문서는 2022년 10월 6일 게시된 원래 내용을 업데이트한 것입니다.
참고문헌:
[2]. Chang, H., Xie, J., Zhao, B., Liu, B., Xu, S., Ren, N., Xie, X., Huang, L., & Huang, W. (2014). Rare Earth Ion-Doped Upconversion Nanocrystals: Synthesis and Surface Modification. Nanomaterials (Basel, Switzerland), 5(1), 1~25.
[3]. Chen, Z., Wu, X., Hu, S., Hu, P., & Liu, Y. Multicolor upconversion NaLuF4 fluorescent nanoprobe for plant cell imaging and detection of sodium fluorescein. J. Mater. Chem. C, 2015, 3, 153~161

.jpg?rev=1A74)