어쩌면 당신은 연구실 폐쇠, 계획된 휴가 또는 갑작스러운 비상상황 등으로 인한 연구 중단을 경험한 적이 있을 것입니다. 어떤 상황이든, 시간이 흐른 후 연구를 재개한다는 것은 쉽지 않은 일입니다. 어떻게 구성하고 실험을 준비하고 목표를 달성하시나요?
연구실 업무를 다시 시작하기 쉽도록 실험을 준비하고 실행하기 위한 이 4단계 가이드를 만들었습니다.
1. 장비 전원 켜기
이 문제는 중요하지 않아 보일 수 있지만, 실제로는 장비의 전원을 잘못 켜면 시스템 성능에 부정적인 영향을 미칠 수 있습니다. 다음은 따라야 할 몇 가지 일반적인 지침입니다.
- 먼저 PC 켜기: 사용자의 PC는 현미경 시스템의 ‘뇌’이므로, 첫 번째 단계로 PC 전원을 켜고 로그인해야 함을 기억하십시오.
- 시스템의 모든 구성 요소 켜기: 시스템에 따라, 구성 요소를 켜는 순서가 중요할 수 있습니다. 예를 들어, Olympus 시스템의 CBH를 켠 후 TPC를 켜야 합니다. 특정 지침은 해당 설명서를 참조하십시오.
- 소프트웨어 실행: 소프트웨어 실행 중 오류가 발생할 경우 당사에서 도와드릴 것입니다! 해당 지역의 판매 담당자에게 연락하거나 여기에서 당사에 문의하여 기술 지원을 요청하십시오.
2. 이미징 준비
장비의 전원이 켜지면 시간을 할애하여 영상 촬영을 위해 샘플을 적절하게 준비하여 로딩하고 평평하게 만듭니다. 다음은 몇 가지 유용한 팁입니다.
샘플 준비
먼저 적절한 커버슬립(coverslip)을 선택합니다. 커버슬립은 #1.5 또는 0.17mm 두께(170µm)여야 합니다. 커버슬립 용으로 설계된 올림푸스 대물렌즈는 좋은 이미지 품질을 위해 적절한 두께가 필요합니다. 커버슬립이 너무 두껍거나 얇으면 광학 아티팩트가 생길 수 있습니다.
커버슬립 두께를 확인하고 표준 유리 슬라이드를 사용하십시오. 일부 애플리케이션에서는 플라스틱 슬라이드를 사용할 수 있습니다. 그러나, 형광 이미징에서 플라스틱은 자가형광성이 매우 높습니다. 이는 파란색 및 녹색 채널에서 강한 배경을 야기하고, 종종 빨간색 채널에서도 이를 유발합니다.
영상 촬영 전에 커버슬립 및 슬라이드를 청소하는 것도 중요합니다. 좋은 세정액은 70% 에탄올이 함유된 증류수입니다. 또 다른 옵션은 A.J. Funk and Co.의 스파클 광학 렌즈 클리너(Sparkle Optical Lens Cleaner)와 같은 광학 세정제입니다.
광학 장치 세척 시 항상 렌즈 페이퍼를 사용하십시오. 고급 화장지나 연구실 화장지는 마모성이므로 광학 표면을 손상시킬 수 있습니다.
샘플 로딩
다음으로, 준비된 샘플을 현미경에 맞는 방향으로 로딩합니다. 항상 커버슬립을 정립현미경에는 위로 향하도록 로딩하고 도립현미경에는 아래로 향하도록 로딩합니다.
도립현미경에서는 샘플이 잘 밀봉되었는지 확인하는 것이 중요합니다. 샘플이 잘 밀봉되지 않으면 대물렌즈 또는 대물렌즈 노즈피스에 액체가 닿을 수 있습니다. 이 액체는 광학 코팅, 광학 접착제 또는 현미경 하드웨어 및 전자장치의 다른 부품을 부식시키거나 산화시킬 수 있습니다.
샘플을 로딩할 때 대물렌즈의 작동 거리(working distance)에 특별히 주의를 기울이십시오. 간단히 말해서, 작동 거리는 대물렌즈가 표본에 초점을 맞추기 위해 얼마나 가까워야 하는지를 나타냅니다. 작동 거리는 100µm 이상의 아주 작은 값부터 몇 밀리미터까지 다양할 수 있습니다.
대물렌즈의 작동 거리를 찾아야 하나요? 각인된 사양 또는 당사의 온라인 대물렌즈 카탈로그를 확인하십시오.

그림 1. 도립현미경의 경우 슬라이드를 거꾸로 로딩해야 합니다. 흔한 실수는 도립현미경에 커버슬립을 위를 향하도록 놓고 슬라이드를 로딩해서 이미지가 흐려지는 것입니다. 항상 광학 표면이 깨끗한지 확인하고 렌즈 페이퍼를 사용하여 표면을 청소하십시오.
샘플 평평하게 하기
연구자들은 흔히 많은 상황에서 샘플 평탄도에 대해 걱정할 필요가 없습니다. 스테이지는 평평하게 고정되어 있으며 샘플 홀더와 슬라이드도 평평합니다.
하지만 공초점 현미경, TIRF 또는 타일링과 같은 세심한 작업이 필요한 애플리케이션에서는 샘플 평탄도가 매우 중요합니다. 샘플이 기울어져 있으면 음영(shading)이 발생할 수 있습니다. 음영은 이미지를 함께 스티칭할 때 아티팩트를 발생시키거나 이미지에서의 위치에 따라 강도가 변경될 수 있습니다.
샘플 평탄도를 개선하는 한 가지 방법은 일부 스테이지 인서트에 있는 레벨링 나사를 사용하는 것입니다. 일반적으로 이러한 나사는 스테이지 인서트의 가장자리에 있습니다. 잘못 정렬된 레벨링된 나사는 샘플을 기울어지게 하는 일반적인 원인이 됩니다. 스테이지 인서트로 인한 샘플 기울어짐이 걱정된다면 이러한 나사를 완전히 빼는 것이 합리적인 접근방식입니다.
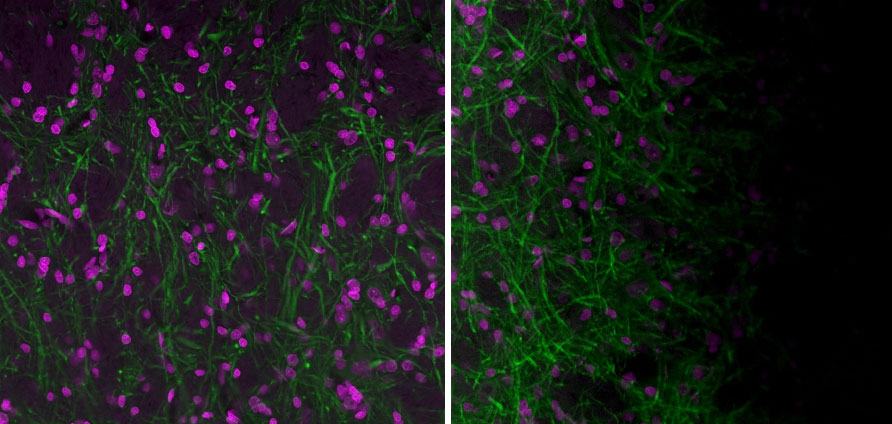
그림 3. 왼쪽: 잘 배열된 Olympus FV3000 레이저 스캐닝 공초점 현미경에서 평평한 샘플로 얻은 이미지. 오른쪽: 잘 배열된 FV3000 현미경에서 평평하지 않은 샘플로 얻은 이미지. 음영의 근원을 파악하기 힘든 경우가 있습니다. 종종, 샘플 홀더에서 평평하지 않은 샘플은 음영 아티팩트를 만들 수 있습니다. 20X UPlanXApo 대물렌즈로 얻은 이미지. 자홍색(magenta)은 Hoechst이고 녹색은 Alexa 488로 착색된 MAP2 (MCA-5H11)입니다.
이멀젼 매질 결정
Olympus는 크게 다섯 가지 종류의 대물렌즈 : 공기, 워터 이멀젼, 워터 디핑, 표준 오일, 실리콘 오일을 제공합니다. 잘못된 이멀젼 매질이 대물렌즈에서 사용되면 이미지 품질이 저하됩니다. 뿐만 아니라, 오일이 오일 사용을 위해 설계되지 않은 대물렌즈의 특정 부분으로 들어갈 경우 손상이 발생할 수 있습니다.
이러한 이유로 해서 대물렌즈용으로 고안된 이멀젼 매질을 아는 것이 중요합니다. 당사의 대물렌즈는 색상으로 구분되어 필요한 이멀젼 매질을 쉽게 인식하고 올바른 매질을 사용할 수 있습니다.
또한 사용자의 워크플로를 고려합니다. 실리콘 오일로 60X에서 촬영한 다음 즉시 60X 워터 이멀젼 대물렌즈로 전환하고 싶지 않을 수 있습니다. 실리콘 오일과 물을 섞으면 이미지가 선명해지지 않습니다. 뿐만 아니라, 워터 이멀젼을 사용하기 전에 슬라이드를 제거해서 청소해야 합니다.
마지막으로, 대물렌즈는 광학 장치용으로 설계되었으므로 대물렌즈의 제조업체에서 제공한 오일을 사용하십시오.

그림 4. 표준 오일 또는 이멀젼 오일 유형–F(왼쪽)와 실리콘 이멀젼 오일(오른쪽). Olympus는 많은 표준 오일용 렌즈와 실리콘 이멀젼 오일용 렌즈 몇 가지를 제공합니다. 올바른 오일을 사용하는 것이 이미징 성공에 필수적입니다. 커버슬립에서 이 두 오일을 섞지 마십시오.
3. 이미지 획득
이제 샘플이 준비되었으니 이미지 획득 단계로 진행하면 됩니다. 다음은 이미지 캡처에 유용한 몇 가지 팁입니다.
이미지 획득 모범 사례
공초점 또는 광시야 형광 현미경을 통해 이미지를 획득할 때는 일반적으로 낮은 조도와 높은 검출 민감도 또는 게인을 사용하는 것이 선호됩니다. 이 방법은 광퇴색(photobleaching) 및 생물학의 변화를 일으키는 유해 레이저 또는 아크등 방사 조도를 줄입니다.
특정 이온 채널과 사멸 경로는 여기광(excitation light)에 의해 활성화될 수 있습니다. 그러나 적절한 품질의 이미지를 생성하기 위해서는 충분한 조도를 사용해야 합니다. 조도가 높으면 아름다운 이미지를 생성할 수 있습니다. 여기광과 감지광의 균형을 어떻게 조절할지와 최종 실험 목표를 고려하십시오.
보정환 (Correction Collar)
당사의 일부 대물렌즈에는 보정환이 있습니다. 적절한 교육 없이 사용하기에는 혼란스러울 수 있습니다. 일반적인 지침은 다음과 같습니다.
- 커버슬립이 없는 경우 0.0, #1.5 유리덮개인 경우 0.17을 사용합니다.
- 보정환이 온도용으로 표시되었는지 확인합니다. 일부 대물렌즈는 실온 또는 37°C(98.6°F)에 따라 스케일이 다릅니다. 보정환을 설정하고, 이미징을 시작하고, 이미지 밝기에 대한 초점을 유지하면서 보정환을 최적화하십시오. 이 마지막 단계에서는 인내와 연습이 필요합니다. 최적화가 불가능하다면, 첫 번째 단계로 보정환을 0.0 또는 0.17의 일반 표시에 가깝게 두십시오.

그림 5. 세 가지 60X 대물렌즈. 60X UplanXApo 대물렌즈(오른쪽)는 표준 오일을 사용하고 보정환이 없습니다. 60X UplanApo 오일 대물렌즈(왼쪽)는 0.17(#1.5 커버슬립)로 설정된 보정환을 사용합니다. 60X UPlanSApo(중앙)는 실리콘 오일을 사용하고 보정환은 37˚C(98.6°F)에서 0.17(#1.5)로 설정됩니다. 보정환 위치를 최적화하는 것이 선명한 이미지를 얻는 데 열쇠일 수 있습니다.
콘덴서 정렬
형광을 주로 사용하는 경우, 정상적인 현미경 작동 중 콘덴서가 사용되지 않을 수 있습니다. 이 경우, 콘덴서 손잡이를 사용하여 콘덴서를 샘플에서 멀리 이동하십시오.
명시야, 위상차 또는 DIC 이미징을 사용하려는 경우, 첫 번째 단계는 일반적으로 콘덴서 정렬을 확인하는 것입니다. 명시야 모드에서는 샘플에 초점을 맞춘 다음 조리개를 닫아 콘덴서 리플렛을 시각화합니다. 이 프로세스는 10배 또는 20배 배율에서 대개 쉽게 수행됩니다.
슬라이드 표면에 맺힌 콘덴서 상의 모양이 흐릿 하거나,대물렌즈 중심부로부터 벗어나 있을 경우, Köhler 조명을 교정하여 콘덴서의 높이와 중심축 위치를 조정하십시오. Köhler 조명에 의한 콘덴서 정렬에 대한 정보를 보려면 온라인 현미경 리소스 센터를 방문하십시오.
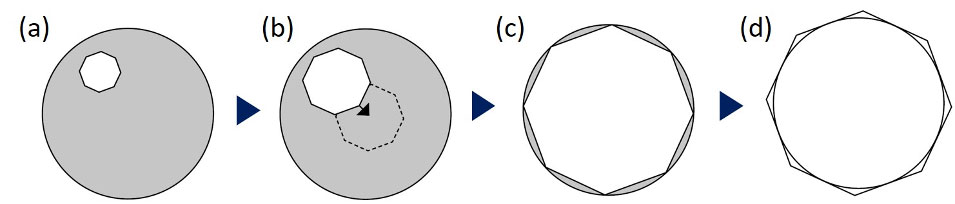
그림 6. 콘덴서 정렬 절차: (a) 조리개를 닫고 (b) 조리개 리플렛 중심을 중앙에 맞추고, (c) 정밀한 중심을 확인하여 시야의 가장자리에 리플렛이 내접하게 한 다음 (d) 리플렛을 둘러싸게 합니다.
파일 크기
현미경 파일은 매우 클 수 있습니다. 그러나 파일 크기를 간소화하기 위해 특정한 조치를 취할 수 있습니다. 예를 들어, 데이터가 필요 없는 경우 “만약을 대비해서” 모든 것을 이미지화한다는 생각은 실제로 삶을 더 힘들게 만들 수 있습니다.
필요한 해상도, 비트 깊이 및 시야로 필요한 것을 이미지화합니다. 필수 파일보다 큰 파일을 가지면 데이터 저장 및 데이터 처리에 원하지 않는 부담을 주므로, 필요한 것보다 많이 또는 적게 이미지화하지 마십시오.
파일 저장
가능한 한 빨리 파일을 저장합니다. 언제든지 컴퓨터 및 하드 디스크 드라이브 충돌이 발생할 수 있으므로, 두 곳 이상에 저장하십시오.
USB 메모리 또는 외장 하드 디스크 드라이브를 사용할 때 주의를 기울이십시오. 이들은 감염되기 쉬우며 컴퓨터 간에 바이러스 또는 맬웨어를 전파할 수 있습니다.
이미징 시스템 PC에서 감염이 발생했다는 사실이 즉시 확인되지 않을 수 있습니다. 시스템이 느려지거나 무작위로 충돌할 수 있습니다. 많은 이미징 시스템에는 시스템 성능을 저하시키지 못하게 하는 안티 바이러스 소프트웨어가 없습니다. 따라서 이미징 시스템 PC는 더 감염되기 쉽습니다.
이러한 위험을 줄이려면 외장 드라이브를 이미징 시스템 PC에 연결하기 전에 검사하십시오.
파일 형식
Olympus는 OIR, OIF, VSI 및 OIB와 같은 독점적 파일 형식을 사용합니다. 이러한 형식은 다음과 같습니다.
- 압축되지 않은 전해상도 이미지를 제공합니다.
- Olympus 이미징 시스템에 적합한 파일 아키텍처를 유지합니다.
- 이미징 매개변수에서 메타데이터를 기록합니다.
FIJI/ImageJ는 적합한 플러그인이 설치되어 있으면 이러한 Olympus 파일을 열 수 있습니다. 가능하면 Olympus 파일 형식으로 이미지를 유지하는 것이 좋지만, TIFF, JPEG 2000 또는 다른 형식으로 파일을 내보내는 것이 필요한 경우가 있습니다.
파일 내보내기 옵션 또는 이미지 파일 유형에 의해 발생할 수 있는 압축 또는 해상도 감소에 유의하십시오. 이미지는 종종 압축되고, 데이터 유실이 발생하므로, JPEG 이미지를 사용하지 마십시오.
4. 시스템 종료
시스템을 올바르게 종료하는 것은 적절하게 시작하는 것만큼이나 중요합니다. 다음은 몇 가지 모범 사례입니다.
사용 후 현미경 시스템 청소
이미징 완료 후 청소는 매너 있는 행동일 뿐만 아니라 하드웨어 손상을 방지하는 일입니다.
예를 들어, 오일 이멀젼 대물렌즈용 표준 오일이 대물렌즈에 남아 있는 경우 말라서 굳을 수 있습니다. 며칠 동안 남아 있었던 오일은 청소가 어렵고 다른 현미경 표면에도 튈 수 있습니다. 당사의 리소스, 올바른 대물렌즈 이멀젼 오일 제거를 위한 6가지 팁을 읽고 대물렌즈 렌즈 청소 방법을 알아보십시오.
슬라이드 또는 가성 투명화 시약의 매니큐어는 현미경 스테이지 또는 이미징 영역에서 발견되는 경우가 종종 있습니다. 특히 액체 또는 기타 잔여물이 보이는 경우 이러한 표면을 청소하십시오. 일반적으로 접안 렌즈, 터치 패널 컨트롤 및 포커스 핸들과 같이 흔히 만지는 표면은 모두 한 사용자에서 다음 사용자에게로 오염 및 감염이 가능한 영역입니다.
바이러스의 확산을 줄이려면 이러한 표면을 청소하는 것이 중요합니다. 터치 패널 컨트롤러 및 접안렌즈의 경우 70% 에탄올이 함유된 증류수에 적신 렌즈 페이퍼를 사용하는 것이 좋습니다. 알코올로 인해 고무가 손상되지 않도록 아이피스를 둘러싸는 고무 아이컵을 제거하십시오. 스테이지 표면, 에어 테이블 또는 작업대를 70% 에탄올이 함유된 증류수와 Kimwipes 또는 종이타월을 사용하여 청소하는 방법도 권장됩니다.
좋은 안내 원칙은 현미경 시스템을 처음보다 더 좋은 상태로 두는 것입니다. 이미징 후에는 현미경 영역에서 샘플을 제거하십시오. 대부분의 샘플은 37°C(98.6°F), 실온 4°C(39.2°F), -20°C(-4°F) 또는 -80°C(-112°F)에서 보관하는 것이 가장 좋습니다. 대부분의 슬라이드 또는 접시는 파손을 방지할 수 있게 보관하고 어두운 곳에 보관합니다. 일부 샘플은 세포 배양기에 반환해야 합니다.
더 많은 청소 팁은 당사의 일반 가이드: 현미경 청소 및 살균 방법을 참조하십시오.
현미경 시스템 종료
시스템을 올바르게 종료하면 다음과 같은 이점이 있습니다.
- 적절한 하드웨어 유지보수
- 다음 사용자를 위해 시스템이 준비되도록 함
시스템을 종료하기 전에 다음 사람이 언제 사용할 것인지 확인하십시오. 시스템을 즉시 사용할 경우 나머지 하드웨어를 모두 켜둔 상태에서 로그아웃하는 것이 좋습니다. 그러나 한 시간 이상 사용하지 않을 경우에는 시스템을 끄는 것이 좋습니다. 이를 통해 작동 시간에 따라 교체 및 정비해야 하는 레이저, 램프, 팬 및 기타 구성 요소의 사용을 줄일 수 있습니다.
항상 하드웨어 구성 요소를 종료하기 전에 소프트웨어를 종료하십시오. 예를 들어, 소프트웨어를 종료하기 전에 현미경 컨트롤 박스를 끄면 오류가 발생하고 다음 사용자가 문제를 겪게 될 수 있습니다. 소프트웨어는 이미징 시스템의 뇌와 같은 것임을 기억하십시오.
연구실 복귀를 위한 빠른 문제 해결 가이드
이미징 문제가 생기면 저희가 도와드릴 것입니다! 다음은 현미경 전문가가 연구실로 돌아갈 때 일반적인 문제에 대한 몇 가지 해결책입니다.
문제 #1: 내 이미지가 흐리게 보입니다. 이미지에 초점을 맞출 수 있지만, 이미지가 선명하게 보이지 않습니다.
제안사항: 렌즈 페이퍼를 사용하여 70% 에탄올이 함유된 증류수로 대물렌즈, 커버슬립 및 접안렌즈를 청소하십시오. #1.5 커버슬립을 사용하도록 하십시오. 마지막으로, 해당 대물렌즈에 대한 올바른 이멀젼 매질을 사용 중인지 확인하십시오.
문제 #2: 대물렌즈를 바꾸면 초점을 완전히 잃어버립니다.
제안사항: 동일한 초점 보정이 TPC 또는 소프트웨어(사용 가능한 경우)에서 설정되었는지 확인하십시오. 대물렌즈가 완전히 끼워졌는지 확인하십시오. 대물렌즈 이멀젼 요구사항을 확인하십시오. 여기엔 올바른 이멀젼 매질을 사용 중인지, 그리고 이 매질이 다른 매질과 혼합되지는 않았는지 확인하는 것이 포함됩니다. 낮은 배율에서 높은 배율로 이동할 때 초점을 조정해야 하는 것은 비정상이 아닙니다. 그러나, 높은 배율에서 낮은 배율로 이동할 때 초점이 상실되면 일반적으로 동초점(parfocality)에 문제가 있음을 나타내는 것입니다.
문제 #3: 형광 이미지를 보면 한쪽은 밝고 다른 한쪽은 어둡습니다. 이렇게 되면 안될 것 같습니다.
제안사항: 먼저, 한쪽은 밝고 다른 한쪽은 어두운 이 패턴이 XY의 스테이지 또는 샘플을 바꿀 때도 그대로인지 확인합니다. 패턴이 계속되면 샘플이 평평하지 않을 수 있다는 것을 고려하십시오. 샘플이 평평하게 나타나면 레이저나 아크등이 잘못 배열된 것일 수 있습니다. 문제가 레이저 또는 아크등이라고 의심되면 형광 여기광 경로를 정렬해보기 전에 지원을 요청하십시오. 현지 판매 담당자 또는 Olympus 기술 지원 센터에 문의하십시오.
문제 #4: 다른 소프트웨어에서 이미지를 열면 이미지가 Olympus 소프트웨어에서 열 때처럼 좋게 보이지 않습니다.
제안사항: Olympus 소프트웨어의 다른 설치 장치에서는 파일을 열 수 있습니까? Olympus 소프트웨어 솔루션 내에 두는 것이 해상도 또는 메타데이터 정보를 유지하기 위한 가장 편리한 방법입니다. 분석 소프트웨어에서 TIFF 또는 다른 일반 파일 형식을 요구하면 RAW, 전해상도 TIFF 파일을 사용하십시오. 이러한 원시 TIFF 파일은 이미징 소프트웨어에서 열지 않으면 종종 검게 나타납니다. 또한 이미지에 줌을 적용할 때 일부 Olympus 소프트웨어는 보간을 수행합니다. 충분한 줌을 적용할 때 모든 소프트웨어가 픽셀을 보간하는 것은 아닙니다. 이렇게 해서 Olympus 소프트웨어에서 이미지가 FIZI/ImageJ와는 다르게 보이는 경우가 있을 수 있습니다.
문제 #5: 제 연구실에서는 수년간 #1 커버슬립을 사용해왔고, 연구실에는 많은 사용 사례가 있습니다. #1.5 커버슬립으로 바꾸는 것이 얼마나 중요한가요?
제안사항: Olympus 대물렌즈는 워터 디핑 렌즈가 아닌 경우 #1.5 커버슬립용으로 설계되었습니다. 대물렌즈와 표본 사이에 유리가 충분하지 않으면 광학 아티팩트가 발생합니다. 이 정도는 실험 및 이미징 요구사항에 따라 달라집니다. 어쨌든 이미지가 가능한 만큼 분해되지 않고 이미징이 최적화되지 않습니다. 가능한 한 빨리 #1.5 커버슬립으로 변경하는 것이 좋습니다.
.jpg?rev=4C75)
