FLUOVIEW FV3000 공초점 현미경을 사용한 DNA 복구 단백질 시각화
레이저 유발 DNA 손상 후 U2OS 세포의 라이브 셀 이미징
2중 가닥 DNA 절단은 DNA 손상의 가장 해로운 형태 중 하나입니다. 손상에 대응하여 절단 영역으로의 DDR 인자 동원, 세포 주기 확인점 신호 및 DNA 복구 활동의 조절을 유발하는 세포 내 DNA 손상 반응(DDR) 경로가 촉발됩니다. 절단 영역의 즉각적인 충실한 신호 표시 및 복구가 세포의 생존율과 암 발생을 초래할 수 있는 돌연변이의 방지에 매우 중요합니다. 따라서 DNA 복구 과정에 관련된 메커니즘을 이해하는 것이 대단히 중요합니다. 이 애플리케이션에서는 2중 가닥 DNA 절단 영역을 포함하여 레이저 유발 손상으로의 DNA 복구 단백질 동원을 FV3000 컨포칼 현미경으로 연구하기 위해 인체 골육종 상피 암세포(U2OS)를 사용하였습니다. 결과적으로 획득한 이미지를 통해 (1) 절단 영역으로 동원된 복구 단백질의 동태 및 누적 레벨을 판단하고 (2) DNA 절단 영역에서 내인성 전사제어인자와 DDR 경로 인자의 공동 국소화의 특징을 규정할 수 있었습니다.
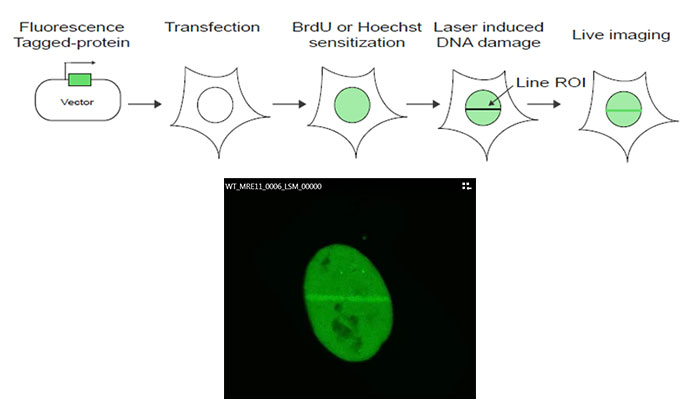
그림 1: 실험 프로토콜의 도식
MRE11 cDNA는 GFP 표지 발현 벡터로 복제된 후 U2OS 세포로 감염됩니다. 브로모데옥시우리딘(BrdU) 또는 Hoechst를 사용한 증감 후 FV3000 현미경의 405nm 레이저를 사용한 핵 내 관심 영역(ROI)의 라인 스캔에 의해 DNA 손상이 유발됩니다. 그런 다음 레이저 유발 손상에 대응하여 MRE11 동원 동태를 모니터링하기 위해 488nm 레이저를 사용하여 라이브 셀 이미징을 수행합니다.
이미징 조건
대물렌즈: 60X 초 보정 오일 이멀젼 대물렌즈(PLAPON60XOSC)
현미경: FLUOVIEW FV3000 레이저 스캐닝 컨포칼 현미경
레이저: 405nm(ROI 자극), 488nm(GFP, 녹색)
정량적 측정을 위한 부드러운 라이브 셀 이미징
타임 랩스 이미지 획득 과정에서 자극 레이저광에의 반복 노출은 광퇴색 및 광독성을 유발하여 실험에서 정량적 데이터 측정 확보 기능에 영향을 미칠 수 있습니다. 프로토콜에서는 레이저 유발 DNA 손상 직후 정량화할 수 있는 복구 단백질 동역학을 캡처하기 위해 부드러운 라이브 셀 이미징으로 강력한 레이저 자극의 균형을 유지해야 하였습니다. 이렇게 하기 위해 Olympus의 TruSpectral 검출 기술 및 고감도 GaAsP 검출기가 특징인 FV3000 컨포칼 현미경을 사용하여 라이브 셀의 연속 이미징에 필요한 레이저 파워를 최소화하였습니다. 또한 TruFocus를 사용하여 이미징 실험 전체에 걸쳐 초점을 유지하였습니다 이러한 기술 결합을 통해 DNA 절단 영역에서 DDR 인자 MRE11의 손상 의존적 누적에 대해 정량화할 수 있는 정확한 타임랩스 촬영 데이터를 획득할 수 있었습니다.
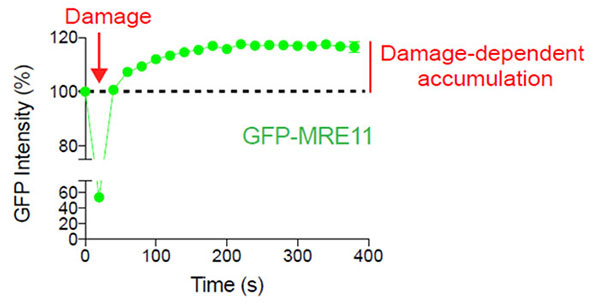 |
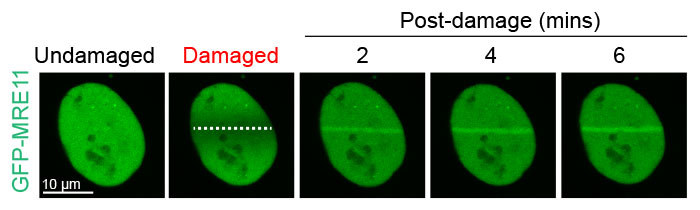
그림 2: DNA 절단 영역에서 MRE11의 손상 의존적 누적
GFP-MRE11 발현 U2OS 세포는 405nm 레이저와 뒤이은 488nm 레이저를 사용한 GFP의 타임 랩스 촬영 이미징에 의한 레이저 유발 DNA 손상을 받았습니다. DNA 손상 전후로 MRE11의 편재화를 시각화하고 정량화하기 위해 20초 간격으로 6분 동안 세포의 이미지를 획득하였습니다.
색수차 정밀 보정 대물렌즈를 통한 정확한 colocalization
가닥 절단 영역으로의 MRE11 동원의 동태 연구 외에 DNA 2중 가닥 절단에서 인산화되고 DDR 경로를 작동시키는 히스톤 단백질인 γH2AX와 후생적 전사 조절에 중요한 역할을 수행하는 단백질인 CHD4의 반응도 조사하였습니다. 정확한 공동 국소화 연구를 위해 색수차의 최소화가 중요하며 이를 통해 각기 다른 획득 채널의 중요한 측면 이동이 초래될 수 있습니다. Colocalization 연구에 미치는 색수차의 영향을 최소화하기 위해 Olympus의 PLAPON60XOSC2 색수차 정밀 보정 대물렌즈를 사용하여 측면 및 축방향 색수차가 거의 없는 신뢰할 만한 colocalization 를 획득하였습니다. 이를 통해 CHD4와 γH2AX가 핵 내 DNA 손상 영역에 colocalization한다는 판단을 내릴 수 있었습니다.
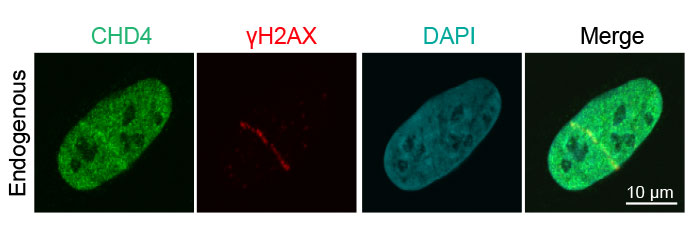
그림 3: DNA 가닥 절단으로의 내인성 DNA 손상 복구 단백질 동원
레이저 유발 DNA 손상 후 내인성 CHD4(녹색, Alexa Fluor 488)와 γH2AX(빨간색, Alexa Fluor 594)의 인체 골육종 U2OS 상피 암세포 검출. 중첩 이미지는 CDH4와 γH2AX의 colocalization을 나타냅니다.
FV3000 컨포칼 현미경에 의한 실험 촉진 방법
고효율 GaAsP 검출기가 장착된 전체 스펙트럼 시스템이 라이브 셀 이미징을 위한 고감도를 제공합니다
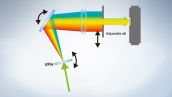
FV3000 현미경 시리즈는 VPH(Volume-Phase Holographic) 기술을 사용하여 투과된 빛을 회절시키는 Olympus의 TruSpectral 검출 기술이 특징입니다. 이 기술은 반사 유형 격자가 장착된 기존 스펙트럼 검출 장치보다 빛 처리량이 훨씬 더 높습니다. FV3000 현미경의 2채널 고감도 스펙트럼 검출기(HSD)는 신호 대 잡음비가 높은 45%의 양자 고효율을 위한 펠티어 냉각 GaAsP PMT로 TruSpectral 기술을 이용합니다. 이러한 검출 기술의 결합을 통해 강력한 고감도 검출을 제공하고 살아있는 조직 관찰에 필요한 레이저 파워를 최소화합니다.
낮은 색수차로 신뢰할 만한 공동 국소화 분석을 위한 PLAPON60XOSC2 색수차 미세 보정 대물렌즈
이 오일 이멀젼 대물렌즈는 405–650nm 스펙트럼의 측면 및 축방향 색수차를 최소화합니다. Colocalization 이미지가 확실하게 획득되며 우수한 위치 정확도로 측정이 가능합니다. 또한 대물렌즈는 850nm까지의 근적외선을 색수차를 보정하므로 정량적 이미징에 유리합니다.

낮은 색수차 대물렌즈
배율: 60X
NA: 1.4(오일 이멀젼)
W.D.: 0.12mm
색수차 보상 범위: 405 - 650nm
Olympus의 TruFocus 시스템으로 초점 유지
TruFocus 모듈은 광독성이 최소인 적외선(레이저 등급 1)을 사용하여 샘플 평면의 위치를 식별합니다. 원샷 자동초점(AF) 모드를 통해 사용자는 심도 있는 샘플의 여러 초점 위치를 설정하여 다위치 실험에서 Z 스택 획득 효율성을 증가시킬 수 있습니다.
Dr. Kyle Miller의 견해
Dr. Kyle Miller |
Dr. JaeJin Kim | 형광 이미징은 DNA 손상 영역에 대한 DNA 손상 반응의 편재화 및 동태를 분석하기 위해 DNA 손상 신호 및 복구 연구에 널리 사용되는 기법입니다. 이러한 요인이 단세포 분해능에서 DNA 병변을 검출하고 복구하는 방법을 식별하는 데는 이러한 정보의 획득이 대단히 중요하였습니다. FV3000 현미경을 통해 Miller 실험실의 Dr. JaeJin Kim 등은 레이저-극소방사선을 사용하여 DNA 손상을 생성하고 고정된 세포와 살아있는 세포 내 DNA 손상 반응 인자 거동을 연구할 수 있었습니다. 고감도 검출기, 자동 초점 기능 및 초 보정 대물렌즈의 사용이 가능하여 FV3000 현미경은 인체 암세포 내 DNA 손상 반응 경로에 대한 연구에 매우 효과적인 수단이 되었습니다. |
감사의 말
이 애플리케이션 노트는 다음 연구원들의 도움으로 작성되었습니다.
텍사스 대학 오스틴 캠퍼스, NMS, Dr. Kyle Miller 및 Dr. JaeJin Kim
이 애플리케이션에 사용되는 제품
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.

