FLUOVIEW FV3000 공초점 현미경을 사용한 스페로이드의 3D 저속 촬영 이미징: 항체 의존적 세포매개 세포독성(ADCC)의 48시간 연속 관찰
항체 의존적 세포매개 세포독성(ADCC)은 항체 약제의 작용 메커니즘의 하나입니다. 내추럴 킬러(NK) 세포 및 단핵 백혈구 같은 주효 세포는 항체로 결합된 표적 세포(예: 암세포)를 인식합니다. 주효 세포는 항체를 인식한 후 세포 용해를 유도하는 갑상샘 세포독성인자를 방출하여 표적 세포를 파괴합니다. 이 애플리케이션에서는 인체 EGFR 대상 치료용 단일클론 항체가 있는 데서 기능성 Fcgamma(FCγ) 수용체를 발현하는 인간 결장 암세포(HT-29) 및 NK 세포(KHYG-1)를 사용하여 3D 공동 배양 실험을 수행하고 FLUOVIEW FV3000 컨포칼 현미경을 사용하여 48시간 동안 이를 관찰하였습니다. ADCC의 결과적 3차원(3D) 이미징을 통해 NK 세포가 암세포를 공격하는 방법을 캡처할 수 있었습니다.
광독성이 감소된 3D 라이브 셀 스페로이드 이미징
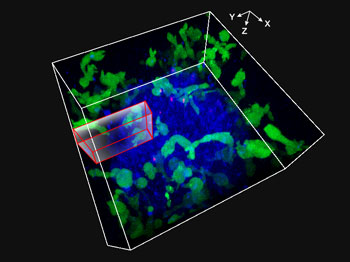
3D 배양 시스템(스페로이드라고 함)에서 생장한 세포 질량은 질량의 두께로 인해 이미지를 획득하기 어렵습니다. 검출될 만큼 강한 형광 신호를 생성하기 위해 더 높은 여기광 강도가 필요합니다. 하지만 여기광이 더 높을수록 광독성이 증가되어 세포가 손상됩니다. 이에 대처하기 위해 약한 형광 신호를 캡처하고 스페로이드 내 심도 있는 신호 생성에 필요한 레이저 파워를 최소화하도록 Olympus의 TruSpectral 검출 기술을 결합하는 FV3000 현미경을 사용하였습니다. 또한 심도 있는 관찰을 위한 고해상도로 더 밝은 이미지를 획득하기 위해 60X 실리콘 오일 이멀젼 대물렌즈(라이브 셀의 굴절률과 긴밀히 일치)를 사용하였습니다. 스페로이드가 NK 세포 매개 HT-29 세포 죽음으로 인해 허탈 상태(collapsed)가 되었기 때문에 이러한 두 기술을 결합하여 48시간 동안 스페로이드의 밝은 3D 타임 랩스를 성공적으로 캡처하였습니다.
관련 영상 |
그림 1: 48시간 동안 스페로이드 HT-29 종양 세포를 공격하는 3D 이미징 NK 세포에 의해 획득된 동영상
HT-29 세포(결장암에서 추출된 세포계)의 스페로이드로 기능성 Fcgamma(FCγ) 수용체 및 ZsGreen 형광 단백질을 발현하는 NK 세포계 KHYG-1(녹색)를 배양하였습니다. HT-29 세포의 표면을 항 EGFR 단일클론 항체 세툭시맙(Alexa Fluor 647, 파란색)으로 표지하였습니다. 프로피듐 요오드화물(PI)이 있는 데서 HT-29 및 NK 세포를 배양하고 48시간 동안 XYZT 이미징을 수행하였습니다. 핵 표지된 빨간색(PI의 세포 흡수 표시)이 세포 죽음의 지표로 사용되었습니다
이미징 조건
대물렌즈: 60X 실리콘 오일 이멀젼 대물렌즈(UPLSAPO60XS)
현미경: FLUOVIEW FV3000 시스템
레이저: 488nm(ZsGreen, 녹색), 561nm(PI, 빨간색), 640nm(Alexa Fluor 647, 파란색)
Z-드리프트보상 시스템으로 정확한 타임 랩스 이미징이 가능합니다
항체 약제의 효과를 평가하는 실험에 라이브 셀의 장기 이미징은 필수적입니다. NK 세포가 스페로이드 암세포에 미치는 영향을 더 정밀하게 캡처하기 위해 Z-드리프트보상기(IX3-ZDC2)를 사용하여 온도 변화 같은 외부 환경 변화로 인한 초점의 변경을 방지하였습니다. IX3-ZDC2를 통해 스페로이드에 대한 초점을 잃지 않고 장기간에 걸쳐 타임 랩스 이미지를 획득할 수 있었습니다. 이를 통해 NK 세포가 종양 질량에 공격을 가하고 들어가면서 모양을 적극적으로 변경하는 것을 확인할 수 있었습니다.
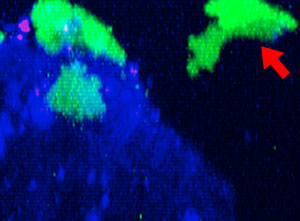 9h | 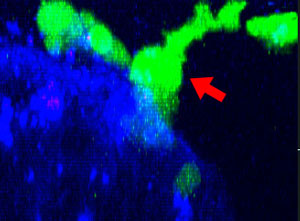 11h | 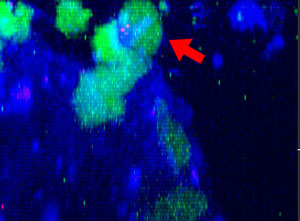 17h | 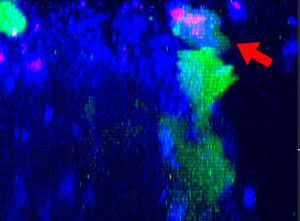 22h | 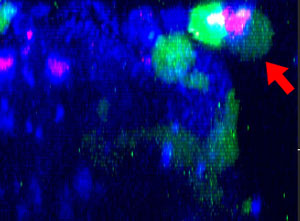 24h |
그림 2: 세툭시맙(파란색)으로 표지된 HT-29 종양 세포에 공격을 가하고 들어가면서 모양을 변경하는 NK 세포계 KHYG-1(녹색). PI 흡수(빨간색)는 세포 죽음을 가리킵니다.
FV3000 컨포칼 현미경에 의한 실험 촉진 방법
전체 스펙트럼 시스템이 고감도를 제공합니다
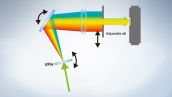
FV3000 시리즈는 부피 위상 홀로그램 장치를 사용하여 전송을 통해 빛을 회절시키는 Olympus의 TruSpectral 검출 기술을 이용합니다. 이 기술은 반사 유형 격자가 장착된 기존 스펙트럼 검출 장치와 비교하여 빛 처리량이 훨씬 더 높으며 심도 있는 조직 관찰에 필요한 레이저 파워를 최소화합니다.
Z-드리프트보상(ZDC) 시스템으로 초점 유지
IX3-ZDC2 Z-드리프트 보상기는 광독성이 최소인 적외선(레이저 등급 1)을 사용하여 샘플 평면의 위치를 식별합니다. 원샷 자동초점(AF) 모드는 심도 있는 샘플에 대해 원하는 대로 여러 초점 위치를 설정하여 다위치 실험에서 효율적인 Z 스택 획득을 가능하게 합니다.
관련 영상 |
라이브 셀 이미징용 실리콘 이멀젼 대물렌즈가 심도 있는 고해상도 관찰을 제공합니다
실리콘 오일의 굴절률(ne≈1.40)은 살아있는 조직의 굴절률(ne≈1.38)에 가까우므로 굴절률 불일치에 의해 야기된 최소 구면 수차로 살아있는 조직 내 심도 있는 관찰을 가능하게 합니다. 또한 실리콘 오일은 고갈되거나 경화되지 않으므로 오일을 재충전할 필요가 없으며 연장된 타임 랩스 관찰에 이상적입니다.
관련 영상 |
Dr. Yuji Mishima의 견해
Dr. Yuji Mishima | 특히 스페로이드 세포를 사용하여 항체 의학의 효과를 입체 구조적으로 평가하는 데 필요한 실험의 수에서 보듯이 최근 수년간 암 연구에서 형광 이미징의 수요가 증가하고 있습니다. 스페로이드는 그 두께로 인해 형광을 사용하여 관찰하기 매우 어렵지만 FV3000 현미경을 사용하여 48시간 전체에 걸쳐 스페로이드 암세포를 관찰할 수 있었습니다. ADCC 실험 내내 살아있는 암세포, 죽은 세포 및 주효 세포(NK 세포)가 항체 치료에 반응함에 따라 이들 세포를 정확히 측정할 수 있었습니다. FV3000가 항체 의학의 치료 효과를 평가하는 데 매우 효과적이었다고 생각합니다. |
감사의 말
이 애플리케이션 노트는 다음 연구원들의 도움으로 작성되었습니다.
JFCR의 암 화학요법 센터, Dr. Yuji Mishima
이 애플리케이션에 사용되는 제품
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.
