암 스페로이드의 높은 처리량 3D 분석을 위한 최적화 이미지 획득
요약
이 애플리케이션 노트에서는 암 스페로이드의 3D 분석에 필요한 품질을 갖춘 고속 이미지를 얻기 위해 컨포칼 현미경의 최적 이미지 획득 방법을 제시합니다. InSphero의 3D InSight™ 미세조직 플레이트를 사용하여 고속처리 약효 평가를 수행하였습니다.
・약제 평가 워크플로
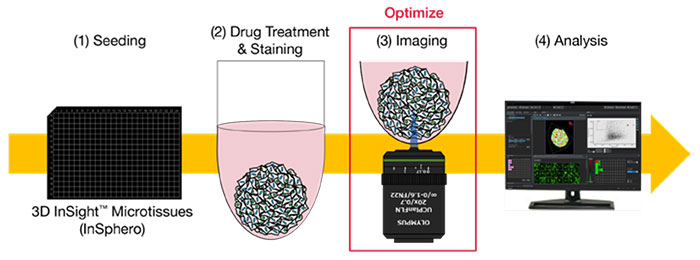
・이미징 조건의 최적화
이점
- NoviSight™ 3D 분석에 필요한 품질로 고속 이미지를 획득하기 위한 FV3000RS 현미경의 획득 설정 최적화.
- NoviSight 소프트웨어는 신호 대 잡음비가 높은 핵 신호 기반으로 인식된 객체로부터 신호 정보를 이용하기 때문에 이미지 품질이 낮은 객체를 분석할 수
있습니다.
서론
3D 암 스페로이드를 사용한 약제 성능 평가가 중요한 이유는 이 스페로이드가 암의 복잡한 체내 미세환경을 나타내기 때문입니다. 이를 통해 연구원들은 종양의 자연 환경과 더욱더 흡사한 조건에서 약효를 평가할 수 있습니다.
하지만 다수의 샘플의 광학적 슬라이스를 획득하는 것은 시간이 많이 소비될 수 있습니다. 이러한 워크플로의 속도를 촉진하기 위해 NoviSight™ 3D 분석에 필요한 품질로 고속 이미지를 획득하기 위한 FLUOVIEW™ FV3000RS 컨포칼 현미경의 최적 이미지 획득 설정을 확정하였습니다.
렌즈 보정환, 심도 방향의 스텝 크기 및 평균화 횟수를 포함한 획득 조건을 최적화하여 56분 23초 동안 Akura™ 384웰 플레이트(InSphero)에서 3D InSight™ 미세조직의 252개
샘플의 광학절편을 캡처하였습니다. NoviSight 소프트웨어를 통해 FV3000RS 컨포칼 현미경으로 고속에서 획득된 다중 샘플 이미지를 정확히 분석할 수
있었습니다.
방법
샘플 준비
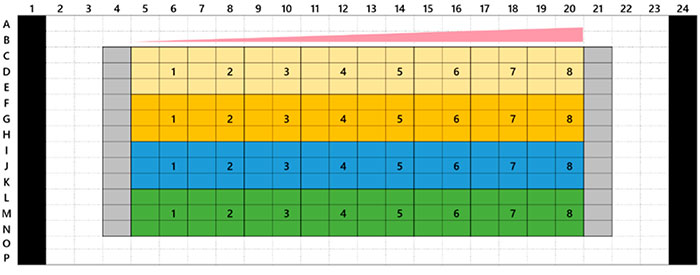
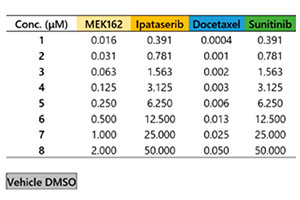
Akura™ 384웰 플레이트의 3D InSight™ 종양 미세조직은 InSphero에서 제공하였습니다. 녹색 형광 단백질 표지 세포계 HCT-116(인체 직장암)이 NIH3T3-RFP 섬유아세포와 함께 응집되었습니다. 각 참조 화합물에 대해 7일 처리(0일차에 투여, 4일차에 재투여)를 수행하였습니다. 그림 1은 플레이트 레이아웃과 시험 화합물 목록을 보여줍니다. 약물 처리 후 샘플을 1x 인산염완충식염수(PBS) 용액으로 세 번 세척하고 4°C(39.2°F)로 하룻밤 동안 4%파라포름알데히드 용액으로 고정시켰습니다. 그런 다음 샘플을 1x PBS 용액으로 세척하고 0.1% TritonX-100 용액에서 1μM TO-PRO-3(Thermo Fisher Scientific)으로 착색한 후 37°C(98.6°F)로 하룻밤 동안 SCALEVIEW-S4 투명화 시약으로 배양하였습니다.
|
|
그림 1 플레이트 레이아웃 및 시험 화합물 목록
이미징 및 분석
실험에서 RFP 및 TO-PRO-3 혼선을 피하기 위해 시퀀스 모드(시간이 두 배 더 걸림)로 이미지를 촬영하였습니다.
분석에서 모든 세포의 형광 신호(TO-PRO-3)를 통해 핵들을 인식할 수 있었습니다. 모든 세포는 GFP 및 빨간색 형광 단백질(RFP) 신호를 기준으로 HCT-116 세포 또는 NIH3T3
세포로 분류되었습니다.
결과
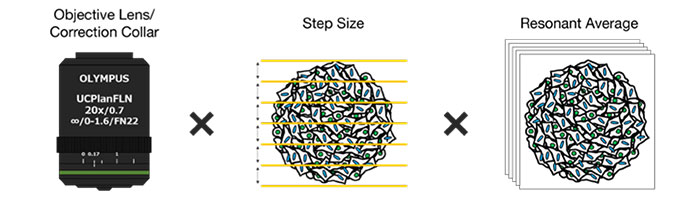
대물렌즈 보정환 최적화
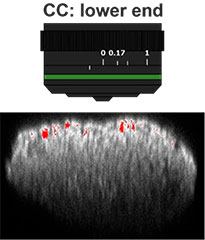
먼저, 대물렌즈의 보정환(CC)은 고해상도 및 고대비의 3D 이미지를 획득하는 데 최적화되었습니다. 이미징에는 작동 거리가 길고 개구수(NA)가 큰 UCPLFLN20X 대물렌즈가 사용되었습니다. 최고 대비 위치는 하단에서 시작하여 조금씩 다이얼을 변경하여 조정되었으며, CC = 0.17이 최적 조건으로 확인되었습니다(그림 2). 그 결과, UCPLFLN20X 대물렌즈로 Akura™ 384웰 플레이트를 관찰하기 위해 CC를 0.17로 조정하였습니다.
|
|
|
|
그림 2 대물렌즈 보정환 최적화(기준자=100μm)
Z 축 스텝 크기 최적화
다음으로, NoviSight™ 소프트웨어의 객체 인식 및 분석에 미치는 영향을 조사하였습니다. 그 결과, 스텝 크기에 따라 인식 정확도가 감소한 것이 밝혀졌습니다(그림 3). 심도 해상도의 절반에 해당하는 최소 스텝 크기(1.28μm)를 참조로 사용하였습니다. 분류 후 각 세포 수는 최소 스텝 크기(1.28μm)와 3μm(학생의 t-test) 간에 큰 차이가 없음을 보여주었습니다. 핵 크기가 대략 10μm 이므로 이 스텝 크기를 사용하여 각 핵에 대해 세 개의 이미지를 촬영하였습니다.
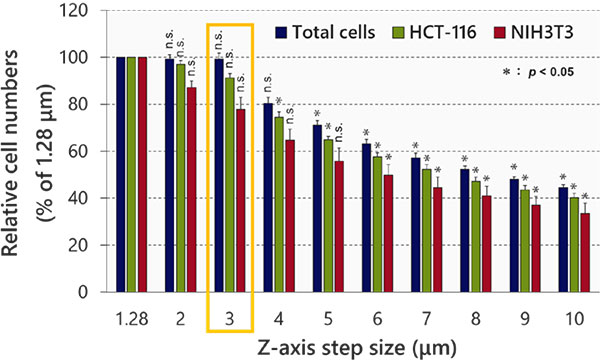
그림 3 스텝 크기 최적화
평균화 횟수 최적화(공진 스캔 모드)
FV3000RS 현미경의 공진 스캔의 이미지 품질은 평균화 횟수에 좌우됩니다. NoviSight 분석에 필요한 이미지 품질을 확보하기 위해 평균화 횟수를 최적화하였습니다. NoviSight 소프트웨어는 형광 신호를 사용하여 분석의 객체를 인식하므로 고해상도 이미지를 사용할 필요가 없습니다. 실험에서 신호 대 잡음비가 높은 핵들이 객체 인식에 사용되므로 기타 채널(GFP/RFP)의 강도 정보를 획득하는 것만으로 충분합니다. 공진 스캔의 평균 이미지와 갈바노 스캔에 의한 인식 정확도를 비교하였을 때 평균화가 수행되지 않은 경우에도 인식 정확도는 대조 표준과 거의 동일하였습니다(학생의 t-test)(그림 4). 이 실험에서는 평균화 없이 이미지 품질이 NoviSight 분석에 충분하였음이 증명되었습니다.
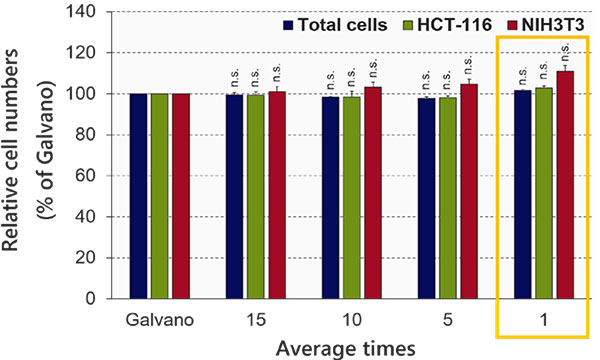
그림 4 평균화 횟수 최적화
최적화 조건에 따른 이미지
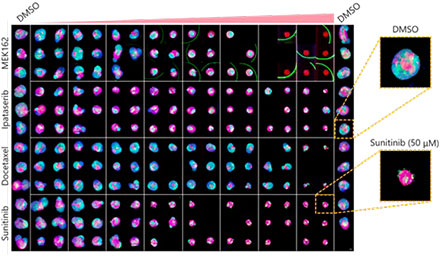
상기 조건 최적화(그림 5A)를 통해 56분 23초 동안 Akura™ 384웰 플레이트(InSphero)에서 3D InSight™ 미세조직의 252개 샘플을 캡처할 수 있었습니다(그림 5B). 그 결과, 각 약제가 용량 반응 방식으로 스페로이드 성장을 방해하는 것이 밝혀졌습니다. 또한 혈관 내피 성장 요인(VEGF)을 방해하는 분자 표적 약제인 Sunitinib의 고농도 처리를 통해 녹색 형광 단백질(GFP)의 강도가 현저히 감소되었습니다. 이는 암세포(GFP 표지 HCT-116)에만 영향을 미치는 것을 가리킵니다.
|
그림 5 최적 조건 및 이미징 결과(기준자=100μm) |
분석
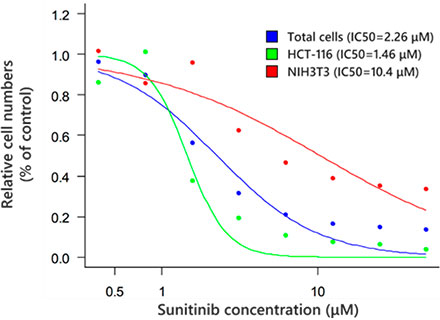
세포가 검출된 후(그림 6A) NoviSight™ 소프트웨어의 열지도를 사용하여 각 스페로이드의 총 세포 수를 확인하는 것이 쉽습니다(그림 6B). 분류 후 상대 세포 수의 비율을 계산하여 표시하였습니다(그림 6C). 분석 결과, 암세포(HCT-116, IC50=1.46 μM)의 성장에 영향을 미친 것이 밝혀졌습니다. 최적화된 조건에서 FV3000RS 시스템을 사용하여 고속 이미징으로 3D 약제 평가를 충분히 수행할 수 있었습니다.
|
|
결론
고속처리 이미징을 위해 최적화된 조건에서 FV3000RS 컨포칼 현미경을 사용하여 Akura™ 384웰 플레이트(InSphero)에서 3D InSight™ 미세조직의 252개 샘플의 이미지를 획득하였습니다. 본 연구에서는 한 시간 내에 이미징을 완료할 수 있고 NoviSight 3D 분석을 수행할 수 있음을 보여줍니다. 염료 혼합 및 샘플 크기 조정을 통해 처리량을 더 향상시킬 수 있습니다.
저자
Hiroya Ishihara, 생물학적 평가 기술 2, 연구개발
Takashi Sugiyama, 생물학적 평가 기술 2, 연구개발
이 애플리케이션에 사용되는 제품
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.