3D 스페로이드 모델의 세포 내 자가포식 경로의 정확한 3D 분석
요약
약효나 독성을 예측하는 데 3D 배양 모델이 사용되었습니다. 이 애플리케이션 노트에서는 세포 내 자가포식 경로에 초점을 맞춥니다. 먼저 모델의 자가포식 상태를 모니터링하는 데 EGFP-LC3 프로브의 유용성을 확인하였습니다. 그런 다음 FLUOVIEW™ FV3000 컨포칼 현미경 및 NoviSight™ 소프트웨어를 통해 Olympus의 정확한 3D 분석 워크플로를 사용하여 클로로퀸이라고 하는 약제 후보의 효과를 정량적으로 평가하였습니다. 이러한 분석 워크플로가 체내 연구를 사용한 프로파일링 약제 후보의 대안을 제공하는 것이 입증되었습니다.
서론
세포 내 분자 이벤트는 다양한 인체 내 병변과 긴밀한 관련이 있습니다. 자가포식은 세포 기관 및 단백질을 분해하고 재순환시키는 세포 내 과정이며,
자가포식의 조절장애는 인체 질병에 연루되어 있습니다. 이러한 질병 과정에 대한 이해를 높이고 이에 대한 약효를 시험하려면 병리적 및 치료적
조건에서 인체 세포의 자가포식 상태를 모니터링하는 것이 중요합니다.
스페로이드 또는 오르가노이드 같은 3D 배양 모델은 체내 미세환경의 복합체와 매우 흡사합니다. 스페로이드 내 세포에 대한 약효를 평가하려면 세포
내 미세한 이미지를 정량적으로 분석하는 것이 대단히 중요합니다. 이 애플리케이션 노트에서는 동적 분자 내 자가포식 과정을 평가하였으며 Olympus FV3000
컨포칼 현미경 및 NoviSight 분석 소프트웨어의 정확한 3D 분석 워크플로를 사용하여 약제 후보의 효과를 정량적으로 평가하였습니다.
이점
- 3D 배양 모델에서 분자 내 이벤트의 정량 분석
결과 및 논의
LC3 단백질은 자가포식 과정의 유용한 표지입니다. 예를 들어 자가포식소체가 누적되었을 때 EGFP-LC3 형광 점이 증가된 것으로 알려졌습니다. 자가포식소체 형성은 자가포식 활동이나 자가포식소체의 반전을 조절하는 다양한 화합물로 조절됩니다. 이러한 화합물의 일부는 현재 임상 시험 중입니다. 그 중 하나로 원래 항말라리아약인 클로로퀸(CQ)은 자가포식소체 및 리소좀의 융합을 억제하기 때문에 현재 암치료를 위한 임상 시험에 있습니다.
2D 배양 시스템을 사용한 자가포식 표지의 확인
2D 배양 시스템에서 자가포식 과정에 대한 CQ의 억제 효과를 측정하기 위해 EGFP-LC3 프로브의 유용성을 확인하였습니다. EGFP-LC3을 안정되게 발현하는 U2OS 골육종
세포계를 준비하였습니다. 세포는 마이크로플레이트 웰에서 단분자층으로 배양되었습니다. CQ 추가 후 Hoechst 33342로 세포를 고정시키고 착색하였습니다.
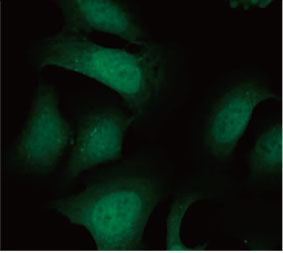
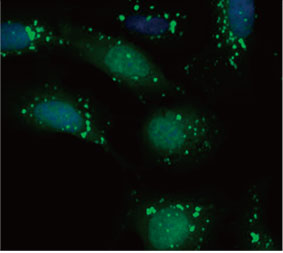
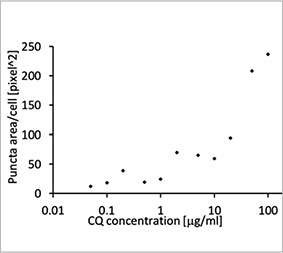
형광 이미지는 CQ 처리가 EGFP-LC3 반점의 형성을 이끌어낸 것을 보여주었습니다(그림 1 A 및 B). 각 세포의 핵의 위치를 기준으로 세포당 반점 영역을
측정하였습니다. CQ의 농도가 증가됨에 따라 반점 영역이 증가됨으로써 자가포식 과정을 측정하는 데 EGFP-LC3의 유용성이 확인되었습니다.
(A)
| (B)
| (C)
|
그림 1 A 및 1 B: (A) 정상 조건에서 배양된 U2OS 세포 발현 EGFP-LC3. (B) 한 시간 동안 CQ로 처리된 U2OS 세포 발현 EGFP-LC3. 그림 1 C: CQ 농도의 증가와 함께 표시된 세포당 반점 영역의 증가. | ||
암 스페로이드 모델 내 LC3 반점의 정량화
3D 배양 모델의 자가포식 상태를 모니터링하기 위해 자궁경부암에서 설정된 HeLa 세포계를 선택하였습니다. HeLa 세포는 비계가 없는 3D 배양 프로토콜에
적합하며 균일한 크기의 암 스페로이드를 형성합니다. EGFP-LC3을 안정되게 발현하는 HeLa 세포계를 준비하였습니다.
세포는 원형 바닥의 저부착성 마이크로플레이트에 파종되었습니다. 5일간의 배양 후 7시간 동안 스페로이드를 CQ로 처리하였습니다. 그런 다음
스페로이드를 고정시키고 막 투과성을 갖추게 하고 핵을 착색한 다음 SCALEVIEW-S4로 최종 투명화 하였습니다(FUJIFILM WAKO).
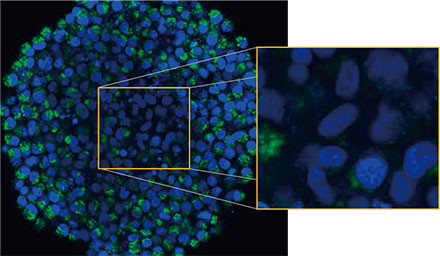
Olympus의 FLUOVIEW™ FV3000 컨포칼 시스템을 사용하여 스페로이드를 관찰하였습니다. 높은 개구수(NA)와 감소된 구면 수차로 인해 실리콘 이멀젼 대물렌즈(UPLSAPO30XSIR)를
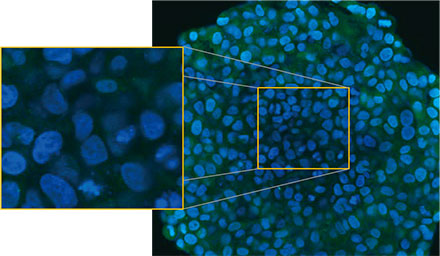
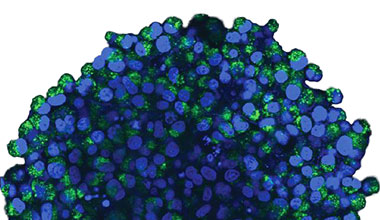
사용하였습니다. 그림 2 (A)*는 적도에서 비처리 스페로이드의 Z 슬라이스 이미지를 보여줍니다. EGFP 신호가 세포에 균일하게 나타났습니다. 이와
대조적으로 CQ 처리는 세포 내 반점 EGFP 신호의 형성을 유도하였습니다(그림 2 (B)*). 스페로이드의 주변부와 중심부에 모두 반점 형성이 관찰되었습니다. CQ
처리는 스페로이드의 크기에 분명한 변경을 야기하지 않았으며 이는 세포 내 자가포식 과정이 3D 암 스페로이드 내 CQ의 효능을 평가하기 위해 개선된
표지일 수 있는 것을 나타냅니다.
3D 배양 모델에서 세포 내 이벤트를 정량적으로 분석하기 위해 FV3000 컨포칼 현미경을 사용하여 캡처된 이미지와 기존 분석 방법보다 더 많은 이점을
제공하는 NoviSight™ 소프트웨어를 사용한 분석을 결합하는 Olympus의 정확한 3D 분석을 사용하였습니다. 기존 분석에서는 다중 Z 슬라이스 이미지에서 인식된
객체의 통합된 특성 값을 사용하거나 다중 Z 슬라이스 이미지들 중 투사 이미지를 분석하게 됩니다. 이러한 방법은 관심 객체의 다중 계산이나 다른
객체에 의해 중첩되고 흐려진 관심 객체의 실종을 야기할 수 있기 때문에 신뢰할 수 없습니다. 이와 대조적으로 Olympus의 정확한 3D 분석 워크플로에는 FLUOVIEW™
소프트웨어에 의해 최적화된 Z 간격의 순차적 Z 슬라이스 이미지의 획득이 포함됩니다. 소프트웨어는 3D 부피를 복원하고 관심 객체를 화소 클러스터로
인식하였습니다. 그런 다음 NoviSight 소프트웨어는 통계 분석에 사용됩니다 FLUOVIEW에서 NoviSight 소프트웨어까지의 워크플로는 간단하며 3D 배양 모델의 분석을 위한
이상적인 플랫폼을 제공합니다.
(A)
| (B)
|
그림 2 A 및 2 B: (A) 정상 조건에서 (B) CQ로 처리된 HeLa 세포 스페로이드 발현 EGFP-LC3. 확대된 이미지는 원래 스페로이드 이미지의 노란색 직사각형 영역을
보여줍니다.* | |
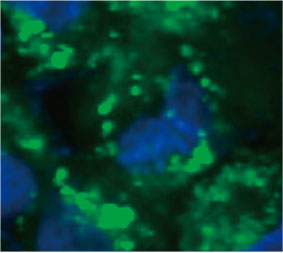
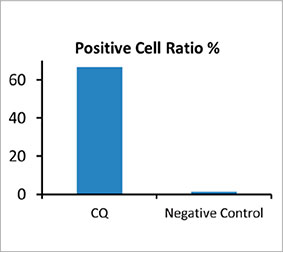
스페로이드 내 자가포식 양성 세포 수를 계산하기 위해 소프트웨어가 각 세포의 핵을 식별하였습니다. 다음으로 각 핵 주위의 영역은 마스크
영역으로 정의되었습니다. 마지막으로 마스크 영역 내 EGFP 신호의 반점은 반점 객체로 인식되었습니다(그림 2 (C)*). 반점이 3개 이상인 세포는 자가포식
양성 세포로 간주되었습니다. 약물 처리 없는 3D 스페로이드는 약 1.4% 자가포식 양성 세포를 보였으며 CQ로 처리된 스페로이드는 66.6% 자가포식 양성 세포를
보였습니다(그림 2 (D)*). 또한 정량 분석은 CQ가 암 스페로이드 내에 반점이 형성되도록 유도한 것을 지원합니다.
(C)
|
| (D)
|
그림 2 C 좌측: CQ로 처리된 스페로이드 내 세포의 원래 이미지. 우측: 반점에 대한 객체 인식이 있는 동일한 이미지(빨간색 직사각형).* | ||
결론
Olympus FLUOVIEW FV3000 컨포칼 현미경과 정확한 3D 분석 워크플로의 일환으로 NoviSight 소프트웨어를 사용하여 3D 배양 모델의 세포 내 자가포식 과정에 대한 CQ 의 영향을 정량적으로 평가하였습니다. 본 연구에서는 연구원들이 이러한 워크플로를 사용하여 투여 의존적 방식으로 약효의 개요를 작성하거나 다중 약제 후보를 객관적으로 가려낼 수 있음을 보여줍니다. 형광 표지된 신호 분자의 염색체 또는 전위에 대한 FISH 신호 같은 약효 또는 약물 독성에 관련된 기타 세포 내 분자 표지들이 있습니다. 이 워크플로는 3D 배양 모델의 세포 내 다양한 워크플로를 정량적으로 평가하는 데 도움이 될 수 있으며 체내 연구 대신에 약제 후보의 대체 프로파일링을 제시합니다.
참고문헌
- Maria C et al., (2019) Targeting autophagy to overcome human disease. International Journal of Molecular Sciences. 20(3): E725. doi: 10.3390/ijms20030725
- Yan C et al., (2013) Therapeutic targeting of autophagy in disease: Biology and Pharmacology. Pharmacological Reviews. 65: 1162–1197. doi: 10.1124/pr.112.007120
- Daniel JK et al., (2008) Guidelines for the use and interpretation of assays for monitoring autophagy in higher eukaryotes. Autophagy. 4(2): 151–175. doi: 10.4161/auto.5338
저자
Kazuhito Goda
*비록 헬라 세포가 의료 연구에서 가장 중요한 세포주가 되었다고 해도, 과학에 대한 Henrietta Lacks의 공헌이 동의를 받지 않은 것이었다는 것을 인정해야만
합니다. 이로 인해 면역학, 전염병, 암에 대한 중요한 발견이 이루어졌지만 사생활, 윤리, 의학적 동의에 대한 중요한 논의도 촉발되었습니다.
Henrietta Lacks의 삶과 현대 의학에 대한 그녀의 공헌을 알아보려면 여기를 클릭하세요.
http://henriettalacksfoundation.org/
이 애플리케이션에 사용되는 제품
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.