약효 평가에서 약물 반응의 이미징
색인
1.스페로이드 약물 반응 이미징(칼슘 이온 변동)
오가노이드와 스페로이드(세포 응집체)는 2D 배양 세포를 사용한 기존의 평가에 비해 실제 생체 조직과 더 유사한 방식으로 반응하는 3D 모델입니다.약물 효능 평가 분야를 위한 약물 개발 연구에서 오가노이드와 스페로이드의 필요성이 증가하고 있습니다.마찬가지로, 광독성 감소와 배경 형광 노이즈의 부재를 비롯한 이점으로 인해 형광 단백질(FP)보다 발광 단백질(LP)을 사용해야 하는 발광 이미징에 대한 관심이 증가하고 있습니다.
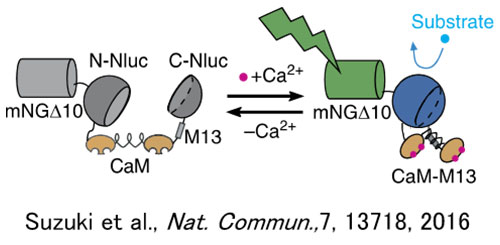
의약품의 주요 표적 분자군인 세포 수용체 GPCR 리간드를 조사하는 경우 칼슘 이온 농도 변동이 종종 지표로 사용됩니다.화학발광(CL)은 형광과 달리 여기광이 필요하지 않기 때문에 스페로이드 및 기타 구조의 자가형광은 문제가 되지 않습니다.CL 프로브의 이러한 특성 때문에 CL 이미징은 높은 신호 대 잡음비(SNR)와 높은 정량화를 유지하면서 스페로이드의 칼슘 이온 농도 변동을 측정하는 데 사용할 수 있습니다.따라서 녹색 강화 나노랜턴(eNL) 칼슘 발광 센서인 GeNL(Ca2+)_520(41)을 배양 세포를 사용하여 만든 스페로이드에 도입했습니다.스페로이드에 대한 GPCR H1 수용체 리간드인 히스타민으로 자극한 후 세포 내부 칼슘 이온 농도 변동에 대한 장기간의 지속적인 관찰이 시도되었습니다(21).그 결과 50분 동안 높은 SNR로 GeNL(Ca2+)_520 발광 신호를 관찰하는 데 성공했습니다(그림 2).
관찰 조건
HEK293T 세포: 화학발광 칼슘 이온 센서((GeNL(Ca2+)_520))가 일시적으로 도입된 96웰 멀티웰 U자형 베이스 플레이트 아데노 연관 바이러스에서 1주 동안 배양
관찰 용기: 멀티웰 플레이트, 96웰, U자형 베이스
관찰 배지: DMEM/F-12(Gibco) +10% FBS
발광 기질: 10μM Furimazine(Promega)
세포 자극: 2μM 히스타민
현미경: IXplore™ Live 시스템 기반 발광 이미징 시스템*
대물렌즈: UPLSAPO20X(개구수 0.75), 카메라 어댑터: 0.5배
EM-CCD: Andor iXon Ultra 888(EM-Gain 1,000배), 노출 시간: 20초/사진, 고정: 1 × 1
|
|
그림 1.화학발광 칼슘 이온 센서 GeNL(Ca2+)_520 액추에이터 작동(왼쪽) 및 IXplore Live 시스템 기반 발광 이미징 시스템의 예(오른쪽) |
명시야 이미지 | 발광 이미지 |
오버레이 이미지
|
동영상 1.히스타민 자극에 의한 칼슘 이온 변동의 발광 관찰(스케일 바: 500μm) |
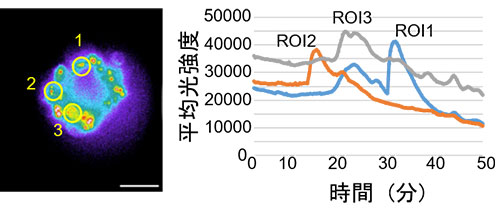
그림 2.히스타민 자극에 의한 칼슘 이온 농도 변동 측정
2.멀티웰 플레이트의 화학발광 다지점 관찰
화합물 라이브러리에서 신약 후보 분자를 선별할 때 세포 내 이온 농도와 세포 형태 변화와 같이 다중 세포 표현형을 테스트하기 위해 멀티웰 플레이트에 주입한 세포의 고함량 분석을 수행해야 합니다.이러한 경우 고휘도 화학발광 단백질을 사용하면 세포 형태와 움직임의 변화를 고대비로 정량적으로 포착할 수 있기 때문에 효과적입니다.
약물 선별 및 효능 평가를 위한 화학발광 이미징을 사용하여 멀티웰 플레이트에 화학발광 단백질을 발현하는 배양 세포를 주입했습니다.전동 스테이지를 사용하여 각 웰에 대해 반복적인 자동 다지점 스캐닝을 수행하고 모든 웰에 대해 획득한 이미징 데이터에 대한 분석을 수행했습니다.이를 통해 단 몇 분 만에 전체 멀티웰 플레이트의 이미지를 획득할 수 있었습니다.그 결과, 마이크로플레이트 웰의 저배율 이미지와 개별 세포의 형태에 대한 고배율 이미지를 고대비로 성공적으로 관찰할 수 있었습니다.1mm에서 100μm 범위의 관측 시야를 가진 세포의 이미지가 그림 3에 나와 있습니다.다지점 스캐닝이 가능한 현미경을 통합한 화학발광 이미징 시스템을 사용하여 높은 처리량과 대용량의 세포 분석을 달성할 수 있음이 실험을 통해 입증되었습니다.
관찰 조건
HeLa 세포: 고휘도 화학발광 단백질의 안정적인 발현, 황색 강화 나노랜턴 센서
관찰 용기: 멀티웰 플레이트, 96웰, 플랫 베이스
관찰 배지: HBSS(-)(Sigma)
발광 기질: 10μM Furimazine(Promega)
현미경: IXplore Live 시스템 기반 발광 이미징 시스템* 대물렌즈: UPLFLN10X2PH(개구수 0.3), 카메라 어댑터: 0.5배br/> EM-CCD: Andor iXon Ultra 888(EM-Gain 1,000배), 노출 시간: 1초/사진, 고정: 2 ×
2
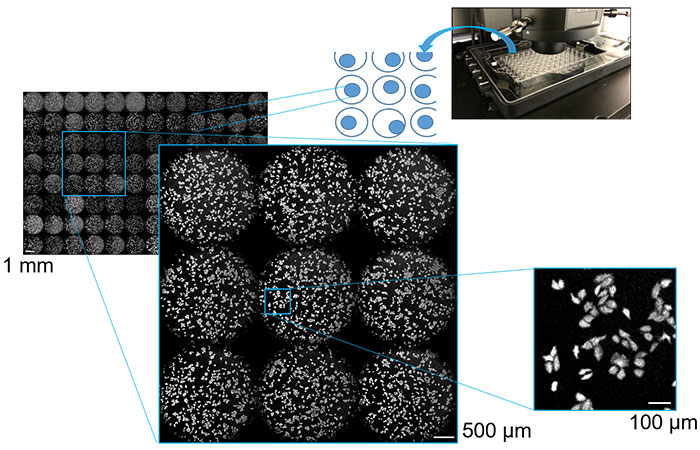
그림 3.다지점 스캐닝 발광 이미징을 사용하여 포착한 1mm, 500μm 및 100μm 멀티웰 플레이트의 배양 세포
3.배지 관류와 자동 기질 첨가를 통한 장기 관찰
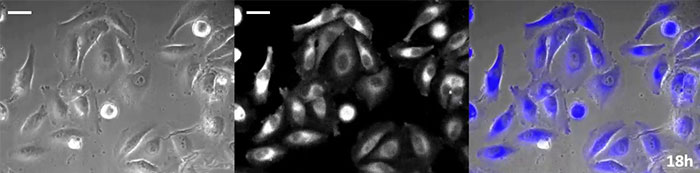
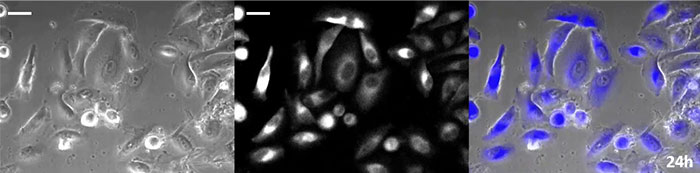
약효 평가 목적을 위해서는 약효에 대한 상세한 분석을 위해 장기간에 걸친 세포 관찰이 필수적입니다.루시페라아제는 특유의 짧은 성숙 시간과 반감기 때문에 시간 경과에 따른 유전자 발현의 역학을 모니터링하는 유효 리포터 유전자로 오랫동안 인식되어 왔습니다.또한 형광성이 있어 여기광이 필요하지 않기 때문에 발광 프로브를 장기 이미징 용도로 사용할 경우 세포 광독성이 감소합니다.그러나 이 기술은 발광 기질(루시페린)이 필요하기 때문에 세포에 루시페린을 안정적으로 공급하는 것이 중요합니다.
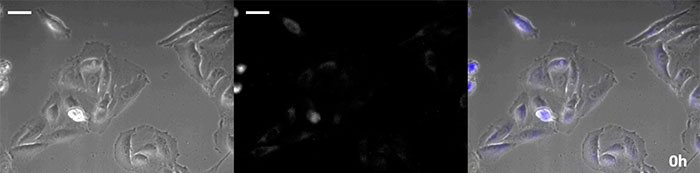
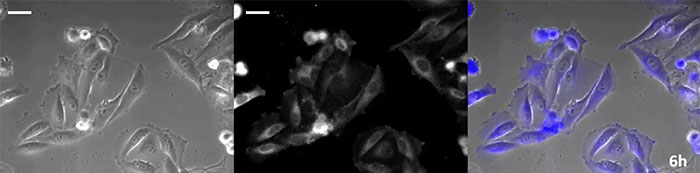
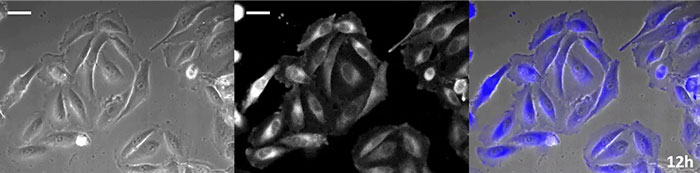
코엘렌테라진형 루시페린은 특히 휘도가 높지만, 짧은 시간 내에 세포 내에서 산화되기 때문에 장기간의 관찰 용도로 사용하려면 적시에 첨가하는 것이 매우 중요합니다.이 문제를 해결하기 위해 고강도 발광 단백질로 세포를 관류하고 자동 기질 첨가 장치가 자동으로 코엘렌테라진을 추가하여 발광을 지속적으로 모니터링할 수 있도록 했습니다.그 결과 위상차 이미징과 함께 발광 이미지를 24시간 이상 모니터링하는 데 성공했습니다(그림 4).
위상차 이미지 | 발광 이미지 |
오버레이 이미지
|
0시간 |
|
6시간 |
|
12시간 |
|
18시간 |
|
24시간 |
|
관찰 조건
HeLa 세포†: 고휘도 화학발광 단백질의 안정적인 발현, 황색 강화 나노랜턴
관찰 용기: 35mm 유리 바닥 접시
관찰 배지: DMEM/F12(Gibco) +10% FBS
발광 기질: 2.5mM Coelenterazine-h(FUJIFILM Wako Pure Chemical Corp.), 1.2μL/7.5분
관류 유속: 40µL/분, 배지 배수: 약10mL/시간
현미경: IXplore Live 시스템 기반 발광 이미징 시스템*
대물렌즈: UPLFLN40XPH(개구수 0.75), 카메라 어댑터: 0.5배
EM-CCD: Andor iXon Ultra 888(EM-Gain 1,000배), 노출 시간: 5분/사진, 촬영 간격: 7.5분, 고정: 1 × 1
4.초파리 배발생 관찰
모델 유기체를 이용한 약효 평가는 임상 시험의 다음 단계로 진행하는 데 필수적입니다.최근 몇 년 동안 초파리는 인간의 질병을 연구하는 데 탁월한 재료로 주목받고 있습니다.예를 들어, 갑상샘 수질암 초파리 모델의 개발과 사용을 통해 발견된 반데타닙(Vandetanib)은 FDA에서 인간 치료제로 승인되었습니다.
형광 단백질은 종종 살아있는 모델 유기체에서 유전자 발현을 모니터링하기 위한 리포터로 사용되지만 배아의 광 전달과 여기광에 대한 응답인 자기 형광을 비롯해 다양한 문제를 고려해야 합니다.반면에 발광 이미징은 여기광이 필요하지 않으므로 이러한 문제의 대부분이 해소됩니다.이 실험을 위해 효모 페이스트와 혼합된 D-루시페린을 3령기 초파리 유충에게 먹이고, 이 화합물을 리포터로 사용하여 초파리 배발생 과정을 통한 인그레일드 유전자 발현의 변화를 시간 경과에 따라 모니터링하였습니다.그 결과 번데기 껍질을 통해 번데기 내부 깊숙이 발광을 감지할 수 있었으며, 형질전환 과정에서 발현 부위와 발현 정도의 변화를 실시간으로 관찰하는 데 성공했습니다(동영상 2).
발광 이미지 | 발광 이미지(파란색) |
 |
동영상 2.초파리 배아 발광 이미징(스케일 바: 500µm)
관찰 조건
초파리: 인그레일드 유전자 발현 발광 리포터(루시페라아제: Pmat)
3령기 초파리 유충에게 효모 페이스트를 혼합한 D-루시페린을 투여한 후 번데기를 24웰 플레이트에 올려 관찰
현미경: IXplore Live 시스템 기반 발광 이미징 시스템* 대물렌즈: UPLFLN4XPH(개구수 0.13), 카메라 어댑터: 0.5배
EM-CCD: Andor iXon Ultra 888(EM-Gain 300배), 노출 시간: 120초/사진, 고정: 1 × 1
감사의 말
이 애플리케이션 노트는 다음 연구원의 도움으로 작성되었습니다.
Kenji Nagai 교수와 Mitsuru Hattori 조교수
오사카대학 과학산업연구소 나가이 연구실
초파리 배아 샘플은 다음 연구원의 도움으로 준비되었습니다.
Toshie Kai 교수와 Ritsuko Sugiyama 조교수
오사카대학 프런티어 생명과학 대학원 생식 생물학 연구실
*이 실험에 사용된 발광 이미징 시스템은 고급 측정 및 분석 기술/장비 개발 프로그램의 일환으로 오사카대학 과학기술연구소의 Kenji Nagai 교수 등과 Tokai Hit Co.Ltd.및 Olympus Corporation이 Olympus IXplore Live 현미경을 포함하여 기존 제품 구성 요소를 결합하여 공동 개발한 결과물입니다.이 특정 시스템은 특정 지역에서만 구매하실 수 있지만 Evident Life Sciences는 전 세계 고객에게 유사한 발광 솔루션을 제공합니다.자세한 내용은 현지 Evident 영업 담당자에게 문의하십시오.
인용된 논문:
Biochem.Biophys.Rep.,23 (2020) 100771
†참고: HeLa 세포는 의학 연구와 과학 개발 분야에서 가장 중요하고 잘 알려진 세포주 중 하나입니다.HeLa 세포는 면역학, 전염병 및 암 연구의 주요 발견에 기여했으며 의료 분야의 윤리에 대해 심각한 문제를 제기했습니다.Henrietta Lacks의 생애와 현대 의학에 대한 그녀의 공헌에 대한 자세한 내용은 http://henriettacksfoundation.org/를 참조하십시오.
이 애플리케이션에 사용되는 제품
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.