이미징 기반 워크플로를 사용한 3D 종양 스페로이드의 약물 효능 평가
인간, 실험 동물 등과 같은 유기체를 이용한 약물 평가에서 측정값은 연령, 성장 환경 등 다양한 요소의 영향을 받기 때문에 여러 샘플의 데이터를 통계적으로 분석하기가 어렵습니다.
오가노이드 및 스페로이드와 같은 3D 세포 배양 모델은 장기 또는 조직의 생체 내 구조와 기능을 밀접하게 모사할 수 있으며 시험관 내에서 대량 배양할 수 있습니다. 결과적으로 통계 데이터 분석에 대한 재현성이 높습니다. 3D 세포 배양 모델은 종양에서 발견되는 세포 이질성을 복제할 수 있으므로 3D 세포 기반 분석의 이미징은 약물 평가에 도움이 됩니다.
3D 세포 기반 분석을 사용하여 약물 효능을 평가하는 워크플로는 다음 3가지 프로세스로 나눌 수 있습니다(그림 1).
- 3D 세포 배양 모델 준비, 배양 및 처리
- 세포의 이미지 획득
- 통계 분석 수행
본 애플리케이션 노트에서는 각 프로세스에 대한 이미징 기반 워크플로를 소개합니다. 워크플로를 단계별로 시연하기 위해 분석법을 사용하여 세포 수준에서 3D 종양 스페로이드에 미치는 화합물 유도 손상을 정량적으로 평가했습니다.
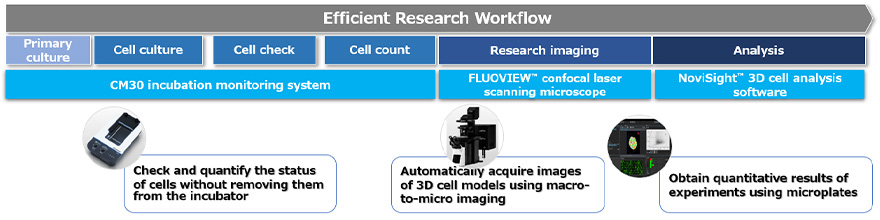
그림 1. Evident 기술을 사용하는 3D 세포 배양 모델을 위한 이미징 기반 워크플로
1. 3D 종양 스페로이드 준비(사전 배양)
종양 스페로이드는 생체 내 종양에서 발견되는 세포 미세 환경을 밀접하게 모사할 수 있으므로 항암제에 대한 스크리닝 분석에 사용되는 경우가 많습니다. 이러한 종양 스페로이드는 일반적으로 반구형 저접착성 세포 배양 용기에서 암세포를 배양함으로써 형성됩니다.
약물 효능을 평가하기 위해 600µm 이상의 종양 스페로이드를 준비했습니다. 이 과정에서 CM30 인큐베이션 모니터링 시스템을 사용했습니다. 이 장치를 사용하면 세포를 장기간 모니터링할 수 있으며 인큐베이터에서 세포 배양액을 제거하지 않고도 세포 배양 상태를 추적할 수 있습니다.
종양 스페로이드를 준비하기 위해 유방암 유래 MCF-7 세포를 U자형 96웰 저접착성 용기에 웰당 2,000개 세포의 밀도로 분주했습니다. 분주 직후
마이크로플레이트를 CM30 시스템에 설치하고 시스템을 CO2 인큐베이터에 배치했습니다. CM30 시스템을 사용하여 분산된 MCF-7 세포에서 스페로이드가 형성된
방법과 시간 경과에 따라 크기가 어떻게 증가하는지 모니터링할 수 있었습니다(그림 2).
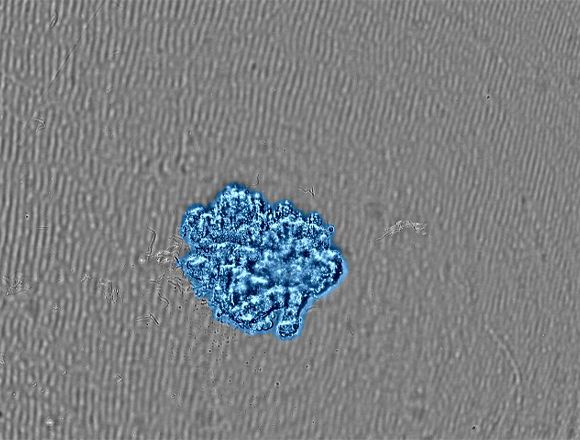
관련 영상그림 2. (a) 스페로이드 형성에 관한 타임랩스 이미지 |
(b) 목표 크기로 성장한 스페로이드의 이미지. 포화도 마스킹은 감지된 세포를 파란색으로 표시합니다. |
CM30 시스템은 포화도 측정 기능을 적용하여 스페로이드 영역을 자동으로 인식합니다. 밀접도 측정 기능을 사용하는 경우 포화도가 전체 이미지의 면적
대비 세포가 차지하는 면적의 비율로 계산됩니다. 그림 3은 7일 동안 MCF-7 스페로이드 면적의 변화를 보여줍니다.
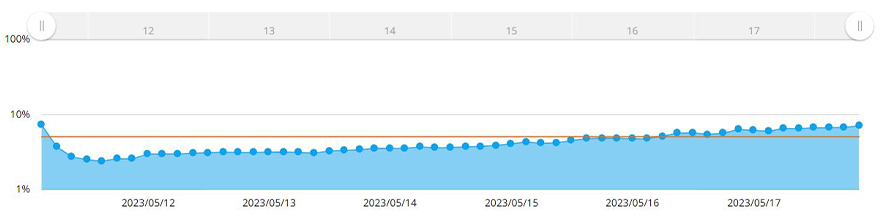
그림 3. 7일 동안 스페로이드 크기의 변화를 보여주는 그래프. 노란색 선은 시스템에 설정된 포화도 목표입니다.
포화도가 획득한 이미지 면적의 5%에 도달했을 때 소프트웨어가 스페로이드 면적을 측정했습니다. 여기서, 포화도가 5%에 도달하면 스페로이드의 직경이 600µm를 초과하는 것으로 판단했습니다. CM30 시스템을 사용하여 소프트웨어에서 목표 포화도를 5%로 설정했습니다. 세포가 해당 포화도에 도달하거나 초과하면 알림이 생성되었습니다.
알림이 올바르게 작동하는지 확인하기 위해 알림 후 1일차에 12개의 웰에서 스페로이드 크기를 측정하고 모든 웰에서 직경 600µm 이상의 종양 스페로이드가 형성된 것을 확인했습니다(그림 4).
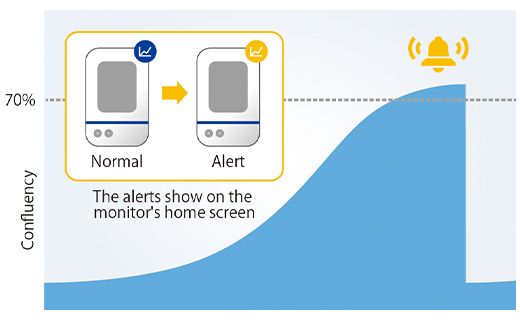 | 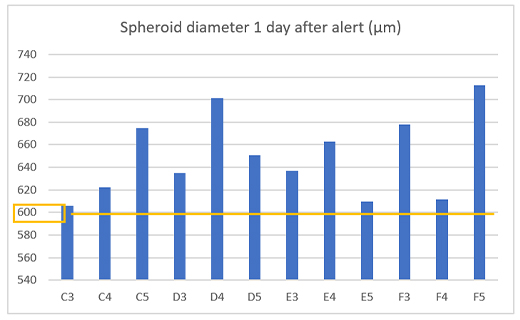 |
그림 4. 알림이 생성된 다음날 준비된 스페로이드 크기.
(a) CM30 시스템 알림의 예 (b) 준비된 스페로이드의 직경(n= 12).
CM30 시스템을 사용하여 스페로이드를 준비하면 연구원의 개입 없이 용기를 인큐베이터 안팎으로 이동하지 않고도 성장 상태를 모니터링할 수 있었습니다. 또한 분석 소프트웨어는 스페로이드 크기를 정량화하고 목표 스페로이드 크기에 도달하면 알림을 제공할 수 있었습니다. 워크플로에 CM30 시스템을 구현하면 이전에 연구원이 세포 배양을 모니터링하는 데 할애했던 시간에 다른 작업을 자유롭게 완료할 수 있습니다.
특정 크기를 초과하는 종양 스페로이드는 세 가지 항암제(Cisplastin, Paclitaxel, 5-FU) 중 하나를 다양한 용량 또는 대조군을 사용해 처리했습니다. 24시간 배양 후 Hoechst 33342, Propidium
Iodide(PI) 및 Calcein-AM을 모든 웰에 첨가했습니다. Hoechst 33342, PI 및 Calcein-AM은 각각 모든 세포의 핵, 죽은 세포의 핵, 스페로이드의 생존 세포를 염색할 수 있습니다. 염색 후 레이저
스캐닝 현미경을 사용하여 종양 스페로이드의 이미지 데이터를 획득했습니다.
2. 3D 종양 스페로이드의 세포 이미지 획득
단일 세포 수준에서 두꺼운 종양 스페로이드의 고해상도 이미지를 획득하기 위해 FLUOVIEW™ FV3000 레이저 스캐닝 컨포컬 현미경을 사용했습니다. FV3000 현미경의 매크로-마이크로 이미징 모듈을 사용하면 샘플을 검색하지 않고도 이미지를 얻을 수 있습니다.
그림 5는 매크로-마이크로 이미징 모듈을 사용한 자동 이미지 획득 프로세스를 도식화한 그림입니다. 종양 스페로이드는 U자형 웰 내에서 일관되지 않은 위치에 부유해 있습니다. 이 문제를 해결하기 위해 매크로-마이크로 이미징 모듈은 먼저 전체 웰을 낮은 배율(매크로 이미지)로 이미징하여 스페로이드의 관심 영역의 위치를 기록합니다. 그 후 모듈은 고배율(마이크로 이미지)에서 스페로이드 영역만 자동으로 획득할 수 있습니다. 이 과정에서 획득한 이미지의 파일 크기가 줄어듭니다. 또한 시스템 메모리의 부하를 줄이는 데도 도움이 됩니다.
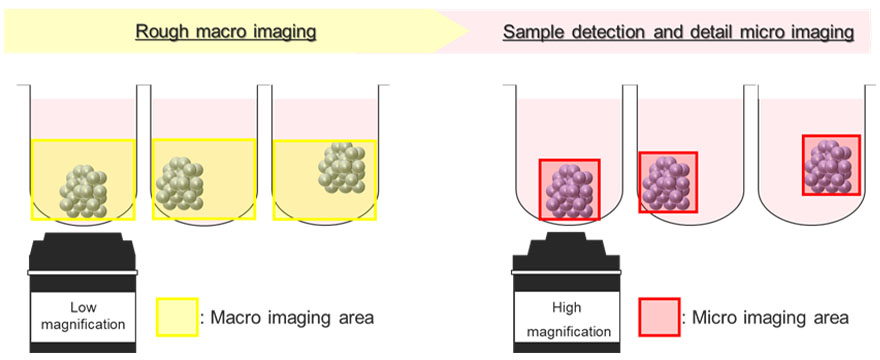
그림 5. FV3000 컨포컬 레이저 스캐닝 현미경의 매크로-마이크로 이미징 모듈의 개략도
현미경으로 60개 웰에서 종양 스페로이드의 연속적인 Z 섹션 이미지를 획득했습니다.
그림 6에 나온 것처럼 종양 스페로이드의 각 세포에 대한 고해상도 이미지를 획득했습니다. 대조군 및 다른 두 가지 항암제와 비교하여 Cisplatin으로 처리한
그룹에서 다수의 PI 양성 세포가 관찰되었는데, 이는 이 항암제가 암세포를 죽였음을 시사합니다.

그림 6. 매크로-마이크로 이미징 모듈에서 자동으로 캡처된 세포의 생존 및 죽음을 확인하는 이미지
3. 3D 암세포 스페로이드의 통계 분석
스페로이드에 있는 각 세포의 생존 가능성을 확인하기 위해 NoviSight™ 3D 세포 분석 소프트웨어를 사용하여 여러 웰에서 획득한 연속 Z 섹션 이미지를 분석했습니다. Hoechst 33342 유래 형광 신호는 모든 세포 핵을 인식하기 위해 사용되었습니다. 산점도 기반 게이팅 프로세스를 사용하여 Calcein-AM에서 유래된 형광 신호의 강도가 낮고 PI 유래 신호의 강도가 높은 세포를 죽은 세포로 정의했습니다. 이와 반대로, Calcein-AM이 높고 PI가 낮은 세포는 생존 세포로 정의되었습니다(그림 7). 그런 다음 갤러리 기능을 사용하여 분류의 유효성을 확인할 수 있습니다. 이는 NoviSight 소프트웨어를 사용하여 형광 신호의 강도에 따라 자동으로 인식된 많은 수의 세포를 분류할 수 있음을 입증했습니다.
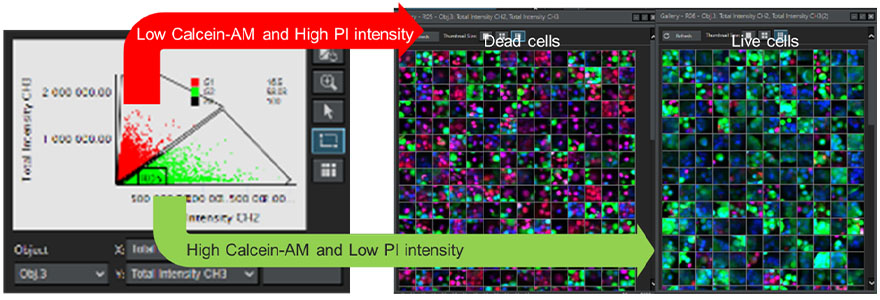
그림 7. NoviSight 소프트웨어를 사용하여 모든 세포의 생존 가능성 결정. 왼쪽: 각 세포에 대한 Calcein-AM 채널과 PI 채널의 형광 신호 강도를 나타내는 그래프. 오른쪽:
죽은 세포와 살아있는 세포의 갤러리 이미지.
그림 8에 나온 것처럼 항암제로 처리된 스페로이드의 생존 세포 비율을 계산했습니다. Paclitaxel과 5-FU를 서로 다른 농도도 추가했을 때 생존 세포의 비율에 큰 변화가 없었습니다. 그러나 첨가된 Cisplatin의 농도가 증가하면 생존 세포의 비율이 감소하는 것을 확인했습니다. NoviSight 소프트웨어는 3D 세포 배양 모델에서 세포 기반 분석의 이미징 기반 분석 작업을 용이하게 하여 여러 약물 후보군의 효능을 동시에 평가합니다.
종양 스페로이드에 대한 항암제의 효과 평가를 위한 고려사항
본 연구에서는 세포 수준에서 항암제가 종양 스페로이드에 미치는 영향을 이해하는 과정의 각 단계에서 이미징 기반 솔루션이 어떻게 도움이 될 수 있는지 확인했습니다.
종양 스페로이드는 까다로운 세포 배양 과정을 통해 준비됩니다. 항암제의 효과를 정량적으로 확인하려면 스페로이드의 조건(예: 본 연구에서 스페로이드 크기)이 동일해야 합니다. CM30 시스템의 원격 모니터링 기능 덕분에 배양액을 인큐베이터에서 꺼내지 않고도 스페로이드가 미리 정해진 크기에 도달할 때까지 세포가 어떻게 증식하는지 확인할 수 있었습니다. 또한 CM30 시스템의 알림 기능은 항암제 치료 시기를 정확하게 맞추는 데 도움이 되었습니다.
레이저 스캐닝 컨포컬 현미경은 세포 수준에서 항암제에 대한 종양 스페로이드의 반응을 관찰하는 데 적합한 옵션입니다. U자형 웰에서 배양된 종양 스페로이드는 웰 중앙 근처에 존재하는 것으로 추정되지만, 실제로는 중앙에서 약간 벗어난 위치에 있는 경우가 많습니다. 종양 스페로이드가 있는 영역을 캡처하기 위해 웰 전체를 이미징하려면 많은 양의 저장 데이터가 필요하고 시간도 많이 걸립니다. FV3000 현미경의 매크로-마이크로 이미징 모듈을 이 프로세스를 단순화합니다. 모듈은 전체 웰의 저배율 이미지(매크로 이미지)를 촬영하고 고배율 이미징(마이크로 이미지)을 위한 최적의 이미징 위치를 자동으로 결정합니다. 모듈은 샘플(종양 스페로이드)을 고배율로 이미징함으로써 이미지 파일 크기와 이미징에 소요되는 시간을 줄입니다.
FV3000 현미경으로 획득한 이미지는 NoviSight 3D 세포 분석 소프트웨어를 사용하여 원활하게 분석할 수 있습니다. 세포 수준에서 생존 신호를 통계적으로 처리한 결과, 첨가하는 Cisplastin 용량이 많아질수록 죽은 세포 수가 증가하는 것으로 나타났습니다. NoviSight 소프트웨어는 신호 강도 및 세포 위치 정보와 같은 분석 매개변수와 함께 사용하여 보다 고급 분석을 수행할 수 있습니다. 약물 평가는 생체 내에서 발견되는 세포 환경을 밀접하게 모사하는 환경에서 3D 스페로이드 내의 각 이질적 세포의 거동을 분석하여 수행할 수 있습니다.
이 워크플로는 3D 세포 배양 모델 분석 시 사용자에게 어렵거나 복잡할 수 있는 프로세스를 자동화하고 단순화하며 시간과 노력을 절약할 수 있는 Evident의 기술을 사용합니다. 솔루션을 결합하면 연구 워크플로를 처음부터 끝까지 간소화할 수 있습니다.
참고 문헌
1) Elena M. Tosca et al., Replacement, Reduction, and Refinement of Animal Experiments in Anticancer Drug Development: The Contribution of 3D In Vitro Cancer Models in the Drug Efficacy Assessment. Biomedicines 2023, 11, 1058.
이 애플리케이션에 사용되는 제품
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.