CM20 배양 모니터링 시스템을 사용한 세포 품질 평가: 세포의 특성화를 통한 실험의 재현성 향상
서론
배양된 세포를 사용한 연구에서 실험 재현성을 확보하는 것이 종종 당면 과제입니다. 이러한 문제를 해결하기 위해 “더 강력한 실험 설계”와 “더 나은 통계”가 대응책으로 제안됩니다.*1 하지만 이러한 대책을 효율적으로 사용하는 데 필요한 정량적 데이터 획득이 연구원의 부담으로 작용합니다. 이 애플리케이션 노트에서는 CM20 시스템을 통한 배양에서 정량적 데이터를 획득하여 실험 재현성을 향상시키고 연구원에게 부과된 데이터 수집의 책임을 완화하기 위한 방법을 소개합니다.
기존 이슈: 배양 준비 단계에서 정량적 데이터 수집의 어려움
일반적으로 품질 판단과 실험의 예비 단계에 해당하는 배양 세포의 운용 타이밍은 운용자의 주관적인 판단에 맡겨짐에 따라 작업자 간 결과에 상당한 차이가 발생합니다. 또한 세포의 정량적 데이터 수집 시 샘플의 일부를 선택할 필요가 있으며 대량 데이터를 비파괴적으로 측정하기 위한 실용적 도구가 부족합니다.
솔루션: CM20 배양 모니터링 시스템을 통한 정량적 데이터 획득
CM20 배양 모니터링 시스템은 세포 샘플을 혈관에서 제거하지 않고 안정된 간격으로 자동으로 관찰할 수 있기 때문에 연구원의 개입 없이 또는 세포 배양 환경의 불안정화 위험 없이 정량적 데이터를 획득할 수 있습니다. 또한 획득된 이미지에서 세포의 수를 자동으로 측정하고 세포 증식 능력의 지수에 해당하는 배가 시간을 계산할 수 있습니다.
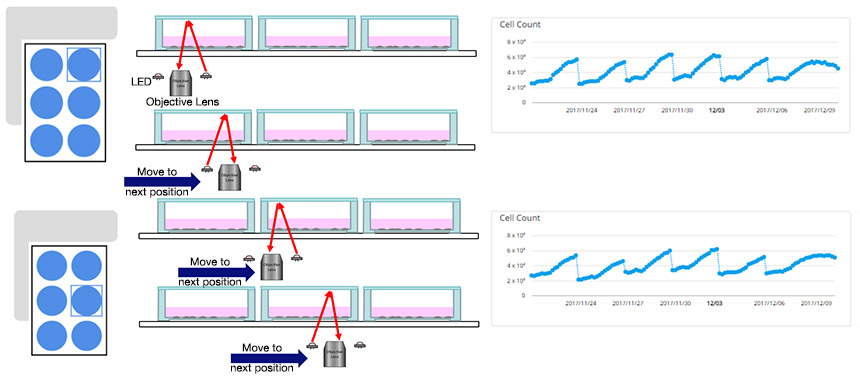
그림 1 CM20은 6웰 플레이트에 파종된 세포의 passage 중에 정량적 데이터를 자동으로 측정할 수 있습니다.
재현성 개선을 확인하기 위한 실험: HUVEC 및 분화 유도를 사용한 Passage 중 세포 특성 간 관계
다음은 세포 배양의 정량적 데이터를 품질 평가로 사용하는 데 성공한 예입니다.

그림 2 CM20을 통한 MSC 이미지 획득과 세포 계수
재현성 개선을 확인하기 위한 실험: HUVEC 및 분화 유도를 사용한 Passage 중 세포 특성 간 관계
다음은 세포 배양의 정량적 데이터를 품질 평가로 사용하는 데 성공한 예입니다. 인간 제대 정맥 내피 세포(HUVEC)의 계대배양 중 획득된 다수의 이미지에서 세포 형태와 배가 시간을 분석하였습니다. 그 결과, 계대배양 중 HUVEC의 배가 시간과 혈관 형성 잠재성 간의 상관관계가 높은 것이 밝혀졌습니다. 이 경우에 증식 능력의 변화가 발생하는 Passage 8(P8)까지 사용하여 재현성이 높은 실험을 계획할 수 있는 것이 입증되었습니다.
(이러한 결과는 CM20 시스템의 시제품을 사용하여 획득되었습니다. 실험의 세부사항은 Scientific Reports의 기사를 참조하십시오.*2)
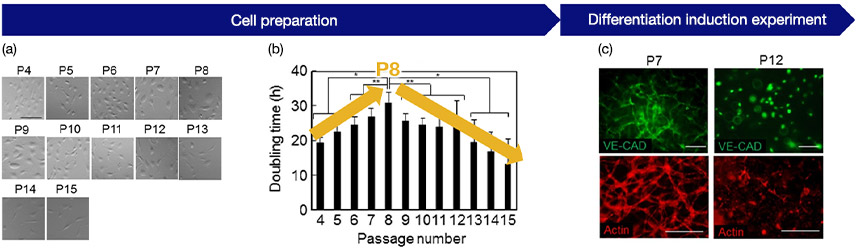
그림 3 (a) passage 번호에 의한 세포 형태: 각 passage에서 이미지 데이터 기록, (b) passage 번호와 성장률 간 관계: P8에서 증식률의 변화를 보여줌, (c) HUVEC의 혈관 형성 잠재성 및 passage 번호: P7에서 혈관 형성 성공 및 P12에서 혈관 형성 실패를 보여줌
추천의 글
| 생명과학 분야에서는 과거에 실시된 실험을 재현할 수 없는 것이 문제로 간주됩니다. 기존 방법의 경우 실험실 내 전문가가 계대배양 중 약간의 변화를 육안으로 인지해야 했습니다. 하지만 새로 개발된 모니터링 시스템을 통해 대량의 이미지를 획득하였고 이 데이터를 분석하여 세포의 품질을 확정하였습니다. 앞으로 배양 중 데이터 획득과 품질 평가를 통해 실험 재현성의 향상이 있기를 바랍니다. |
|
Prof. Junji Fukuda
재료과학공학과, 공학 화학공학 및 생명과학 학부, 요코하마 국립대학 | |
참고문헌
*1) Monya Baker, "1,500 scientists lift the lid on reproducibility", nature 533, 452–454 (26 May 2016)
*2) Tatsuya Osaki, Tatsuto Kageyama, Yuka Shimazu, Dina Mysnikova, Shintaro Takahashi, Shinichi Takimoto & Junji Fukuda, "Flatbed epi relief-contrast cellular monitoring system for stable cell culture", nature Scientific Reports ISSN 2045-2322 (online) (15 May, 2017)
이 애플리케이션에 사용되는 제품
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.
