深部観察性能を大幅に向上したTruResolutionシステム
深部観察に対応した自動球面収差補正システム「TruResolution」
オリンパスの多光子励起レーザー走査型顕微鏡FVMPE-RSは、厚みのある標本の深部観察において対物レンズの補正環を自動調整することで球面収差を自動補正するTruResolutionシステムを新たに搭載しました。従来の多光子励起顕微鏡では、対物レンズからサンプル内観察位置までの間で発生する球面収差によって蛍光強度や解像度が低下するという課題がありました。TruResolutionシステムでは、これまで使いづらかった対物レンズの補正環をソフトウェアで簡便にコントロールできるようにし、独自のアルゴリズムによって高速かつ正確に最適位置を設定できるようにしました。加えて、Zスタック画像取得時には深さに応じて補正環を自動調整し、全ての深さに対して対物レンズの解像性能を最大限発揮することで、明るく高精細な画像取得を可能にしました。
球面収差と補正環の役割
対物レンズは、細胞やオルガネラなど微細な構造を観察するために、何枚ものレンズと緻密な設計・製造工程によって収差(結像性能のエラー)を抑えた高い光学性能を実現しています。よって、理想的な条件下においては非常にクリアな標本のイメージを取得することが可能ですが、標本や標本と対物レンズの間に存在する媒質(カバーガラスなど)の屈折率が浸液の屈折率と異なると、屈折率差によって光が屈折し、対物レンズの中心部から出る光線と周辺部から出る光線で集光深度に差が生じます。この現象を球面収差と呼び、これによって解像度や蛍光強度が低下してしまいます。この球面収差を取り除くには、対物レンズの補正環を調整することが有効です。いくつかのタイプの対物レンズには補正環が付いており、これを回すことにより対物レンズからの中心光線と周辺光線の集光深度差を調整し、球面収差を補正することができます。例えば図1(a)のように水浸の対物レンズで水中に集光する場合、補正環の位置を0に合わせることで理想的な結像性能を得ることができますが、図1(b)のように同じ補正環位置でカバーガラスを通して組織を観察しようとすると球面収差によって中心光線と周辺光線で深さ方向の集光位置に差が生じ、集光スポットが拡がって分解能や蛍光強度が低下します。このような場合、図1(c)のように、補正環を調整することによって球面収差を補正することができます。しかし、多光子励起顕微鏡で深部観察を行う場合には、図1(c)のようにサンプルの表面付近で補正環を調整した状態で観察位置を深部に移動すると、再び球面収差が発生してしまいます(図1(d))。このため、多光子励起顕微鏡で任意の観察深さで補正量を最適に調整することは非常に困難でした。
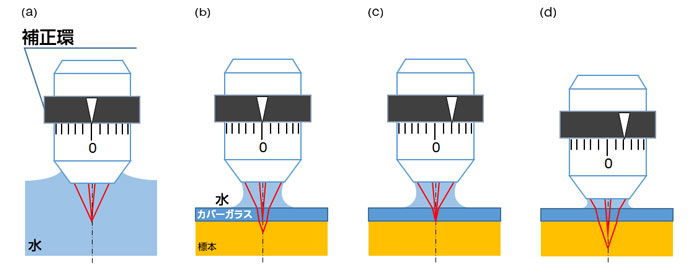
図1:標本やカバーガラスによる球面収差の発生と補正環調整の効果を示す概念図
(a) 理想条件における集光状態。水中にある観察対象に対して水浸の対物レンズを用いた場合、対物レンズの中心と周辺で集光深さが一致し、球面収差は発生しない。
(b) 球面収差が発生した場合の集光状態。浸液を水とし、カバーガラスを通して組織を観察した場合、カバーガラスの両界面において光が屈折し、球面収差が生じる。
(c) 補正環で球面収差を補正した場合の集光状態。
(d) (c)で補正環を調整後に集光位置を深部に移動した場合、再び球面収差が発生する。
TruResolutionシステムによる球面収差の自動補正
多光子励起顕微鏡では、蛍光検出に共焦点ピンホールやカメラを用いないため、解像度の限界は集光スポットサイズのみで決定されます。また、深部観察時にはサンプル内の散乱によって蛍光信号強度が低下しますが、集光スポットサイズを小さくすることで励起光密度を高くし、蛍光強度の低下を補うことができます。このため、多光子励起顕微鏡にとって、補正環調整による球面収差の補正は解像度と蛍光強度の両面から非常に重要であると言えます。
サンプルの屈折率やカバーガラスの厚さ、または観察深さによって補正環の最適位置が異なるため、実際には画像取得を行いながら補正環調整を行う必要があります。しかし、多光子励起顕微鏡では、暗室環境化で観察を行うことが多いために画像取得中に補正環を手で操作することは容易ではありません。また、対物レンズは補正環を回すことでフォーカス位置が変化してしまうため、補正環の最適位置を定めることは経験を必要とする作業でした。加えて、Zスタック画像取得時には各深さで補正環の調整量を変える必要があり、全深さ位置で補正環を最適化したZスタック画像を取得することは不可能でした。
今回新たに搭載したTruResolutionシステムは、これらの課題を解決し、多光子励起顕微鏡の深部観察時において簡易な操作で補正環を完全に調整します。まず、補正環を電動駆動にすることで、暗室中においてもソフトウェアで補正環を制御可能にしました。また、補正環回転角に応じて対物レンズのZ位置を自動追随させることで、補正環を回転させてもフォーカス位置が変わらない機構を実現しました(図2(a))。加えて、異なる補正環回転角で取得した複数枚の画像から独自のアルゴリズムでコントラストカーブを算出し、そのピーク位置から最適な補正環位置を高精度に決定できるようにしました(図2(b))。これらを統合することにより、ソフトウェア上で1クリックするだけでベストの補正環位置を自動設定できるようになりました。また、Zスタック画像取得時においては、各深さで補正環位置を登録することで、深さに応じて補正環が自動回転し、常に最適な状態で画像取得が行えるようになりました。このTruResolutionシステムによって、これまで不可能だった深部Zスタック観察での補正環調整が可能となり、どの深さでも明るく高解像な画像取得を行えるようになりました。
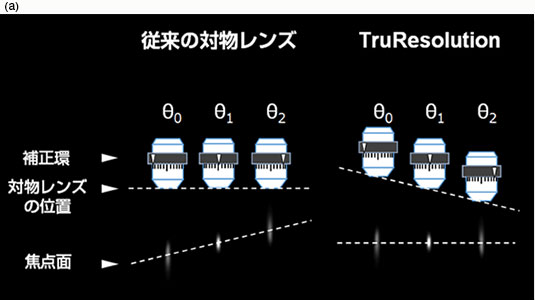
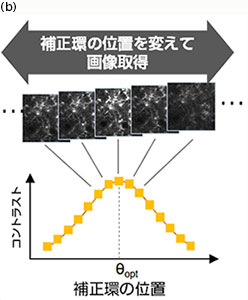
図2
(a) 従来の対物レンズとTruResolutionシステムにおける、補正環回転時のフォーカススポット位置変化の概念図。従来は補正環を回転させることでフォーカス位置が変化したが、TruResolutionシステムでは対物レンズのZ位置を連動させることでフォーカス位置を一定に保つことができる。
(b) 最最適な補正環位置θoptの設定方法。補正環を回転しながら複数枚の画像を取得し、各々の画像からコントラス値を算出してコントラストカーブを求める。このピークを解析することで最適な補正環位置を決定する。
サンプルの深部観察への適用
上述のように、TruResolutionシステムは深部観察時に補正環を自動調整し、明るく高解像な画像取得手段を提供します。図3は、マウスの脳を模擬して屈折率および散乱係数を調整したゲル中に埋め込んだ蛍光ビーズを、TruResolutionシステムを利用して観察した結果です。TruResolutionシステムを利用して補正環を自動調整した場合は深さが変わっても励起光スポットサイズがほぼ均一に保たれているのに対し、対物レンズの補正環をサンプル表面で最適化して固定した場合には集光スポットが深さに沿って拡がり、明るさも低下することがわかります。この結果はTruResolutionシステムによる画像品質の向上の効果を明らかに示しています。
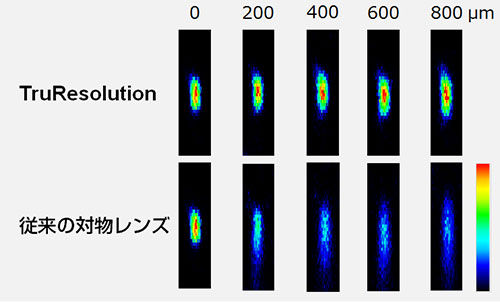
図3:マウス脳の光学特性を模擬したゲル(屈折率1.36,散乱係数43 cm-1)中の各深さでの蛍光ビーズ(φ200 nm)の観察結果
励起波長は960 nm。上段がTruResolutionシステムで補正環を自動調整した場合、下段が補正環を表面位置で最適化して固定した場合を各々示している。両観察で励起強度は等しく、画像輝度は各深さで規格化している。対物レンズはFV30-AC25Wを利用。。
次に、実際に生体サンプルを観察した結果を示します。図4はマウス脳の神経細胞樹状突起を深さ400 µmでin-vivo観察した結果です。補正環を表面位置で最適化して固定した場合と比べ、TruResolutionシステムを利用した場合の方が同じ励起強度でも明るい画像を得ることができます。これは図3のようにTruResolutionシステムでは集光スポットが最適状態に設定されているのに対し、補正環を表面位置で固定した場合ではスポットが拡がって励起密度が低下していることに起因します。
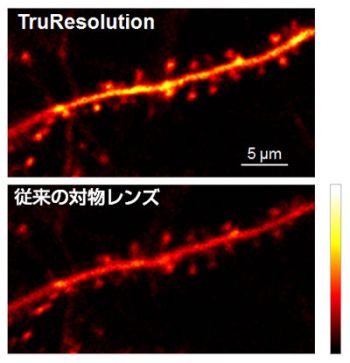
図4:マウス脳神経細胞樹状突起のin-vivo観察結果(Thy1-YFP-H mouse, sensory cortex)
観察深さは400 µm、励起波長は960 nm、対物レンズはFV30-AC25Wを利用。上段がTruResolutionシステムによる補正環自動調整した場合、下段が補正環を表面調整位置で固定した場合を各々示しており、励起強度は等しい。
また、TruResolutionシステムは透明化サンプルに対しても大きな効果を発揮します。透明化サンプルでは透明化手法によって屈折率が大きく異なります。これに対して、例えばオリンパスのXLPLN10XSVMPでは屈折率1.33から1.52まで広い範囲を補正環で対応できるように設計されています。しかし、その分補正環の調整は重要で、異なる設定で使用すると容易に光学性能が乱れてしまいます。このような透明化サンプルに対してもTruResolutionシステムを利用することで、補正環を最適な位置に自動調整して、明るく高解像な画像を取得することができます。図5(a)はScaleA2試薬によって透明化したマウス脳を約4mmの深さまでZスタック観察したXZ画像を示しています。比較としてTruResolutionシステムを利用した場合と、補正環を透明化試薬CUBICに最適化して固定した場合とを並べていますが、明らかにTruResolutionシステムを利用した方が明るい画像を取得できることがわかります。なお、浸液と透明化サンプルの屈折率が等しい場合は深さごとに補正環を調整する必要はなく、図5のTruResolutionシステムの結果ではサンプル内の一箇所のみで補正環を自動調整しています。また、図5(b)は深さ2.7mmの位置におけるXY画像を示していますが、図5(a)と同様にTruResolutionシステムの方が明るく画像取得できていることがわかります。
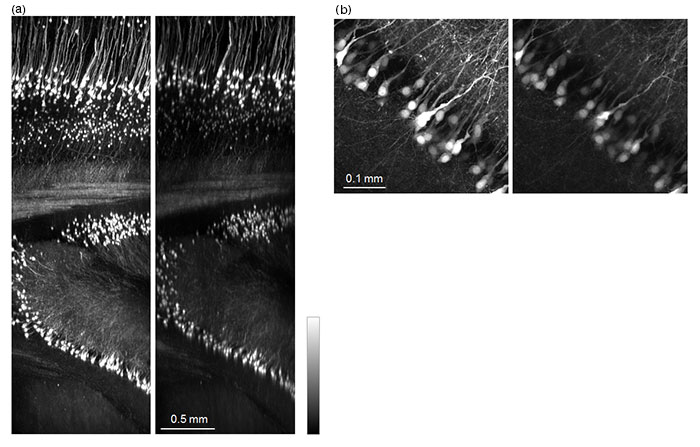
図5:透明化マウス脳(Thy1-YFP-H mouse, sensory cortex)の観察結果
透明化手法はScaleA2を利用。左側がTruResolutionシステムで補正環を自動調整した場合、右側がCUBIC透明試薬の屈折率に補正環を合わせた場合を各々示している。両条件で励起強度は等しい。励起波長は960 nm、対物レンズはFV30-AC10SVを利用。
(a) Zスタック画像取得後、Y方向に250 µm厚をmaximum intensity projectionした結果。
(b) 深さ2.7mmの位置でZ方向100 µm厚をmaximum intensity projectionした結果。
まとめ
従来適切に調整することが難しかった補正環を、オリンパス独自のアルゴリズムにより自動で最適な位置に調整するTruResolutionシステムを利用することで、多光子励起顕微鏡の深部観察において球面収差を自動的に補正し、常に対物レンズの解像性能を最大限発揮して明るく高精細な画像取得を行うことができます。
著者
オリンパス株式会社 技術開発部門光学システム開発本部
土井 厚志
サンプル作製、画像の取得にご協力賜りました先生:
理研BSI-オリンパス連携センター
毛内 拡先生、平瀬 肇先生、宮脇 敦史先生
上記研究内容の詳細は下記文献をご参照下さい。
論文:Biochemical and Biophysical Research Communications (BBRC)
発表年:2018年
タイトル:A spherical aberration-free microscopy system for live brain imaging(リンク)
著者:Yoshihiro Uea, b, Hiromu Monaia, c, Kaori Higuchia, b, Daisuke Nishiwakia, b, Tetsuya Tajimaa, b, Kenya Okazakia, b, Hiroshi Hamac, Hajime Hirasec, Atsushi Miyawakia, c, d,
a BSI-Olympus Collaboration Center, RIKEN, Hirosawa, Wako-City, 351-0198 Saitama, Japan
b OLYMPUS Corporation, Hachioji-City, 192-0033 Tokyo, Japan
c Brain Science Institute, Center for Brain Science, RIKEN, Hirosawa, Wako-City, 351-0198 Saitama, Japan
d Center for Advanced Photonics, RIKEN, Hirosawa, Wako-City, 351-0198 Saitama, Japan.
このページはお住まいの地域ではご覧いただくことはできません。