生体サンプルの信号と顕微鏡カメラのデジタルデータとの関係を理解する
このホワイトペーパーでは、生体サンプルの信号と顕微鏡カメラのデジタルデータとの関係について探ります。 関係を理解すると、最高品質の画像とデータを実現する理想的な画像取得条件の設定に役立ちます。
デジタルイメージングの基本
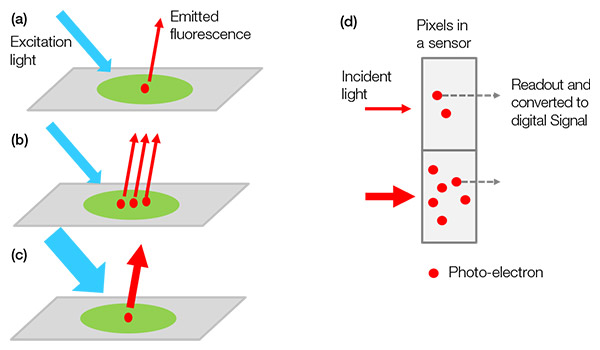
顕微鏡用のモノクロカメラは、生体サンプルからの光を検出して視覚化する装置です。 顕微鏡は蛍光染料またはタンパク質から発せられた蛍光を観察し、この光をカメラが検出して、デジタル信号として検出するための光電子に変換します。
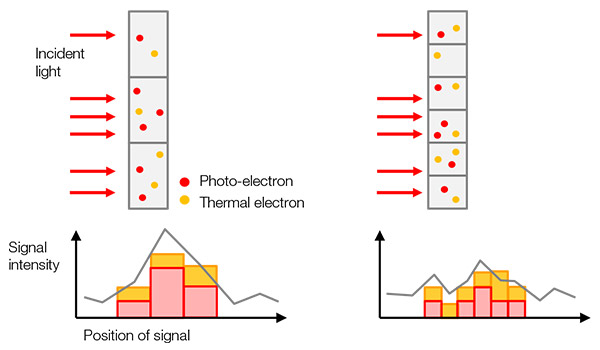
検出される信号値は、標識された対象物(対象タンパク質など)の数、励起光の強度、励起と蛍光発光/検出の効率(カメラによる光からデジタル信号への変換効率を含む)の複雑な乗数です(図1)。
1つの実験において、さまざまなサンプルに対して同じシステムと画像取得設定を使用する場合、対象物の数以外のすべての要素が定数値になるため、検出される信号値は対象物の数に比例します。 つまり、例えば遺伝子編集したサンプルと野生型のサンプルを定量的に比較できることになります。
図1 – サンプルからデジタル信号へ:(a)標識された対象物が励起して蛍光発光します。 |
信号とバックグラウンドノイズの構造
このセクションでは、画質に寄与する中心的な要素について説明し、実験中に注意深く画像取得することの重要性を取り上げます。
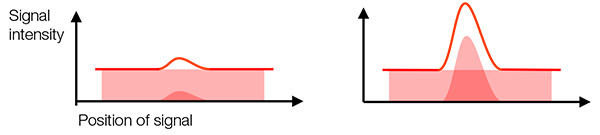
実際の信号とバックグラウンド信号:検出される信号には、実際の信号とバックグラウンド信号(バックグラウンドノイズ)があります。 実際の信号とバックグラウンド信号を区別して対象物を検出するには、実際の信号の強度とバックグラウンド信号に十分な高さの比率が必要です(図2)。 これはSN比(SNR)と呼ばれます。 高いSNRを目指すことで、よい画質と定量的解析が可能になります。
一般に、SNRを向上させる方法として、実際の信号の最大化(高NA対物レンズの使用など)と、バックグラウンド信号の最小化(暗室、低温冷却、高量子効率カメラの使用など)があります。
信号を高めるためにカメラの増幅係数を指定するゲイン設定は、実際の信号とバックグラウンド信号の両方に影響するため、SNRは向上しません。
図2 – 左:低いSNR:バックグラウンドノイズは実際の信号と区別するのが難しくなっています。 |
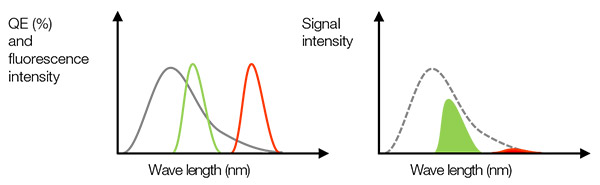
実際の信号:前述のように、高NA対物レンズを使用するとSNRの向上に役立ちます。 強い信号を得るもう一つの重要な要素は、高い量子効率(QE)です。 QEは入射光から光電子への変換効率を示します。 カメラのQEが特定の波長でゼロパーセントになる場合、光を感知できないことに留意してください。 例えば、生物組織観察に適した近赤外(NIR)領域(生体の窓)にCy7などのNIR染料を使用するか、多重化時のクロストークを阻止するには、感度が720 nmを超えるカメラを選択する必要があります。
図3 – 左:灰色の線はカメラのQE。 緑色と赤色の線は蛍光発光スペクトルを示します。右:検出される信号の値は、左の図のQEと蛍光スペクトルの乗数である領域の大きさに等しくなります。この例で、蛍光強度が十分でも、赤色の蛍光のQEが低いため、検出される信号が弱い可能性があります。 |
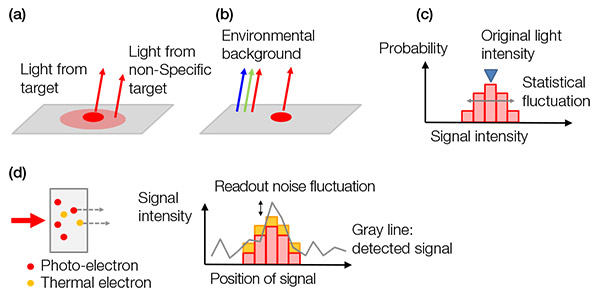
バックグラウンドノイズ:バックグラウンド信号は以下のように分類できます。
a)生体バックグラウンド信号
b)非生体バックグラウンド信号
c)光電子の統計変動(ショットノイズ)
d)カメラのノイズ
ショットノイズは独特で、コイントスになぞらえることができます。 2回のコイントスで「表」と「裏」が出る確率が50%であるように、数値Nを用いた試験の統計変動は±√(N)です。 検出される光電子の数は同じ規則に従います。
バックグラウンドノイズのすべての例を、下の図4に示します。
図4 – バックグラウンドノイズの例:(a)非特異的染色または自己蛍光からの生体バックグラウンドノイズ、(b)スライドに反射する部屋の環境光、(c)ショットノイズ、(d)センサーで生成された熱電子などのカメラのノイズ(左)と読み出しノイズ(右)。 熱電子はセンサーを冷却することで低減できます。 |
解像度:大きな画素サイズまたはビニング画像の取得では、多くの光を得て高いSNRが実現しますが、画素サイズが大きくなると解像度は低くなります(図5)。 最適な解像度を伴う最良の画素サイズを検討してください。
図5 – 左:大きな画素サイズは高い感度を生みますが、解像度は低くなります。 |
顕微鏡用カメラの使用のベストプラクティス
理想的な画像取得設定はアプリケーションとサンプルによって異なりますが、共通する2つのパラメーターは励起光の強度と露光時間です。 長い露光時間または強い励起光は、明るい蛍光をもたらし、高いSNRにつながります。 ただし、光毒性への悪影響もあります。 このことは重要な疑問を生みます。励起光による細胞への損傷を抑えながら、長時間のライブセルイメージング実験を行うために、最良の画像取得パラメーターをどのように設定するか、というものです。
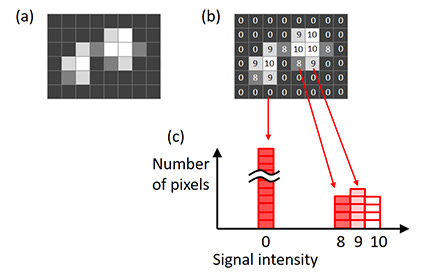
理想的な露光時間を判断するには、画像ヒストグラムを使用します。 ヒストグラムのX軸は信号強度です。 各X値のヒストグラムの高さは、信号強度に対する画素数を表します(図6)。
図6 – 画像のヒストグラム。 (a)オリジナル画像、(b)オリジナル画像に示された各画素の信号強度、 |
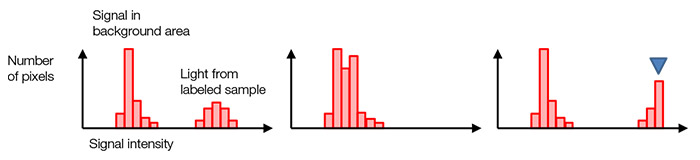
通常、黒色のバックグラウンド画素は、バックグラウンド光がない場合でもゼロ以外の信号値を持ちます(図7、左)。 これによって、図4(d)に示した読み出しノイズ変動による負の値の信号を避けられます。 ヒストグラムの形状と分布から、現在の露光時間が適切かどうかわかります。 ヒストグラムが低い信号範囲内に集まりすぎている場合は、露光時間が短すぎます(図7、中央)。 最大信号レベルで尖った崖状になっている場合は、信号値が飽和しています(図7、右)。 この場合、励起光強度を低くするか、露光時間を短くすることができます。
図7 – 標準的な露光(左)、露光不足(中央)、 |
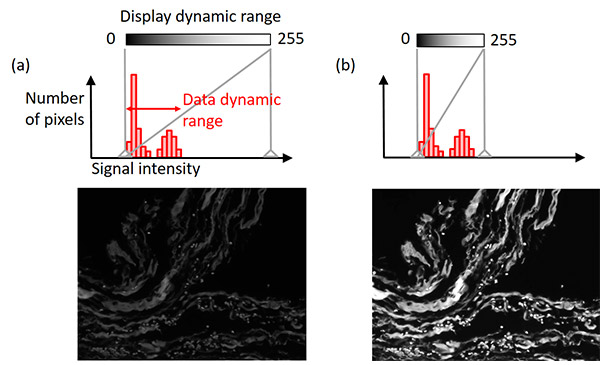
画像取得ソフトウェアの中には、オリジナル画像データを保持しつつ、見やすくする自動表示調整機能を持つものがあります。 ほとんどの場合、モノクロカメラの信号ダイナミックレンジ(例えば、 16ビット= 65,536レベル)は、ディスプレイのダイナミックレンジ(通常、8ビット= 256レベル)より広くなっています。
表示調整機能では、信号強度とディスプレイの明るさの関係が指定されます。 サンプルの最も明るい信号の強度が、カメラで処理可能な最大強度よりかなり低いことはよくあります。 この場合、ディスプレイのダイナミックレンジをデータのダイナミックレンジ(バックグラウンドレベルから最大強度の信号までの範囲)に合わせれば、オリジナル画像データを保持しつつ、見やすくなります(図8)。 調整の説明にはヒストグラムが役立ちます。
図8 – ディスプレイ調整:(上)ディスプレイ設定インジケータを灰色の垂直線で示したヒストグラム、(下)画像例。 左の画像例:オリジナルのディスプレイ設定。 右の画像例:オリジナル画像データを保持しつつ、表示条件を調整。 |
顕微鏡カメラのデータ収集パラメーターを設定するための6つのステップ
要約すると、実験用に顕微鏡カメラを正しく設定するには、一般的に以下に示す6つのステップがあります。 最善の手順は、特定のアプリケーションやサンプルによって異なることに注意してください。
- 観察倍率を決定します。
- サンプルにピントを合わせ、観察対象を見つけます。 プロセスを短縮して高毒性を最小限に抑えるため、高いゲインまたはビニングモードの使用を検討してください。 最高の条件で信号を観察するために自動または手動の表示調整を行うことと、画像の観察をしないときは必ず励起光シャッターを閉じることもお勧めします。
- 画像取得のためにゲインとビニングモードを戻します。
- 励起光の強度を最も弱くして、現実的な露光時間で信号を観察できるかどうか確認します。 信号を確認できないか、SNRが低すぎる場合は、露光時間を長くしてみます。
- 露光時間が非現実的な長さになるか、画像取得速度に対して許容される最大露光時間より長い場合は、励起光強度を徐々に上げていきます。
- ヒストグラムを調べて飽和状態がないことを確認します。
結論
顕微鏡観察プロセスでは、画像とデータの品質にたくさんの要因が寄与している一方で、デジタルイメージングの基本とヒントを押さえておけば、実験ごとに最良の取得設定を判断しやすくなります。 信号を最大化して、バックグラウンド信号を最小限に抑え、サンプル状態を最適にすることが、あらゆるアプリケーションや実験にとってデータ品質を向上させるために欠かせない要素です。
著者
 |
小蒲健夫
科学ソリューション部門 OLYMPUS CORPORATION OF THE AMERICAS |
このページはお住まいの地域ではご覧いただくことはできません。