FV10i-LIV 共焦点顕微鏡
生産・販売終了製品

本製品は生産を終了致しました。 現行の製品を見るにはこちらをクリックしてください
オールインワン共焦点顕微鏡 FLUOVIEW FV10i は、オリンパスの高品質の光学系やソフトウェア技術をワンボックスに搭載し、初めてのユーザーでも高い操作性で高品質の共焦点画像の効率的取得を可能にしました。
このページはお住まいの地域ではご覧いただくことはできません。
特長
使う人の視点から生まれたオールインワンレーザー顕微鏡
設置する場所、使う時間、使う人を選ばない一体型ボディ
FV10iの最大の特長は、その斬新なワンボックス・デザインにあります。多様な装置と複雑なセッティングが必要だったレーザー顕微鏡のイメージを刷新し、ダイオードレーザーやインキュベーターなど全ての機能を内蔵した一体型ボディを実現しました。さらにコンパクトなだけでなく、除振機能や暗室不要の遮光カバーを装備するなど、使い勝手を徹底的に追求。専用の部屋を用意することなく、研究室内に容易に設置できます。それは、まさに分析装置と同じ感覚です。FV10iが人と研究とレーザー顕微鏡の関係を一新します。

| 1. 暗室機能 | ボディと遮光カバーを一体化。従来のレーザー顕微鏡のように暗室を必要とせず、研究室で手軽に使用できます。 |
|---|---|
| 2. スキャンユニット | 蛍光色素に合わせて条件を自動設定する検出器をスキャンユニットに搭載。各蛍光色素に最適な条件でイメージングできます。 |
| 3. 顕微鏡機能 | 対物レンズ、ステージ、フォーカス機能をボディに内蔵。10xおよび60xの対物レンズとズームにより、10~600xで撮影できます。 |
| 4. 除振機能 | 除振機能を備えたインシュレータを内蔵。除振台が不要で、研究室のデスクにそのまま設置できます。 |
| 5. レーザーコンバイナー | 4本のレーザーユニットを装備。すべてコンパクトで長寿命・省電力のダイオードレーザーを採用しています。 |
高精細な共焦点画像を追求した、先進の光学性能
4波長のダイオードレーザーを搭載

4つ (405/473/559/635nm) のレーザーを搭載しており、最大4色までの多重染色標本のイメージングが可能。レーザーユニットには、すべて長寿命でメンテナンス不要、省電力のダイオードレーザーを採用しており、駆動音も静かです。
検出器に新開発の分光方式を採用

検出部は、蛍光2チャンネル、透過位相差1チャンネル。蛍光チャンネルには、グレーティング、ビーム・スプリッター、スリットで構成される新開発の分光方式を採用しています。また、蛍光色素の特性に合わせて最適な波長幅が自動設定される、可変バリアフィルター機能を搭載しています。
2つのシーケンシャルモード
ラインシーケンシャルとフレームシーケンシャルのモードを搭載。蛍光色素2色までのイメージングではクロストークのないラインシーケンシャルで、また、3・4色ではバーチャルチャンネル機能によるフレームシーケンシャルで画像を取得できます。
10x・60x 2つの対物レンズを装備

10xおよび60xの2つの対物レンズを装備。ズーム機構により、10~600xまで連続的に倍率を変えられます。標本のサイズなどに応じた最適のイメージング条件を効率よく設定できます。
インキュベーターをはじめ、使いやすいタイムラプスの新機能
簡易インキュベーターを内蔵

簡易インキュベーターを内蔵しており、面倒なセットアップも必要なく、容易にライブセルのタイムラプスイメージングを行えます。培養容器内の環境を温度37℃、湿度90%、CO2濃度5%*に保持。最長3日間のタイムラプス撮影をサポートします。
*インキュベーター内をCO2濃度5%に保持するには、6%CO2ガスを流量150ml/minで流入してください。
専用培養ポッドを付属

φ35mmガラスボトムディッシュ対応の専用培養ポッドを付属。培養液の環流や、タイムラプス中の薬液の投与が可能です。また、オートクレーブ滅菌に対応しています。
安定したタイムラプスイメージング
インキュベーターだけでなく周辺内部の空間も37℃に保持。長時間にわたって安定した状態の細胞のタイムラプス撮影が可能です。システムの設置環境温度が変動すると、フォーカスがドリフトすることがあります。
水浸対物レンズに水を自動補給

新開発の自動水補給システムにより、水浸対物レンズの先端に自動的に水を補給します。長時間タイムラプスでも、レンズ先端部の水の乾きに気を配ることなく安心してイメージングを行えます。また、対物レンズの切り替え時にも自動的に水を補給します。
カバーガラス厚を検知し、補正環を自動調整

水浸対物レンズ使用時は、カバーガラスの厚みを検知し補正環を自動的に調節する機能を備えており、いつでも最良の状態でイメージングできます。
マルチエリアタイムラプスに対応
高精度な電動ステージを備えており、マルチエリアタイムラプスによる効率的なイメージングを行えます。1ディッシュ (ウェル) で10カ所のポイント指定が可能。たとえばφ35mmガラスボトムディッシュの場合、3つのディッシュが装着できるため、最大で30カ所の撮影が行えます。
使い始めたその日から、スムーズに撮影をスタートできる、「新」操作感覚
使う人それぞれに、ストレスのない快適な操作環境
標本をステージにセットしてカバーを閉じる。FV10i本体で行う作業はわずかこれだけで完了です。後はすべて洗練された画面でわかりやすく、効率よく操作できます。たとえば、これまで経験と専門知識が必要だった撮影ポイント選択も、新開発のイメージマッピング機能で誰でも簡単&スピーディ。さらに、オートフォーカスや自動明るさ調整など、オリンパスならではの先進のオートマティック機能によって、標本や撮影モードに合わせて撮影条件が設定されます。また、撮影の手順がひと目でわかるナビゲーション機能を装備。レーザー顕微鏡を初めて使う人にもストレスのない快適な操作環境を提供します。
セッティング
標本をセットしたら、蛍光色素を選択。わずかそれだけの操作で、最適な撮影条件が自動的に設定されます。
イメージマッピング機能
<Start>ボタンをクリックするだけで、自動的に標本のマップイメージを作成。誰でも簡単に撮影したいポイントを見つけられます。
撮影機能
ズーミングやポイントの移動など、洗練された画面操作で撮影ポイントの設定もスピーディ。後はボタンをクリックするだけで撮影完了です。
クリックひとつで自動的にマップイメージを作成
探すのではなく、「選ぶ」感覚で、撮影したいエリアを見つけられます
セッティングが完了したら、<Start>ボタンをクリック
標本のセッティングが完了したら、「Acquire Map Image」画面で<Start>ボタンをクリック。すると、自動的に標本のマップイメージの作成が始まります。それはあたかも細胞を鳥瞰するかのような感覚。誰でも容易にスピーディに、撮影したいエリアを見つけ出すことができます。
マッピングエリア選択
φ35mmガラスボトムディッシュ、スライドガラスなど、 初めての人でも容易に撮影ポイントを見つけられます。セッティングした標本のタイプに応じてエリアを表示。スキャニングしたいエリアをクリックすると、そのエリアがマップイメージ画面にプレビューされます。また、エリアの切り替えもクリックで容易に操作できます。
蛍光色素切替
蛍光色素ごとにマップイメージ画面の表示を切り替えられます。重ね合わせて表示することも可能です。
キャニングモード設定
目的に応じて、次の2つのスキャニングモードを選択できます。
Automatic
中心から渦巻状に自動でマップイメージを作成。初めての人でも容易に撮影ポイントを見つけられます。
Manual
マップの中から見たいポイントをランダムに選択できます。
最大9x9エリアから選択が可能。あらかじめポイントを絞り込んだ効率のよい選択が可能です。
任意の標本マップを自動生成

セットされた標本ホルダを自動検出し、任意のマップ画像を作成します。高速モード (低解像) でマップイメージを作成することも可能です。
初めての人でも安心な、ナビゲーション機能
ズーミングやポイントの移動なども、洗練された画面でスマートに操作。
マップイメージとライブイメージの2つの画面を使って、撮影したいポイントを素早く絞り込めます。ズーミングやポイントの移動なども直感的な操作で簡単&スピーディ。さらに、初めてレーザー顕微鏡を使う人でもスムーズに撮影を完了できる、使い勝手のよいナビゲーション機能を装備しています。
| 撮影モード選択 |
タイムラプス、Zスタック、マルチエリアなど、5タイプの撮影モードを選択できます。
タイムラプス 指定したポイントをあらかじめ設定した時間間隔で連続的に撮影します。 Zスタック 焦点位置を変えて連続的に撮影。3次元の画像を取得できます。 Zスタック- タイムラプス タイムラプスとZスタックを合わせた撮影が可能です。 マルチエリア- タイムラプス タイムラプス撮影を、点在する複数のポイントで自動的に行います。 マルチエリア - Zスタック- タイムラプス 3つの機能を合わせた撮影を実行します。 |
|---|---|
| マルチエリア選択 | マルチエリアモード時に撮影するエリアを登録。エリアごとに適切な撮影条件を設定できます。 |
| マップイメージ画面 | 「Acquire Map Image」で取得した画像が表示されます。この画面を使って撮影ポイントを絞り込みます。 |
| コントロール画面 |
各種コントローラーを操作して詳細な撮影条件を設定することも可能です。主に以下の設定が行えます。
|
| ライブイメージ画面 | マップイメージ画面で絞り込んだポイントを表示。さらに移動やズーミングを行って撮影ポイントを決定します。蛍光色素別など表示をさまざまに切り替えることもできます。 |
初めての人も安心なナビゲーション機能を備えています

「Navigation」の<Start>ボタンをクリックすると、操作の手順が示され、それとともに次に操作するボタンがハイライトで点滅表示されます。ナビゲーションに従って操作するだけでスムーズに撮影を完了できます。
貼り合わせ機能

隣り合った領域を撮影することにより、高解像で広い領域の画像取得が可能です。またスライドガラス全体のマップイメージも作成可能です。
ソフトウェア ZDC 機能 (FV10i-LIV Only)

タイムラプス中のZドリフト補正機能 (ソフトウェア ZDC 機能) により、温度変化のある環境下などでの長時間タイムラプス中のZドリフトをさらに軽減できます。
多彩な編集・解析を容易に行えるFLUOVIEW専用ソフトウェア
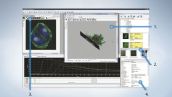
オリンパスオリジナルの編集・解析用ソフトウェアを付属しています。FV10iで撮影した画像を、さまざまに編集・解析できます。
| 1. 3D表示機能 | 3D表示機能として、Alpha Blend法とMaximum Intensity Projection法をサポート。また、3D画像の角度を自由に変えたり、任意の箇所で断面表示したり、多彩な機能を備えています。 | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 2. 容易な画像検索 | メイン画面と同時にサムネイル画面の表示が可能。過去のデータなどを簡単に探すことができます。 | ||||||||
| 3. 2D解析ツール |
| ||||||||
| 4. データマネージャー | サムネイルや各種ファイル情報の表示を効率よく行えます。 |
ファイル I/O
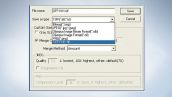
各種条件と画像を同時に保存するOIF (Olympus Image Format) を採用。また、TIFFやBMP、JPEGなど、互換性の高い各種フォーマットにも対応しています。
効率よくストレスのないイメージングをサポートする充実の機能
各種の標本ホルダを付属

φ35mmガラスボトムディッシュ、スライドガラス、カバーガラスチャンバ (8ウェルタイプ) 、ウェルスライドに対応した標本ホルダを付属しています。また、φ35mmガラスボトムディッシュ利用時はプラスティックの蓋をしたまま観察が可能で、コンタミネーションなどの心配もありません。
隣り合った領域の画像の取得
2x2、3x3の隣り合った画像のイメージングが可能です。隣り合った領域を撮影することにより、時間とともに移動する細胞が視野から外れることを防ぎます。
大容量データも安心のHDDレコーディング
HDD (ハードディスク) レコーディング機能を備えており、撮影した画像を自動的にHDDに保存できます。大容量データとなる長時間タイムラプスなどの場合でも安心です。また、イメージングの最中に、すでに撮影した映像の編集・解析を行えます。保存先にネットワークで接続した外部のHDDを指定することも可能で、イメージング中に離れた場所にあるPCで再生できます。
仕様
| レーザーユニット > ネガティブチャープ搭載多光子励起用IRパルスレーザー | - | |
|---|---|---|
| レーザーユニット > 導入光学系 |
内蔵
| |
| レーザーユニット > 光刺激用可視光レーザー(オプション) | - | |
| レーザーユニット > 可視光LDレーザー > 405 nm |
| |
| レーザーユニット > 可視光LDレーザー > 440 nm |
| |
| レーザーユニット > 可視光LDレーザー > 473 nm |
| |
| レーザーユニット > 可視光LDレーザー > 559 nm |
| |
| レーザーユニット > 可視光LDレーザー > 635 nm |
| |
| レーザーユニット > HeNe(G) レーザー (543 nm, 1 mW) |
| |
| 走査, 検出 > メインスキャナー > 標準レーザーポート |
| |
| 走査, 検出 > メインスキャナー > 検出器 > スタンダード検出器 |
| |
| 走査, 検出 > メインスキャナー > 検出器 > 冷却 GaAsP-PMT 2チャンネル |
| |
| 走査, 検出 > メインスキャナー > 検出器 > オプション 4チャンネル検出器 |
| |
| 走査, 検出 > メインスキャナー > 受光方式 > アナログ積算モード |
| |
| 走査, 検出 > メインスキャナー > 受光方式 > フォトンカウンティングモード |
| |
| 走査, 検出 > メインスキャナー > 可視 - UV - IR 励起ダイクロイックミラーターレット |
| |
| 走査, 検出 > メインスキャナー > ビームスプリッターターレット |
| |
| 走査, 検出 > メインスキャナー > 波長選択 | 蛍光チャネルには回折格子とスリットによる可変バリアフィルター機構 | |
| 走査, 検出 > ガルバノメータースキャナー (高精細イメージング) > ガルバノメータースキャナー (X, Y) |
| |
| 走査, 検出 > ガルバノメータースキャナー (高精細イメージング) > 走査モード > 2D | XY | |
| 走査, 検出 > ガルバノメータースキャナー (高精細イメージング) > 走査モード > 3D | XYT, XYZ | |
| 走査, 検出 > ガルバノメータースキャナー (高精細イメージング) > 走査モード > 4D | XYZT | |
| 走査, 検出 > ガルバノメータースキャナー (高精細イメージング) > 走査モード > 5D | - | |
| 走査, 検出 > ガルバノメータースキャナー (高精細イメージング) > 走査モード > その他 |
マップイメージ, ワンショット
| |
| 走査, 検出 > ガルバノメータースキャナー (高精細イメージング) > 走査スピード |
| |
| 走査, 検出 > ガルバノメータースキャナー (高精細イメージング) > ピンホール |
蛍光2CH 共通光路に1 基
| |
| 走査, 検出 > ガルバノメータースキャナー (高精細イメージング) > 走査ズーム |
| |
| 走査, 検出 > レゾナントスキャナー (高速イメージング) > 走査モード > 2D | - | |
| 走査, 検出 > レゾナントスキャナー (高速イメージング) > 走査モード > 3D | - | |
| 走査, 検出 > レゾナントスキャナー (高速イメージング) > 走査モード > 4D | - | |
| 走査, 検出 > レゾナントスキャナー (高速イメージング) > 走査モード > 5D | - | |
| 走査, 検出 > レゾナントスキャナー (高速イメージング) > 走査モード > その他 | - | |
| 走査, 検出 > レゾナントスキャナー (高速イメージング) > 走査スピード | - | |
| 走査, 検出 > レゾナントスキャナー (高速イメージング) > 走査ズーム | - | |
| 走査, 検出 > 視野数 |
| |
| 走査, 検出 > Z駆動部 |
| |
| 走査, 検出 > 透過光検出器 | 位相差用: 1 基 | |
| 顕微鏡 > フレーム |
| |
| 顕微鏡 > フレーム > 倒立 |
| |
| 顕微鏡 > 対物レンズ, 焦準部 > 対物レンズ |
| |
| 顕微鏡 > 対物レンズ, 焦準部 > オートフォーカス (AF) |
| |
| 顕微鏡 > 対物レンズ, 焦準部 > 水補給 |
| |
| 顕微鏡 > 対物レンズ, 焦準部 > オイル補給 |
| |
| 顕微鏡 > XYステージ > XY駆動方式 |
| |
| 顕微鏡 > XYステージ > 標本ホルダー |
| |
| 顕微鏡 > インキュベーター > 内部環境 |
| |
| 顕微鏡 > インキュベーター > 加熱方式 |
| |
| システム制御 > コントローラー |
| |
| システム制御 > 電源ユニット | - | |
| オプションユニット > 光刺激スキャナー |
| |
| オプションユニット > TIRFMユニット |
| |
| ソフトウェア > 画像取得 | - | |
| ソフトウェア > プログラマブルスキャンコントローラー | - | |
| ソフトウェア > 画像表示 | - | |
| ソフトウェア > 3次元構築・観察 | - | |
| ソフトウェア > 画像形式 | - | |
| ソフトウェア > 蛍光分離 | - | |
| ソフトウェア > 統計処理 | - | |
| ソフトウェア > オプションソフトウェア | - | |
| ソフトウェア > 画像取得モード |
マップイメージ,ワンショット,タイムラプス (XYT) ,Z スタック (XYZ) ,Z スタックタイムラプス (XYZT) ,
| |
| ソフトウェア > マップ画像取得 |
10× 対物レンズにて3×3 ~ 9×9 (エリアは標本ホルダーにより異なります)
| |
| ソフトウェア > マルチエリアタイムラプス |
電動XYステージによる自動マルチエリアタイムラプス
| |
| ソフトウェア > 画像取得領域領 | 領域指定: 全画面, 矩形領域クリップ (最小 96×96 画素) | |
| ソフトウェア > 画像表示 |
| |
| ソフトウェア > クロストーク低減 | ラインシーケンシャル動作 (2CH) もしくはフレームシーケンシャル動作 (3CH, 4CH) | |
| ソフトウェア > 取得画像ファイル形式 |
| |
| ソフトウェア > 閲覧可能画像ファイル形式 |
| |
| ソフトウェア > 画像編集 |
LUT: 擬似カラー設定, コントラスト調整
| |
| ソフトウェア > 3 次元画像構築 | 3D 表示: AlphaBlend 法, Maximum Intensity Projection 法 3D アニメーション表示, 断面切り出し表示 | |
| ソフトウェア > 画像処理 | - | |
| ソフトウェア > IRレーザー制御 |
| |
| ソフトウェア > 多点タイムラプスソフトウェア (オプション) | - | |
| ソフトウェア > マッピングとマルチポイント刺激ソフトウェア(オプション) | - | |
| ソフトウェア > シーケンサーマネージャー (オプション) | - | |
| 寸法, 質量, 電圧/電流 > スキャナー付き顕微鏡ユニット > 寸法 (mm) |
| |
| 寸法, 質量, 電圧/電流 > スキャナー付き顕微鏡ユニット > 質量 (kg) |
| |
| 寸法, 質量, 電圧/電流 > スキャナー付き顕微鏡ユニット > 消費電力 |
| |
| 寸法, 質量, 電圧/電流 > 蛍光照明ユニット > 寸法 (mm) |
| |
| 寸法, 質量, 電圧/電流 > 蛍光照明ユニット > 質量 (kg) |
| |
| 寸法, 質量, 電圧/電流 > 蛍光照明ユニット > 消費電力 |
| |
| 寸法, 質量, 電圧/電流 > 透過光検出ユニット > 寸法 (mm) |
| |
| 寸法, 質量, 電圧/電流 > 透過光検出ユニット > 質量 (kg) |
| |
| 寸法, 質量, 電圧/電流 > 透過光検出ユニット > 消費電力 |
| |
| 寸法, 質量, 電圧/電流 > 顕微鏡コントロールユニット > 寸法 (mm) |
| |
| 寸法, 質量, 電圧/電流 > 顕微鏡コントロールユニット > 質量 (kg) |
| |
| 寸法, 質量, 電圧/電流 > 顕微鏡コントロールユニット > 消費電力 |
| |
| 寸法, 質量, 電圧/電流 > FVパワーサプライユニット > 寸法 (mm) |
| |
| 寸法, 質量, 電圧/電流 > FVパワーサプライユニット > 質量 (kg) |
| |
| 寸法, 質量, 電圧/電流 > FVパワーサプライユニット > 消費電力 |
| |
| 寸法, 質量, 電圧/電流 > レーザーコンバイナー用電源 > 寸法 (mm) |
| |
| 寸法, 質量, 電圧/電流 > レーザーコンバイナー用電源 > 質量 (kg) |
| |
| 寸法, 質量, 電圧/電流 > レーザーコンバイナー用電源 > 消費電力 |
| |
| 寸法, 質量, 電圧/電流 > レーザーコンバイナー (Multi Ar付き) > 寸法 (mm) |
| |
| 寸法, 質量, 電圧/電流 > レーザーコンバイナー (Multi Ar付き) > 質量 (kg) |
| |
| 寸法, 質量, 電圧/電流 > レーザーコンバイナー (Multi Ar付き) > 消費電力 |
| |
| 寸法, 質量, 電圧/電流 > レーザーコンバイナー (Multi Arなし) > 寸法 (mm) |
| |
| 寸法, 質量, 電圧/電流 > レーザーコンバイナー (Multi Arなし) > 質量 (kg) |
| |
| 寸法, 質量, 電圧/電流 > レーザーコンバイナー (Multi Arなし) > 消費電力 |
| |
| 寸法, 質量, 電圧/電流 > LD559レーザー電源 > 寸法 (mm) |
| |
| 寸法, 質量, 電圧/電流 > LD559レーザー電源 > 質量 (kg) |
| |
| 寸法, 質量, 電圧/電流 > LD559レーザー電源 > 消費電力 |
| |
| 寸法, 質量, 電圧/電流 > Multi Arレーザー電源 > 寸法 (mm) |
| |
| 寸法, 質量, 電圧/電流 > Multi Arレーザー電源 > 質量 (kg) |
| |
| 寸法, 質量, 電圧/電流 > Multi Arレーザー電源 > 消費電力 |
| |
| 寸法, 質量, 電圧/電流 > HeNeGレーザー電源 > 寸法 (mm) |
| |
| 寸法, 質量, 電圧/電流 > HeNeGレーザー電源 > 質量 (kg) |
| |
| 寸法, 質量, 電圧/電流 > HeNeGレーザー電源 > 消費電力 |
| |
| 寸法, 質量, 電圧/電流 > 使用環境 (室内使用) > 周辺温度 | 18 - 28 °C (使用中の室温変化は ±2 °C) | |
| 寸法, 質量, 電圧/電流 > 使用環境 (室内使用) > 最大湿度 | 30 - 80 % (結露なきこと) | |
| 寸法, 質量, 電圧/電流 > 使用環境 (室内使用) > 電源電圧変動 | - |
コントローラーおよびモニター
| 寸法、質量、電圧/電流 | FVコントロールユニット | 寸法 (mm) | 169 (W) x 445 (D) x 432 (H) |
|---|---|---|---|
| 質量 (kg) | 13.5 | ||
| 消費電力 | AC 100~240 V 50/60 Hz 7 A | ||
| モニター | 寸法 (mm) | 530.8 (W) x 233 (D) x 368 - 488.2 (H) | |
| 質量 (kg) | 6.2 | ||
| 消費電力 | AC 100 V 50/60 Hz 0.85 A |
アプリケーション
細胞周期マーカー"Fucci"による幹細胞生理状態の可視化
| CD133 陽性の胃がん幹細胞(細胞周期マーカー Fucci発現)のスフェロイドを長時間連続で観察した。上のスフェロイドは、血清を抜いた状態で培養しており、細胞周期が止まっていることから、幹細胞性を維持していることがわかる。一方、下のスフェロイドは、血清を加え培養したもので、血清により細胞分裂が起こり、スフェロイドから単層培養へ戻る、すなわち幹細胞の状態を失うことが示唆される。共焦点レーザ顕微鏡FV10iは厚みのあるスフェロイドを立体的に観察することが可能である。※レーザ顕微鏡FV10iで48時間連続撮影。 |
画像データのご提供:
岡山大学大学院医歯薬学総合研究科消化器外科学分野
矢野 修也先生、藤原 俊義先生
参照論文:
Yano S, Tazawa H, Hashimoto Y, Shirakawa Y, Kuroda S, Nishizaki M, Kishimoto H, Uno F, Nagasaka T, Urata Y, Kagawa S, Hoffman RM, Fujiwara T. A genetically engineered oncolytic adenovirus decoys and lethally traps quiescent cancer stem-like cells into S/G2/M-phases. Clin Cancer Res. December 1, 2013 19:6495-6505.
テロメライシン(Telomelysin、OBP-301)による休眠癌幹細胞の活性化と細胞破壊
| スフェロイド培養(三次元培養)したCD133 陽性の胃がん幹細胞(細胞周期マーカー Fucci発現)へ、テロメライシン(OBP-301)、シスプラチン、放射線、それぞれの処理を行った。 シスプラチンや放射線では癌細胞塊の大きさは変わらず、ほとんどの細胞はG1 期(赤色)で止まっているが、 テロメライシンを投与された癌細胞塊では、表面から細胞は黄色や緑に変わり、徐々に癌細胞塊のサイズが減少していく様子がわかる。「テロメライシン」は胃がん幹細胞の細胞周期を止めているp53 やp21 の発現を抑え、逆に細胞周期を回転させるE2F-1 の発現を上げることが示唆される。※レーザ顕微鏡FV10iで8日間連続撮影。 |
画像データのご提供:
岡山大学大学院医歯薬学総合研究科消化器外科学分野
矢野 修也先生、藤原 俊義先生
参照論文:
Yano S, Tazawa H, Hashimoto Y, Shirakawa Y, Kuroda S, Nishizaki M, Kishimoto H, Uno F, Nagasaka T, Urata Y, Kagawa S, Hoffman RM, Fujiwara T. A genetically engineered oncolytic adenovirus decoys and lethally traps quiescent cancer stem-like cells into S/G2/M-phases. Clin Cancer Res. December 1, 2013 19:6495-6505.
Fucciを導入したHT29細胞のスフェロイドイメージング
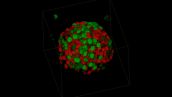
画像データのご提供:
公益財団法人がん研究会がん化学療法センター
臨床部 三嶋 雄二先生、畠 清彦先生
積層化された筋芽細胞シート内での繊維芽細胞の挙動
|
画像データのご提供:
大阪大学大学院工学研究科 生命先端工学専攻 生物学コース 生物プロセスシステム工学研究室 長森 英二先生、 紀ノ岡 正博先生 |
ゼブラフィッシュの胚発生におけるレチノイン酸シグナリングの検出

画像データのご提供:
理化学研究所 脳科学総合研究センター 細胞機能探索技術開発チーム
下薗 哲先生、宮脇 敦史先生
参照論文:
Shimozono S. et al. Visualization of an endogenous retinoic acid gradient across embryonic development. Nature 496, 363-366 (18 April 2013)
抗体依存性細胞障害(ADCC)の観察
| PMI4788細胞(ヒト大腸癌由来株化細胞)にセツキシマブ(抗体医薬)処理を行いNK細胞と共に培養。NK細胞添加後にFV10iにて抗体依存性細胞障害を観察。セツキシマブ:Alexa647(赤) NK細胞:ZsGreen(緑) 細胞死判定用:DAPI(青) |
画像データのご提供:
公益財団法人がん研究会がん化学療法センター 臨床部
三嶋 雄二先生、畠 清彦先生。安部 隆史(オリンパス株式会社)が撮影。
抗がん剤シスプラチン濃度違いによる作用・効果の観察
|
Fucciを導入した大腸がん由来培養細胞株HT-29に抗がん剤 Cisplatinを投与し、細胞に与える影響を連続観察した。
35mmガラスボトムディッシュに継代培養した2日目の培養細胞に対しCisplatinを低濃度(0.25µg/ml)、高濃度(2.5µg/m)l、コントロール(0µg/ml)で各々投与した。 |
画像データのご提供:
公益財団法人がん研究会がん化学療法センター 臨床部
三嶋 雄二先生、畠 清彦先生
破骨細胞融合過程における
イノシトールリン脂質局在の解析
| ドキシサイクリン添加によりイノシトールリン脂質結合ドメインを発現するRAW264.7細胞を樹立し、1µg/ml doxycyclineと10 ng/ml RANKL存在下で48h培養した後ライブ観察した。PtdIns(4,5)P2 の局在は赤で、PtdIns(3,4,5)P3の局在は緑で示す。 画像は2分ごと、34分に渡って取得した。 |
画像データのご提供:
北海道大学大学院医学研究科 生化学講座分子生物学分野 連携研究センター光バイオイメージング部門
及川 司先生
参照論文:
Oikawa T, et al. Tks5-dependent formation of circumferential podosomes/invadopodia mediates cell-cell fusion. J Cell Biol. 197(4):553-568(2012).
HeLa 細胞※1
|
染色: YFP (Actin)
対物レンズ: 60XW NA1.2 レーザー波長: 473nm インターバル: 3.5 分毎 (トータル12時間) |
マウス脳
|
DAPI (nuclei - blue), Alexa 488 (Actin - green), Alexa 568 (Neurofilament - red).
興味のある9箇所の異なる領域を、1024X1024の解像で、14枚以上のZセクションで自動取得し、FV10iのソフトウェアで構築。 |
HeLa 細胞※1
|
インターバル: 20 分毎 (一昼夜)
グリーン: GFP マゼンタ: Mito Tracker Red |
※1 HeLa細胞は医学研究で最も重要な細胞株の一つで、科学の発展に偉大な貢献をしました。しかし、この細胞の元となったヘンリエッタ・ラックス(Henrietta Lacks)さんの同意が得られていなかった事実を認識しなければなりません。HeLa細胞の使用は、免疫学や、感染症学、癌研究などにおける重要な発見に貢献しましたが、同時に医学における個人情報保護や倫理についての重要な議論も引き起こしました。
ヘンリエッタ・ラックスさんの生涯と現代医学への貢献における詳細は、以下にアクセスしてご覧ください。
http://henriettalacksfoundation.org/