FLUOVIEW FV3000 Redを用いたNIRイメージングによる新規蛍光ナノプローブの腫瘍標識性の検証
1. NIRイメージングにおける様々な課題
蛍光イメージングは様々な生物医学イメージングに利用されていますが、その中でもNIRイメージング(Near Infrared imaging)は、透過性が高く深部まで観察可能できること、低い光毒性、組織からの自家蛍光の少なさから、医学研究、特に腫瘍診断において大変注目されています。
蛍光タンパクなどの従来の蛍光マーカーと比べ、蛍光ナノプローブは、化学組成や構造、サイズの改変によりNIRイメージングに利用することが可能で、局在認識や、ドラッグデリバリー、マルチモーダル検出など様々な用途に向けて改良することができます。しかし現在の蛍光プローブの多くは、主に可視領域およびNIR-I領域(400-1000nm)でのイメージングのためのものであり、深部観察には限界がありました。最近の研究ではNIR-Ⅱ領域(1000−1700nm)での蛍光イメージングにも対応させることが可能なことがわかってきました。NIR-Ⅱ蛍光イメージングでは、更に深部での観察が可能なだけでなく、光散乱と自家蛍光が少ないという特性もあり、より高解像に画像取得が可能です。これにより、従来の蛍光イメージングでは明らかにできなかった生体情報の取得に期待がされています。
より高解像にin vivoイメージングを行うためには、プローブ設計が非常に重要です。D-A-D(donor-acceptor-donor)構造を持つ分子は、その高い生体適合性などの点からNIR-II分子設計において特に注目されており、強力な電子受容体であるbenzo[1,2-c:4,5-c']bis([1,2,5]thiadiazole) (BBTD)が広く使用されています(図1a)。しかしD-A-D 構造を持つNIR-II分子は、強いICT(Intramolecular Charge Transfer, 分子内電荷移動)効果のため、量子収率が比較的低く、更にBBTDは合成条件が厳いため開発が困難とされていました。電荷移動能力の強さは受容体ユニットを変えることで調整できるため、BBTDを比較的電荷移動能力の弱い受容体に置き換えることで、NIR-II蛍光分子の量子収率(QYs)が強化されICT効果を抑制できることが期待されます。
今回、南方科技大学の李凯先生のグループは、南京科技大学の刘杰先生のグループ、中国科学院上海医薬研究所の陈浩先生のグループとの共同研究により生まれた受容体の分子エンジニアリング的設計法により、高い吸光係数と量子収率を持つNIR-II蛍光プローブを作ることに成功(図1b)しました。これにより、2次元だけでなく3次元的にも腫瘍の標的部位の検出が可能になりました。
出典:2021年11月10日にJournal of Materials Chemistry B
“Acceptor Engineering of Small Molecule Fluorophores for NIR-II Fluorescent and Photoacoustic Imaging”
この研究では、NIR-Ⅰ領域で光音響断層イメージング(PAT, photoacoustic tomography)を行いました。PATは非侵襲的に組織のサイズや形状、位置、および境界をより正確に三次元解析が可能であり、NIR-II 蛍光イメージング(FLI, fluorescence imaging)とNIR-I 光音響イメージング(PAI, photoacoustic imaging)の2つの手法の組み合わせ実験を行うことで、効率的に腫瘍診断をすることが可能になります。
また、一般的な共焦点顕微鏡システムでは、検出器がNIR領域に対応しておらず、検出効率が非常に低いという問題があります。今回は、NIR領域の研究に必要な700nm以上の波長のレーザーと、NIR領域に対応した検出器を備えたFV3000 Redシステムを用いて実験を行いました。
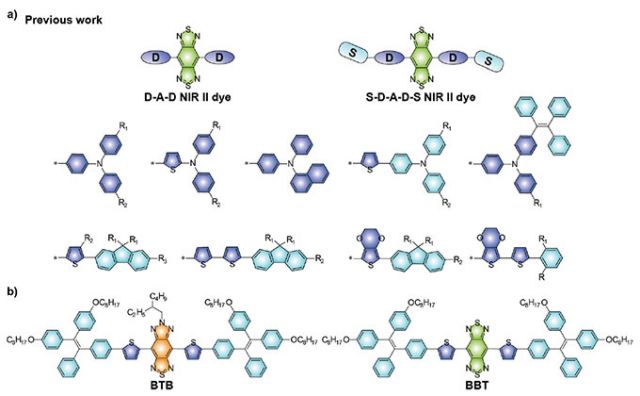
図1.(a)BBTD受容体に基づく代表的なD-A-DタイプNIR-II蛍光分子。(b)今回の論文で新しく報告されたNIR-II蛍光分子BTBおよびコントロール用蛍光分子BBTの化学構造。
2. イメージング手法を組み合わせた新規プローブの腫瘍標識性の検証
従来の蛍光プローブは、腫瘍そのものに対して標識性を持たないが、血管透過性・滞留性亢進効果(Enhanced Permeability and Retention; EPR効果)により腫瘍部位に濃縮滞留することがわかっていて、腫瘍のin vivoイメージングに応用できます。しかしこの受動的濃縮法には一定の大きさのナノ粒子が必要であり効率的ではありません。そこで今回は、Arg-Gly-Asp(RGD)ターゲティングペプチドでナノプローブ表面を修飾したBTB-RGD NPsナノプローブを使用し、BTB-RGD NPsの腫瘍標識性の検証を行いました。
まず、担がんマウスを用いてin vivo NIR-II蛍光イメージングと光音響断層イメージング(PAT)を行い、生体内での腫瘍部位のシグナル強度を確認しました。その結果、BTB-RGD NPを投与したマウスは、腫瘍部位で蛍光シグナルが有意に増加を示しましたが、BTB NPs投与マウスでは、腫瘍部位のシグナルの増加はわずかでした(図2)。
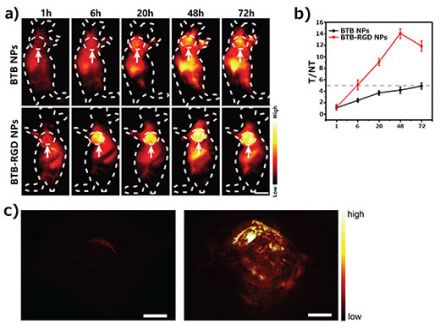
図2. 143B骨肉腫細胞を皮下接種した担がんマウスを使用し、BTB-RGD NPsまたは非標的のBTB NPsを投与後、特殊な蛍光イメージング装置を用いて72時間蛍光イメージングを行った。またPATを用いて、BTB-RGD NPsのターゲティング能力を3次元的に確認した。
(a) BTB-RGD NP投与マウスは、腫瘍部位でNIR-II蛍光シグナルの有意な増加を示したが、非ターゲティングBTB NPs投与マウスでは、腫瘍部位の蛍光はわずかに増加しただけだった。矢印は皮下腫瘍を示す。各群n = 4、励起波長:808nm、フィルター: 1000 nm long-pass、スケールバー: 5 mm。 (b) 143B腫瘍イメージングにおけるBTB NPs をベースとしたT/NT比。平均(標準偏差)でプロット。n = 4。 (c) BTB (左) または BTB-RGD NPs (右)投与後 48 時間のマウスの 143B 腫瘍のPAIの三次元構築。(励起:730 nm)スケール: 2 mm。
この実験においてNIR-Ⅱ蛍光イメージングとPATの結果が一致したことから、今回設計した蛍光プローブがNIR₋Ⅱ生体内にて有効に機能していることが確認できました。
さらに、BTB−RGD NPsの腫瘍標識性を細胞実験によって実証しました。この実験は共焦点顕微鏡を用いる必要がありますが、通常のシステムでは観察域が可視光に限定されているため、プローブを可視領域の類似構造に置き換えることで間接的にしか標識性を確認することができません。そこで今回は、イメージングモジュールがNIR観察用にアップグレードされ、NIR-Ⅰ領域までイメージングが可能になったFV3000 Redシステムで実験を行いました。
がん細胞(PC3:前立腺がん細胞、U87:膠芽腫)と正常細胞である 3T3細胞を40μg mL−1 BTB−RGD NPsまたはBTB NPs条件下で4時間共培養し、固定した後、FV3000 Redシステムで観察して、がん細胞の蛍光シグナル強度を確認しました。その結果、BTB−RGD NPsとの共培養後の蛍光シグナルは BTB NPs によるコントロール 群より高くなりました(図3)。これに対して、正常細胞である3T3 細胞では有意な差が見られませんでした。これらの結果により、RGD ペプチドで修飾したナノプローブには腫瘍標識性が増強されていることが確認できました。
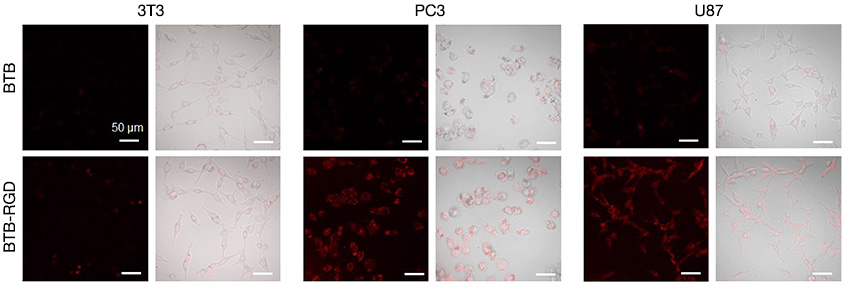
図3. BTB−RGD NPsまたはBTB NPs条件下で4時間培養した、がん細胞と正常な細胞のNIR-Ⅰ蛍光画像
【撮影条件】
システム:FV3000-NIR
励起波長:730nm
フィルター:760-890nm
スケール:50μm
これまでの実験では、観察に使用するシステムの観察域が可視光のみであったため、プローブを可視領域の類似構造に置き換えることで間接的にしか腫瘍標識性を確認することができませんでした。しかしFV3000 Redシステムを使用した今回の実験では、プローブを置き換えることなく、BTB-RGD NPの腫瘍細胞への標識性の測定を成功させることができました。
◆実験を可能にしたFV3000 Redの技術
FV3000 Redは、FV3000をベースとしたNIR検出ニーズに対応したシステムです。レーザー、光学系、対物レンズ、検出器など各イメージングモジュールをNIR検出用にアップグレードすることで、より高感度で正確なマルチカラーNIRイメージングに特化した、NIRイメージングソリューションを提供します。
|
|
 | 謝辞 本アプリケーションノートは南方科技大学医用生体工学科 李 凯 先生のご協力を得て作成されました。 |
参考文献: 1.V. J. Yao, S. D’Angelo, K. S. Butler, C. Theron, T. L. Smith, S. Marchio, J. G. Gelovani, R. L. Sidman, A. S. Dobraff, C. J. Brinker, A. R. M. Bradbuty, W. Arap. and R. Pasqualini, Ligandtargeted theranostic nanomedicines against cancer, J. Control. Release 2016, 240, 267-286. 2. B. Guo, Z. Sheng, D. Hu, C. Liu, H. Zheng, B. Liu, Through Scalp and Skull NIR-II Photothermal Therapy of Deep Orthotopic Brain Tumors with Precise Photoacoustic Imaging Guidance, Adv. Mater. 2018, 30, 1802591. 3. G. L. Bagnato, N. Irrera, G. Pizzino, D. Santoro, W. N. Roberts, G. Bagnato, G. Pallio, M. Vaccaro, F. Squadrito, A. Saitta, D. Altavilla, and A. Bitto, Dual αvβ3 and αvβ5 blockade attenuates fibrotic and vascular alterations in a murine model of systemic sclerosis, Clin. Sci. 2018, 132, 231-242. 4. N. Zoppi, N. Chiarelli, V. Cinquina, M. Ritelli, and M. Colombi, GLUT10 deficiency leads to oxidative stress and non-canonical αvβ3 integrin-mediated TGFβ signalling associated with extracellular matrix disarray in arterial tortuosity syndrome skin fibroblasts, Hum. Mol. Genet. 2015, 24, 6769-6787. 5. Y. Li, Z. Li, D. Hu, S. Wang, M. Zha, S.-B. Lu, Z. Sheng, and K. Li, Targeted NIR-II emissive nanoprobes for tumor detection in mice and rabbits, Chem. Commun. 2021, 57, 6420-6423.
このアプリケーションノートに関連する製品
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
このページはお住まいの地域ではご覧いただくことはできません。
