イメージングベースのワークフローを用いた3次元がんスフェロイドの定量評価
ヒトや実験動物などの生物個体を用いた医薬品評価では、測定値が年齢や生育環境などのさまざまな因子の影響を受けるため、多検体による統計的なデータ分析に困難が生じます。
オルガノイドやスフェロイドに代表される3次元細胞モデルは生体に近い細胞モデルであり、in vitroにおいて大量培養可能であることから、再現性が高く統計的なデータ分析により適していると考えられます。3次元細胞モデルは空間的にheterogeneousな細胞が構造体を形成するという特徴から、イメージングベースのセルベースアッセイが医薬品評価の最適な選択肢です。
薬効評価を目的とした3次元細胞モデルによるセルベースアッセイを以下の3つのプロセスに分解しました(図1)
- 3次元細胞モデルの準備(前培養~薬剤処理)
- 細胞画像の取得
- 統計解析
本アプリノートでは、3次元細胞モデルの1つであるがんスフェロイドに対する化合物の細胞レベルでの障害を定量評価するアッセイを例にとり、各プロセスを効率よく実施するためのイメージングベースのワークフローソリューションをご紹介します。
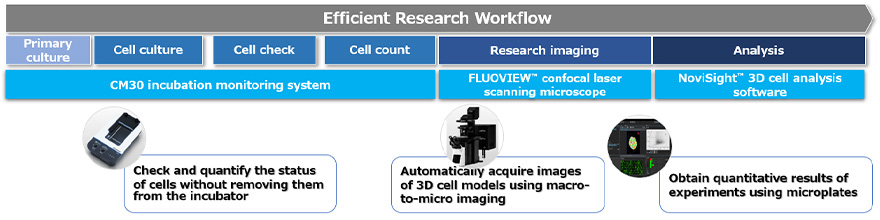
図1.エビデントが提供するワークフローソリューション
1.3次元細胞モデルの準備(前培養)
半球型の低接着細胞培養容器中でがん細胞を培養することで、がんスフェロイドが形成されることが知られています。がんスフェロイドは生体に近い微小環境を再現すると考えられており、抗がん剤のスクリーニングアッセイにおいて使用されています 1)。
薬効評価を行うために、一定のサイズ以上のがんスフェロイドをマルチウェルプレート内の複数のウェルに準備することを試み、その手段としてインキュベーションモニタリングシステムCM30を活用しました。CM30はインキュベーター内に静置した細胞の状態を、インキュベータから取り出すことなく長期間にわたりモニターすることが可能な装置です。以下にCM30を用いたがんスフェロイドの準備のプロセスをご紹介します。
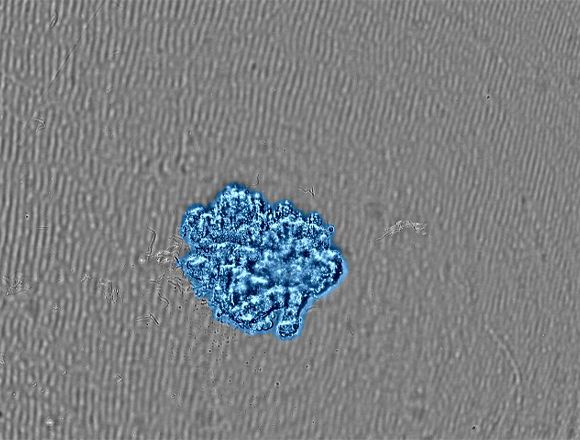
乳がん由来のMCF-7細胞をU型の96ウェル低接着容器に2000細胞/ウェルの密度で播種し、播種直後のマイクロプレートをCO2インキュベータ内に設置したCM30にセットします。CM30を用いることで、分散していたMCF-7細胞がスフェロイドを形成し、そのサイズが時間の経過と供に増加している様子をモニターする事ができました(図2)。
Related Videos図2(a)スフェロイド形成の経時観察画像 |
(b) 目標サイズに成長したスフェロイドの画像。コンフルエンシーマスクは検出された細胞を青色で示す。 |
CM30ではコンフルエンシー計測機能を応用し、スフェロイド領域を自動認識することが可能です。コンフルエンシー計測機能では、撮影した画像中に存在する細胞の占有領域を比率(Confluency)として算出し(図3グラフ)、画像の面積からがんスフェロイドの断面積を定量できます。また、任意のConfluencyをBorderとして設定すると、Borderを超えた際にアラートが発生します。MCF-7スフェロイド領域の7日間の変化を図3に示しました。
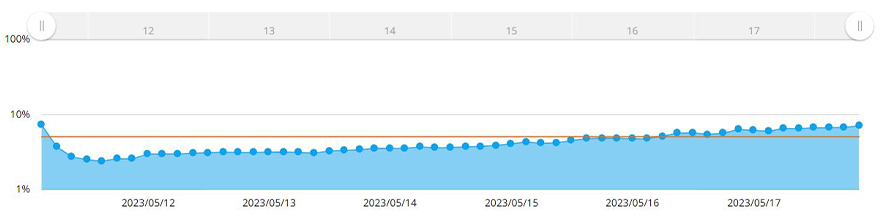
図3.スフェロイドのサイズ変化のグラフ
黄色い線は、設定したBorderを示します。取得した画像の面積に対してConfluencyが5%に達すると、スフェロイドの直径が600μmを超えたと判断できます。直径600μmを超えたMCF-7スフェロイドに対して、抗がん剤処理し、次の画像取得のステップに移ります。図4(A)に示すように、既定のサイズを超えたがんスフェロイドが存在した際にアラート発生を確認することができました。
アラート機能の効果を確認するために、アラート発生から1日後の12ウェルのスフェロイドサイズを計測したところ、全てのウェルで直径600μm以上のがんスフェロイドを得られたことがわかりました。
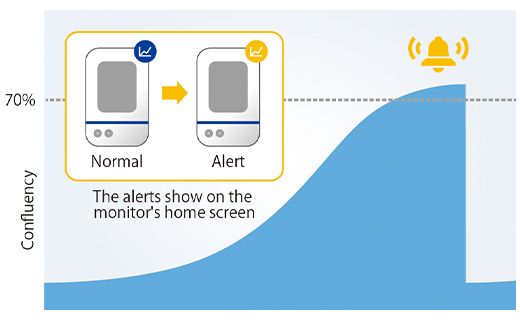 | 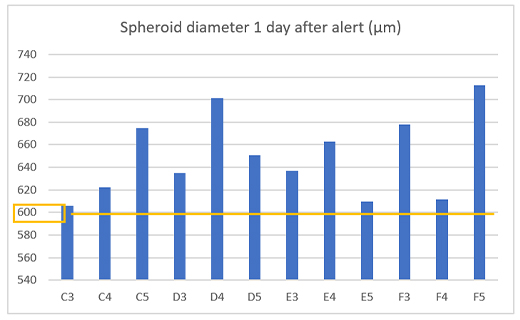 |
図4.アラートの発生と調製済のスフェロイドサイズ
(a)アラート発生イメージ (b)調製したスフェロイドの直径(n= 12)
CM30を用いたスフェロイド調製では、インキュベータからの容器の出し入れをすることなく、増殖状態をモニターすることができます。また、解析ソフトウェアを用いてスフェロイドサイズを定量し、期待していたサイズを超えたことをアラートで把握することも可能です。従来のワークフローで課題となっていた培養空間での増殖確認の手間を省き、実験室から離れた場所でいつでも増殖状態を確認することができるようになり、研究者が培養に伴う時間的・空間的な制約からの解放されることになります。
一定サイズを超えたがんスフェロイドに対して抗がん剤を処理して、24時間後に全てのウェルにHoechst 33342、PI、Calcein-AMを添加しました。Hoechst
33342、PI、Calcein-AMは、それぞれスフェロイド中の全細胞の細胞核、死細胞の細胞核、生細胞を染色することができます。次のステップでは染色後のがんスフェロイドの画像データを取得しました。
2. 細胞画像の取得
厚みのあるがんスフェロイドの1細胞レベルでの高解像画像を取得するために、共焦点顕微鏡FV3000を使用しました。FV3000のMacro-micro imagingモジュールを用いることで煩雑なサンプル探索の時間を節約し、効率よく画像取得することが可能になります。
図5はMacro-micro imagingモジュールによる自動画像取得の模式図です。U型のウェル容器内において浮遊するがんスフェロイドは、ウェルごとにさまざまな位置に存在します。Macro-micro imagingモジュールでは、最初に低倍率でウェル全体を撮像することで、目的とするスフェロイドの位置を記録します。その後、スフェロイドの領域のみを高倍率で自動取得することが可能になります。
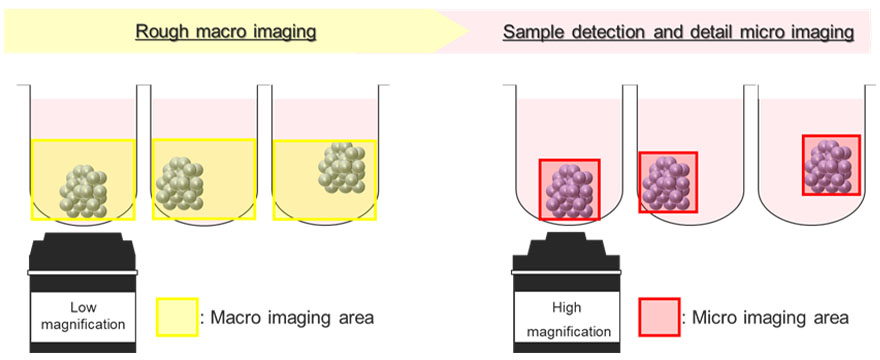
図5. FV3000 Macro-micro imagingモジュールの模式図
濃度を変えて抗がん剤を処理したがんスフェロイド群と、抗がん剤未処理のがんスフェロイド群の、計60ウェルのがんスフェロイドの連続Z断面画像を取得しました。
図6に示すように、がんスフェロイド中の各細胞の高解像度画像を取得できました。Cisplatin処理群ではPI陽性の細胞が数多く存在しており、抗がん剤の影響が強く出ている事を示唆するデータが得られました。Macro-micro
imagingモジュールでは、自動探索したがんスフェロイドの存在空間のみを撮像しており、取得画像のファイルサイズを減らすことができます。本モジュールを使用することで、システムメモリへの負荷を低減できるという点もメリットとして挙げられます。

図6. Macro-micro imagingモジュールで自動撮像した細胞生死判定用画像
3. 統計解析
スフェロイド中の各細胞の生死判定は、3次元細胞解析ソフトウェアNoviSightを使用し、複数のウェルから得られた連続Z断面画像を解析することによって行います。全ての細胞核の認識には、Hoechst 33342由来の蛍光シグナルを利用しました。図7に示すように、Calcein-AM由来の蛍光シグナル強度が低く、PI由来のシグナルが高い細胞を死細胞、逆にCalcein-AMが高く、PIが低い物を生細胞と定義づけ、全ての細胞を死細胞と生細胞に分類します。NoviSightを用いる事で、自動認識した大量の細胞を蛍光シグナルの強度で分類することが可能です。また、分類の妥当性はギャラリー機能で容易に確認できます。
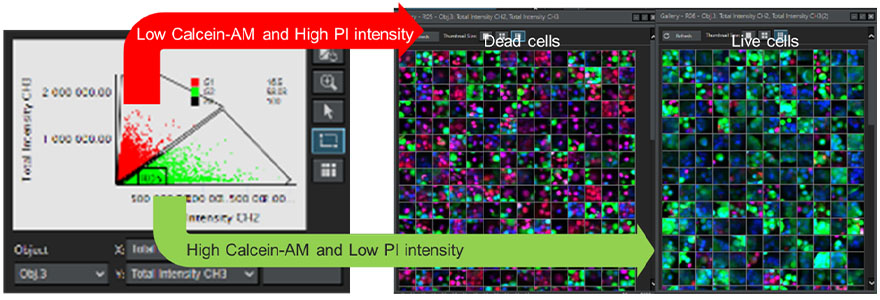
図7. NoviSightのよる全細胞の生死判定
左:各細胞のCalcein-AMチャネルとPIチャネルの蛍光シグナル強度をプロットしたグラフ。右:死細胞と生細胞のギャラリー画像
抗がん剤で処理した際のスフェロイド中の生細胞の割合を算出しました。図8に示すように、Paclitaxelと5-FUの濃度を変えて添加した場合には、コントロールと比較して生細胞の比率に大きな変化は見られません。一方で、Cisplatinの添加では添加濃度の増加に伴う生細胞の比率の減少を確認することができます。NoviSightを用いることで、3次元細胞モデルに対するイメージングベースのセルベースアッセイが容易となり、複数の医薬品候補の効果を同時に評価することが可能です。
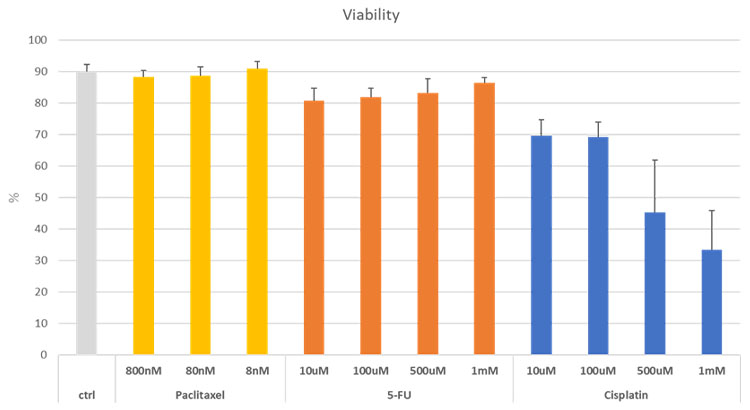
図8. 抗がん剤添加に対するがんスフェロイド中の生細胞の比率の変化
考察
オルガノイドやスフェロイドに代表される3次元細胞モデルは、構成要素である個々の細胞の振る舞いが、モデル全体の機能を特徴づけています。本検討では、がんスフェロイドに対する抗がん剤の効果を細胞レベルで把握するために、検討の各プロセスに対するイメージングベースのソリューションの有用性を確認しました。
がんスフェロイドは、手間のかかる細胞培養のプロセスを経て調製されます。抗がん剤の効果を定量的に確認するためには、複数のスフェロイドが均質な条件(本検討ではスフェロイドサイズを採用)を持つ必要があります。CM30では、マルチウェルプレートの複数のウェルに播種した細胞がスフェロイドの形状をとり、所定のサイズまで増殖する様子をインキュベーターから細胞を出し入れする事なく、モニタリングすることができます。また、アラート機能を利用することで、適切なタイミングで抗がん剤の処理などの次のステップに移行することが可能となります。
がんスフェロイドの抗がん剤に対する応答を細胞レベルで観察するには、共焦点顕微鏡は適切な選択肢です。U底のウェルで培養されたがんスフェロイドは、ウェルの中心付近に存在すると考えられますが、実際には中心から僅かにズレた場所に位置することも多くあります。複数のウェルでがんスフェロイドの存在領域のみを自動撮像するためには、これまでウェル全体の撮像を行うような時間や保存データなどの負荷が大きい方法が採用されてきました。FV3000のMacro-micro imagingモジュールは、低倍率での撮像位置調整と高倍での細胞レベルでの画像取得を自動に行うことができ、撮像にかかる負荷を大幅に低減することができました。
FV3000で取得した画像は、シームレスに3次元細胞解析ソフトウェアNoviSightで解析することが可能です。細胞レベルでの生死判定のシグナルを統計処理し、添加した薬剤が用量依存的に死細胞の数を増加させることを示しました。NoviSightはシグナルの強度や細胞の位置情報などの解析パラメータと組み合わせ、より高次の解析などを行うことができます。従来の2次元培養では再現できない、heterogeneousな細胞ごとの振る舞いを解析することで、より生体に近い環境での医薬品評価を実現する事が期待されます。
エビデントが提供するワークフローソリューションは、3次元細胞モデルの解析を行う上でユーザーが困難に感じるプロセス、煩雑に感じるプロセスを自動化、短縮化、省力化する事が可能です。各ソリューションの組み合わせにより、ユーザーの研究の成功に貢献します。
共焦点イメージングと画像解析に関してはこちらもご参照下さい。
参考文献
1)Elena M. Tosca et al., Replacement, Reduction, and Refinement of Animal Experiments in Anticancer Drug Development: The Contribution of 3D In Vitro Cancer Models in the Drug Efficacy Assessment. Biomedicines 2023, 11, 1058.
著者
合田 和史、林 太朗 R&D、株式会社エビデント
このアプリケーションノートに関連する製品
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
このページはお住まいの地域ではご覧いただくことはできません。