「TruAI」ディープラーニングを活用した高効率・高精度な画像解析
顕微鏡を用いた実験では、画像を取得するだけでなく、その画像をベースに解析を行うことも非常に重要です。正確な画像解析のためには、画像から解析対象領域を抽出するセグメンテーションが欠かせず、それには画像の輝度や色味にしきい値を適用する方法が主流となっています。しかしながら観察対象や撮影条件によっては、染色具合を含むサンプルの状態や、光学的不均質性、各種ノイズなどの要因により十分に正確なセグメンテーションができない場合があります。イメージングソフトウェアcellSensに搭載されるTruAIは、ディープラーニングを活用することでこれらの要因による影響を抑え、正確な解析をサポートします。ディープラーニングとはAI(Artificial Intelligence)のうちの一つで、人間の脳を模したニューラルネットワークと呼ばれる構造を学習させ情報処理を行います。TruAIは、以下に示すようなさまざまな画像に対応するニューラルネットワークを構築し、サンプルへのダメージを軽減、および画像解析の精度向上・効率化に貢献します。
TruAIを使用したアプリケーション例
1) 非染色画像を用いた核検出およびセグメンテーション
細胞数カウント、細胞・組織内の核の位置や面積の評価には、核を蛍光染色し、その蛍光輝度情報からセグメンテーションする方法が一般的です。一方TruAIでは、透過画像と蛍光画像による核のセグメンテーション結果を用いてニューラルネットワークを学習させることにより、透過画像のみから核のセグメンテーションを行うことが可能となります。このアプローチでは、一度ニューラルネットワークを作成した後は、核を蛍光染色する必要がなくなるため、以下のような利点が挙げられます。
- 核の染色に費やしていた手間と時間を削減
- 染色そのものによる細胞への影響を除外
- UV励起が不要のため、光毒性を低減
- 核に使われていた蛍光チャンネルを他の色素に活用することによる取得情報の追加
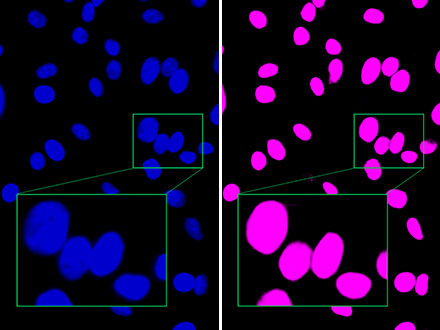
 TruAIを用いた核検出 図1 左:明視野画像 右:TruAIで明視野画像から検出した核(ピンク) |
図2 左:蛍光画像 右:TruAIで明視野画像から検出した核(ピンク) |
図1:非染色の細胞のためほとんどコントラストがついていない明視野画像からでも、高精度で核を検出できていることを示す。
図2:蛍光画像と比べても、TruAIのほうが近くに存在する核をはっきりと分離して識別しており、高精度で検出できていることを示す。
2) 微弱励起光観察による高精度なセグメンテーション
前述のとおり、蛍光染色は現在の生細胞の顕微鏡観察において有用な手段ですが、励起光により細胞へダメージを与えたり、蛍光褪色でのS/N比低下によって検出精度に影響を及ぼす懸念があります。目に見える変化がなくても、強い励起光の露光は細胞本来の活性を損なう可能性があります。そのため、特に長期間での生細胞観察においては、最小限の励起光で蛍光観察を行うことが求められます。しかし、微弱な励起光では観察画像のS/N比が著しく低下するため、解析精度も低くなります。一方TruAIでは、微弱な励起光によるS/N比の低い画像でも高い精度で解析することができます。
図3 |
図4 |
図5 |
図3:十分な輝度の蛍光画像(左)から、従来の輝度にしきい値を適用する方法で核を検出した結果(右)。
図4:微弱励起光によってS/Nが著しく低い蛍光画像(左)から図3と同じ方法で核を検出した結果(右)。検出精度が低いことを示す。
図5:微弱励起光によってS/Nが著しく低い蛍光画像(左)からTruAIで核を検出した結果(右)。図3と同様、図4よりも高い精度で検出されていることを示す。
3) 形態的特徴に基づいたセグメンテーション
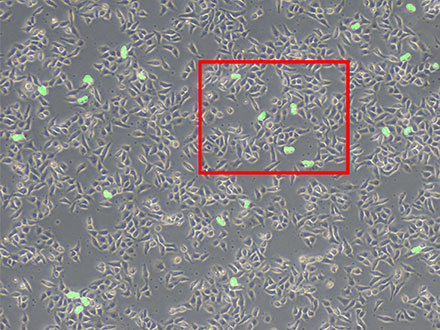
形態的な特徴から画像をセグメンテーションしたい場合、輝度や色味にしきい値を適用する従来のアプローチでは、高い精度のセグメンテーションを行うのは非常に困難です。そのため、ハンドラベリングなどを用いて、都度マニュアルでカウントや計測をする必要がありました。TruAIは、このハンドラベリングによるセグメンテーション結果も学習させることが可能です。学習後はハンドラベリングをしなくても自動でセグメンテーションできるようになるため、高精度かつ高効率な解析が可能になります。たとえば下図のようにハンドラベリングによって学習したニューラルネットワークを用い、分裂中の細胞をカウントすることができます。
図6: 位相差画像から分裂中の細胞をTruAIで推論した結果(緑) |  図6赤枠部分の拡大 図7: 多くの細胞の中から分裂中の細胞のみを検出 |
4) 組織標本のセグメンテーション
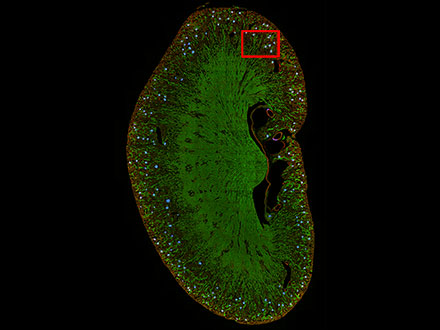
TruAIは、細胞だけでなく組織標本のセグメンテーションにも活用できます。例えば腎臓の糸球体のように、目視などのマニュアルな方法以外では判別が困難なものも、ニューラルネットワークを学習させればセグメンテーションが可能です。また、組織全体がイメージングされた広範囲の貼り合わせ画像にも活用できます。
図8: マウスの腎臓切片画像から糸球体の位置をTruAIで推論した結果(青) |  図8赤枠部分の拡大 図9: TruAIが糸球体の特徴を捉えて検出 |
このアプリケーションノートに関連する製品
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
このページはお住まいの地域ではご覧いただくことはできません。