薬剤の性能評価を自動化:スフェロイド作製から3次元解析まで
要約
大量の三次元サンプルを作製・解析するのは非常に労力がかかります。YAMAHA CELL HANDLER™とFLUOVIEW FV3000共焦点レーザー走査型顕微鏡、NoviSight™3次元細胞解析ソフトウェアを組み合わせると、サンプル作製から三次元解析までほぼ自動で行うことができます。これにより、大量の三次元細胞モデルを用いたアッセイを安定して実施できます。
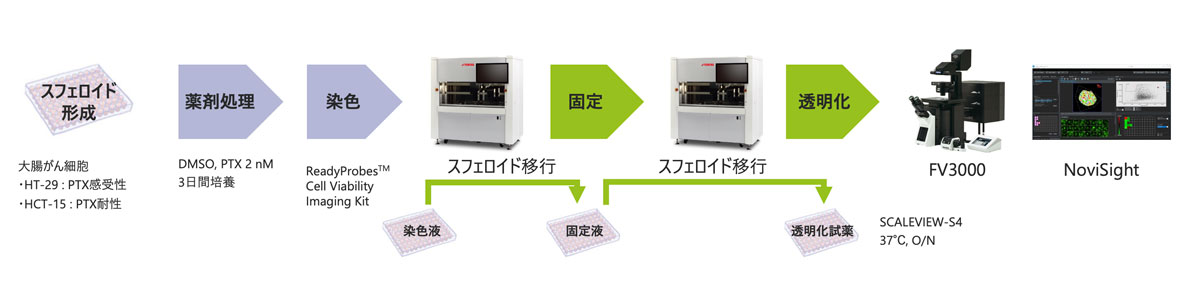
図1.ワークフローの自動化
はじめに
3次元がんスフェロイドを使用して薬剤の性能を評価することは重要です。なぜなら、スフェロイドはがんの複雑な生体内微小環境を再現しているからです。これにより、研究者は腫瘍の本来の環境により近い条件のもとで、薬剤の有効性を評価することができます。
しかし、多数のサンプルを作製・染色・画像取得・3次元解析には多大な時間がかかります。このワークフローを簡便にするため、我々は、YAMAHA CELL HANDLER™によるスフェロイド作製・固定・染色の自動化、FV3000とNoviSight™による画像取得・3次元解析の自動化を行いました。
利点
- CELL HANDLER™を用いることで、細胞の損傷やサンプルの紛失なく、サンプル作製を行うことができます。また、サンプル移動の前後にスフェロイドの画像を撮影し、各種パラメーターを解析するため、完全なトレーサビリティーを確保できます。
- 大量に作成したサンプルをFV3000とNoviSightで簡単に三次元解析できます。スフェロイドの内部と外部での薬剤の影響の違いなどを定量化できます。
方法
サンプル作製
超低接着U底プレートに直径100umのスフェロイド(HT-29, HCT-15)を作製し、パクリタキセル(PTX) 2 nMまたはDMSOを添加しました。3日間の培養後、スフェロイドをReadyProbes™ Cell Viability Imaging Kitで染色し、固定液の入ったプレートに移し4℃ で一晩処理しました。その後、SCALEVIEW-S4に移し、37℃で一晩処理しました。サンプルの移動はすべてYAMAHA CELL HANDLER™で実施しました。
撮像と解析
FLUOVIEW®共焦点走査型レーザー顕微鏡FV3000を使用して、プレート上のスフェロイドの蛍光画像を取得しました。大量の画像を3次元細胞解析ソフトウェアNoviSightに取り込み、3次元解析を実施しました。三次元画像中の生細胞と死細胞を認識し、ウェルごとの生存率を算出しました。
結果
YAMAHA CELL HANDLER™における撮像と解析
YAMAHA CELL HANDLERではサンプル移動前後で画像と形状データを取得できます。画像から、ほとんどのスフェロイドがサンプルの損失なく、正常に移行されたことが確認できます(図2)。
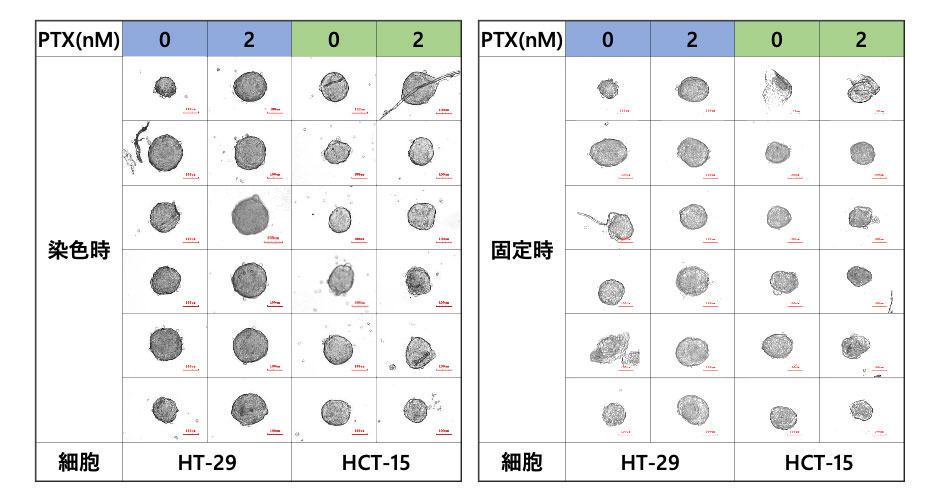
図2.染色時と固定時のスフェロイドの様子
また、PTXで処理したスフェロイドとPTXで処理していないスフェロイドの間で、面積に差は見られませんでした。一方で、蛍光シグナルはPTXがHT-29の生細胞数を大きく減少させることを示し、HCT-15のスフェロイドでは生細胞の減少が見られませんでした(図2)。
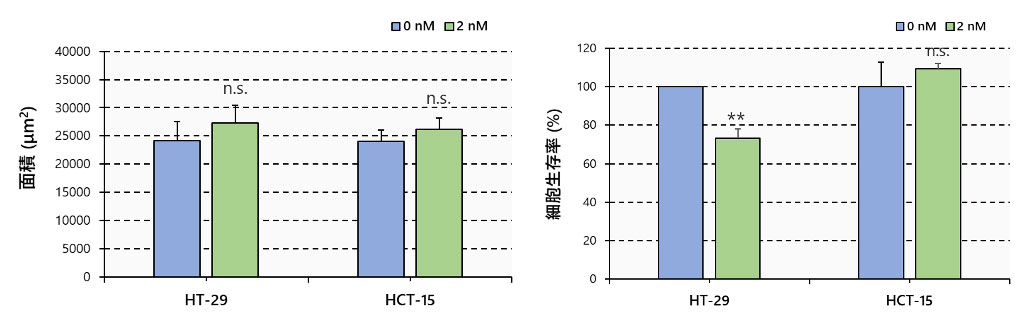
図3.固定時のスフェロイドの面積と細胞生存率
N=6, **: p < 0.01, Error bars: SE
FV3000とNoviSightによる三次元画像の撮像と解析
スフェロイドの微小環境に対するPTXの影響を解析するために、スフェロイドをFV3000で観察しました(図3)。
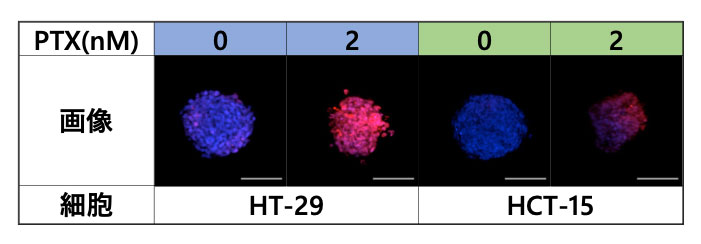
図4.共焦点顕微鏡FV3000による撮像結果
青:核(全細胞)、赤:核(死細胞)
その後、複数の3次元画像をNoviSightソフトウェアで読み込み、3次元解析を実施しました。PTXはHT-29スフェロイドの生細胞を大きく減少させ、スフェロイドの中心から内側まで大きく影響を及ぼしていました。一方で、HCT-15スフェロイドでは影響は小さいことが分かります(図5)。
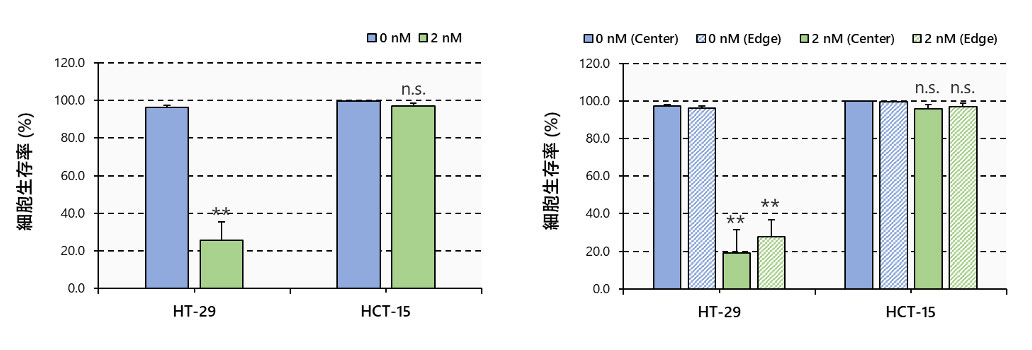
図5.3次元解析による細胞生存率
N=3~6, **: p < 0.01, Error bars: SE
結論
YAMAHA CELL HANDLER™により、大量のサンプルを簡単に用意できます。そのサンプルをFV3000、NoviSightを用いることで簡単に三次元解析できます。ワークフローの中で、高いトレーサビリティーを確保することで、三次元細胞解析の精度を向上できます。
著者
Hiroya Ishihara, Biological Engineering, Research and Development, EVIDENT
このアプリケーションノートに関連する製品
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
このページはお住まいの地域ではご覧いただくことはできません。