Utilisation de la méthode de sectionnement optique SILA pour une imagerie parfaitement nette des échantillons épais
Étant donné leur format compact et leur grande plage d’utilisation, les scanners de lames sont de plus en plus utilisés par les chercheurs. Une de leurs applications les plus puissantes est la détection de la fluorescence dans les échantillons épais lorsqu’ils sont couplés à la microscopie de fluorescence à grand champ. Pour les applications avec des échantillons épais, la technique SILA, une technique d’acquisition avec un éclairage par des motifs lumineux aléatoires, ou « tavelures », constitue une solution d’imagerie particulièrement efficace. Associée à notre scanner de lames pour la recherche SLIDEVIEW™ VS200, la technique d’imagerie SILA permet un sectionnement optique rapide pour la production d’images numériques de lames d’histologie. Cette méthode permet d’éliminer la lumière hors plan focal des échantillons épais et d’améliorer ainsi grandement le contraste.
Limites de la microscopie de fluorescence à champ large
La microscopie à grand champ est une technique d’imagerie dans laquelle une surface relativement importante d’un échantillon est éclairée avec de la lumière d’une longueur d’onde (d’excitation) spécifique. Des molécules couplées à des fluorophores sont utilisées pour marquer des structures spécifiques de l’échantillon en s’y liant. Ces fluorophores absorbent la longueur d’onde d’excitation puis émettent de la lumière d’une longueur d’onde plus longue qui est détectée par la caméra.
Les signaux captés par la caméra sont émis par tous les fluorophores atteints par la lumière d’excitation dans tout le volume de l’échantillon, là où la puissance de la lumière d’excitation est suffisamment importante. Par conséquent, les structures fines marquées par fluorescence présentes dans le plan focal sont brouillées par la lumière émise en dehors du plan focal. Pour résoudre ce problème, il suffit d’utiliser des méthodes de sectionnement optique qui permettent d’acquérir des images nettes.
Présentation de la technologie SPARQ pour un sectionnement optique rapide
L’imagerie SILA utilise la technologie SPARQ (mise au point par Bliq Photonics) qui associe un algorithme HiLo1 à un brouilleur de tavelures pour produire un sectionnement optique rapide. Elle permet d’éliminer des images à grand champ la lumière émise en dehors du plan focal, ce qui permet d’atteindre des performances similaires à celles obtenues en microscopie confocale. 1-3
Cette technologie implique l’acquisition de deux images de l’échantillon : une image avec un éclairage uniforme et une image avec un éclairage spatialement structuré de l’échantillon par des tavelures de lumière laser stochastiques. Une fois les deux images acquises, celles-ci sont combinées informatiquement afin de produire une image nette. Le passage d’une condition d’imagerie à l’autre est réalisé au moyen d’un brouilleur de tavelures, comme illustré dans la figure 1.

Figure 1 – Acquisition d’une image SILA
1. Éclairage uniforme
L’image prise avec un éclairage uniforme contient à la fois des signaux émis par des objets se trouvant dans le plan focal et par des objets en dehors du plan focal. Le contenu hors du plan focal apparaît flou et renferme, par conséquent, uniquement des composants à faible fréquence spatiale. L’application d’un simple filtre passe-haut sur l’image acquise avec un éclairage uniforme permettrait d’éliminer le contenu hors du plan focal et d’obtenir une image nette des éléments à haute fréquence. Cependant, cela aurait également pour conséquence de supprimer les éléments à faible fréquence spatiale présents dans le plan focal.
Pour récupérer le contenu à faible fréquence de l’échantillon au niveau du plan focal, il est nécessaire d’acquérir et de traiter une image prise avec un éclairage structuré (produit par des tavelures). De cette manière, il est possible de récupérer les signaux à faible fréquence et de ne distinguer que les signaux provenant du plan d’intérêt.
2. Éclairage en tavelures
Les tavelures sont des fluctuations aléatoires créées par la diffusion et la réflexion diffuse de la lumière passant à travers des irrégularités du milieu traversé caractéristiques des sources de lumière cohérente comme les lasers. Les interférences issues de ces phénomènes de réflexion ou de diffusion de la lumière créent les motifs stochastiques granulaires projetés sur l’échantillon.4
L’éclairage en tavelures applique à l’échantillon une modulation spatiale à haute fréquence. Une des caractéristiques importantes de ce type d’éclairage repose sur le fait que le contraste de modulation se limite au plan focal du système de microscopie. Par conséquent, la mesure du contraste local de la modulation de l’image permet de déterminer à quel point l’objet se trouve dans le plan focal ou contient des contributions dans le plan focal.
3. Combinaison des deux images
Au moyen d’un filtre passe-haut, les hautes fréquences du plan focal sont extraites de l’image prise avec un éclairage uniforme. À partir de l’image avec un éclairage en tavelures, on détermine à quel point l’objet se trouve dans le plan focal ou contient des contributions dans le plan focal par mesure du contraste local. Par l’application d’un filtre passe-bas sur l’image sur laquelle le contraste local a été mesuré, on obtient les signaux à faible fréquence du plan focal.
De ce fait, en ajustant correctement les filtres passe-haut et passe-bas, le contenu à faible fréquence du plan focal obtenu à partir de l’image prise avec un éclairage en tavelures permet de compléter le contenu à haute fréquence du plan focal obtenu à partir de l’image prise avec un éclairage uniforme. La fusion des contenus à haute fréquence et à faible fréquence des deux images permet d’obtenir une image nette à haute résolution qui contient tous les composants de toutes les fréquences comprises dans la largeur de bande de fréquences du système d’imagerie (figure 2).1-3

Figure 2 – Schéma du traitement SILA
Il est intéressant de noter qu’il est également possible d’ajuster le degré de sectionnement optique en changeant simplement le réglage d’un paramètre appelé « épaisseur de sectionnement » ou ST. L’augmentation de l’épaisseur de sectionnement est comparable à l’augmentation de la taille du sténopé d’un microscope confocal.
L’augmentation de l’épaisseur de sectionnement permet des contributions à partir d’une plus large plage de contraste de l’image prise avec un éclairage en tavelures (c.-à-d., un plus grand volume de signaux) pendant le traitement des images SILA. L’intensité globale augmente et le rapport signal/bruit (RSB) change en conséquence. Cependant, comme pour l’analogie du sténopé pour laquelle le gain de signal est dû à la collecte en dehors du plan focal, l’augmentation de l’épaisseur de sectionnement conduit à une image SILA comprenant moins de coupes optiques.
Exemple d’un résultat expérimental obtenu avec la méthode de sectionnement optique SILA
Une coupe de 16 µm d’un rein de souris réalisée au cryostat (lame n° 3 préparée FluoCells, F24630) a été éclairée dans des conditions d’imagerie SILA et d’imagerie à grand champ. L’épaisseur de sectionnement a été réglée sur 2 (scanner VS200, objectif UPLSAPO40XS, ON 1,25, DF 300 µm, caméra Hamamatsu ORCA-Fusion). À la vue de l’épaisseur de l’échantillon, cette épaisseur a été considérée comme étant optimale pour l’éclairage. Une épaisseur de sectionnement trop petite peut provoquer une granularité au niveau de l’image SILA générée du fait de la nature stochastique intrinsèque des tavelures.5
La longueur d’onde d’excitation utilisée pour l’acquisition était de 488 nm. Un miroir dichroïque multibande (pour DAPI, FITC, Cy3 et Cy5) et un filtre d’émission unique pour l’isothiocyanate de fluorescéine (FITC) ont été utilisés. Le temps d’exposition de la caméra était réglé sur 60 ms. La figure 3a montre l’image acquise par imagerie à grand champ tandis que la figure 3b montre l’image de la même région acquise au même plan Z par imagerie SILA avec une épaisseur de sectionnement réglée sur 2. On peut constater une amélioration du contraste sur l’entièreté de l’échantillon. En s’attardant sur les zones 1 à 4, on peut voir que les images acquises avec la méthode SILA révèlent plus de détails que celles acquises avec la méthode d’imagerie à grand champ.
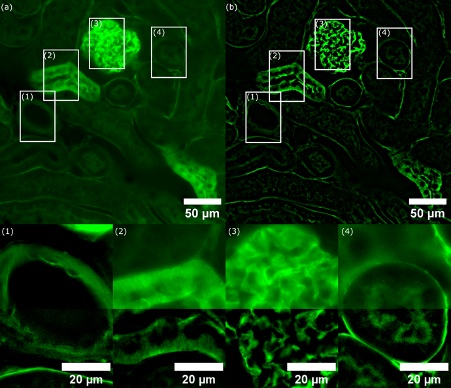
Figure 3 – (a) Image à champ large d’un rein de souris marqué avec de l’agglutinine de germe de blé couplée à l’Alexa Fluor 488 (W-11261). Les rectangles blancs indiquent les quatre régions d’intérêt (ROI 1 à 4) correspondant aux structures comparées. (b) Image sectionnée optiquement (SILA) avec une épaisseur de sectionnement de 2 correspondant à 6,803 µm. Encarts représentant des gros plans des ROI (1 à 4) avec fusion des canaux d’imagerie à grand champ et d’imagerie SILA (moitié supérieure : grand champ, moitié inférieure : SILA). Nous pouvons voir que le contraste de l’image en imagerie SILA est bien meilleur. En comparaison, certaines structures sur l’image à grand champ sont à peine visibles. Notez que les ROI détaillées présentent des échelles d’intensité différentes afin de montrer les détails des structures résolus.
Conception optique du système d’imagerie SILA
Nous avons intégré le dispositif de sectionnement optique SILA à un scanner de lames à grand champ (notre système VS200) en remplaçant la source de lumière pour fluorescence montée de série par une source de lumière cohérente produite par des diodes laser couplées à une fibre monomodale. La source laser couplée à une fibre monomodale projette la lumière à travers le module de brouillage de tavelures, qui génère des tavelures sur le même plan pour l’éclairage structuré et élimine les tavelures pour l’éclairage uniforme. En contrôlant précisément l’éclairage laser et le module de brouillage, toutes les images SILA sont calculées et assemblées pour former l’image sectionnée optiquement de la lame entière.

Figure 4 – Schéma du système SILA comprenant une source de lumière cohérente, un module de brouillage de tavelures
pour la génération d’un éclairage uniforme ou d’un éclairage en tavelures, un trajet optique doté d’un objectif permettant
d’amener la lumière jusqu’à l’échantillon et de capter la lumière émise et, enfin, une caméra comme détecteur de lumière.
Mesures de la qualité
1. Durée du balayage
La durée de balayage de l’imagerie SILA a été testée sur de petites surfaces de 5 × 5 mm. Même si nous avons acquis une paire d’images pour chaque champ d’observation de la caméra, la durée d’acquisition des images SILA n’est pas deux fois plus longue que celle des images à grand champ. Par exemple, avec un objectif à air de 40x, nous observons une augmentation de la durée d’acquisition de seulement 53 %. Des résultats supplémentaires se trouvent dans le tableau 1.
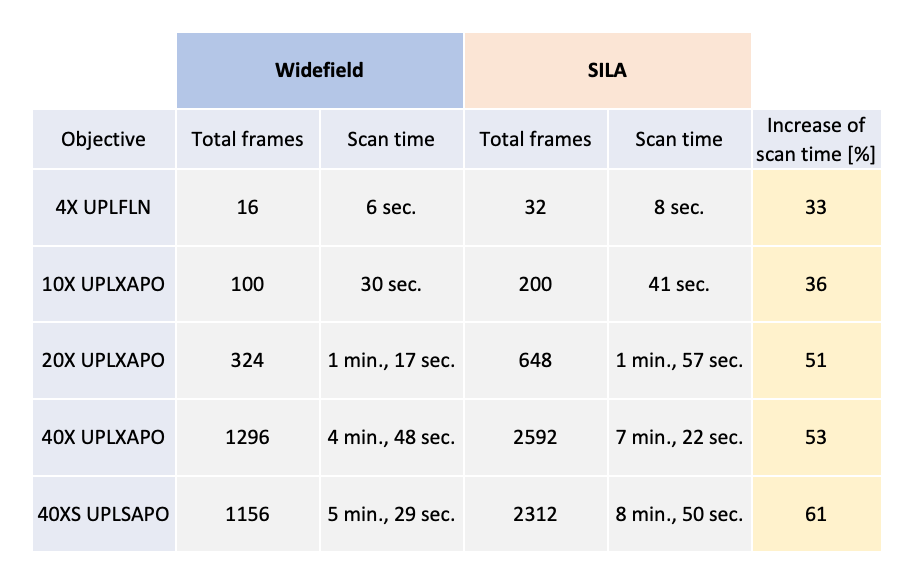
Tableau 1 – Durées du balayage pour l’acquisition d’images à grand champ et SILA au moyen d’une caméra ORCA-Fusion (Hamamatsu Photonics)
avec quatre canaux (DAPI, FITC, CY3 et CY5) et une durée d’exposition de 50 ms pour une surface de balayage de 5 × 5 mm.
L’augmentation de la durée du balayage est calculée pour chaque grossissement.
2. Résolution
La résolution optique des images SILA est identique à celle des images à grand champ. La résolution théorique des objectifs avec une grande ON a été simulée à 0,2 µm dans la direction latérale et 0,45 µm dans la direction axiale. Les valeurs expérimentales de la fonction d’étalement du point (PSF) ont été mesurées avec un objectif à immersion dans l’huile (UPLXAPO100XO, ON 1,45) sur un échantillon contenant des billes fluorescentes (microsphères TetraSpeck de 0,1 µm, avec une fluorescence bleue/verte/orange/rouge foncé) avec une longueur d’onde d’émission de 520 nm. La largeur à mi-hauteur (LMH) pour les images à grand champ est de 0,22 µm dans la direction latérale et de 0,47 µm dans la direction axiale. Nous avons confirmé que les valeurs théoriques calculées concordent avec les valeurs de la fonction d’étalement du point mesurées expérimentalement sur de très petites billes.
3. Capacité de sectionnement optique
La force de l’imagerie SILA réside dans sa capacité à réaliser un sectionnement optique. Dans les figures 5a à 5d, nous pouvons voir des images d’une sous-région du rein de souris de la figure 3 réalisées avec différentes épaisseurs de sectionnement (ST), avec les vues orthogonales correspondantes (figures 5e à 5h). Les images de l’ensemble de l’échantillon ont été acquises sous forme d’un empilement de 39 coupes Z avec un espacement de 0,34 µm entre les coupes. Dans la figure 5i, on voit une augmentation du contraste entre les structures et le fond à mesure que l’épaisseur de sectionnement baisse. Nous pouvons également identifier plus facilement les détails des structures.
Pour le démontrer, nous avons tracé le profil de l’intensité le long de l’axe X d’une coupe Z au même point pour chaque épaisseur de sectionnement et chaque image à grand champ. La comparaison des profils normalisés montre clairement à quel point les détails sont mieux visibles avec l’imagerie SILA qu’avec un système d’imagerie à grand champ traditionnel. Les pics d’intensité correspondant aux structures sont plus élevés que ceux correspondant au fond et deviennent plus étroits avec la réduction de l’épaisseur de sectionnement.
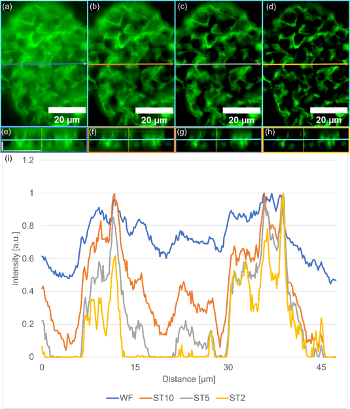
Figure 5 – Amélioration du sectionnement optique avec la méthode SILA par rapport à l’imagerie à grand champ. (a) Éclairage uniforme, (b) éclairage SILA avec ST10, (c) SILA avec ST5 et (d) SILA avec ST2. Chaque image comprend une flèche qui indique la position et la mesure du profil d’intensité pour le plan de la vue orthogonale dans la direction de l’axe X (e à h). Chaque image SILA avec différentes épaisseurs de sectionnement et chaque image à grand champ sont acquises sous forme d’empilements de coupes Z, y compris la vue orthogonale dans la direction de l’axe X. Dans les figures a à d, les lignes bleues indiquent le même plan Z. L’échelle graphique horizontale correspond à 20 µm, tandis que l’échelle graphique verticale correspond à 5 µm et s’applique à toutes les sous-figures. (i) Les profils d’intensité enregistrés sont indiqués sur les figures a et b ; imagerie à champ large en bleu, SILA avec ST10 en orange, SILA avec ST5 en gris et SILA avec ST2 en jaune. Tous les tracés sont normalisés à 1. Nous pouvons voir une amélioration du contraste avec la réduction de l’épaisseur de sectionnement (ST).
4. Profondeur de champ
La méthode de sectionnement optique SILA permet de réaliser l’imagerie d’échantillons d’une épaisseur de plusieurs centaines de microns. Lorsque les échantillons sont clarifiés, la profondeur de pénétration de l’imagerie SILA n’est limitée que par la distance frontale de l’objectif. Si les échantillons ne sont pas clarifiés, la lumière peut être dispersée par les structures de l’échantillon, ce qui l’empêche d’atteindre les couches cellulaires plus profondes.6
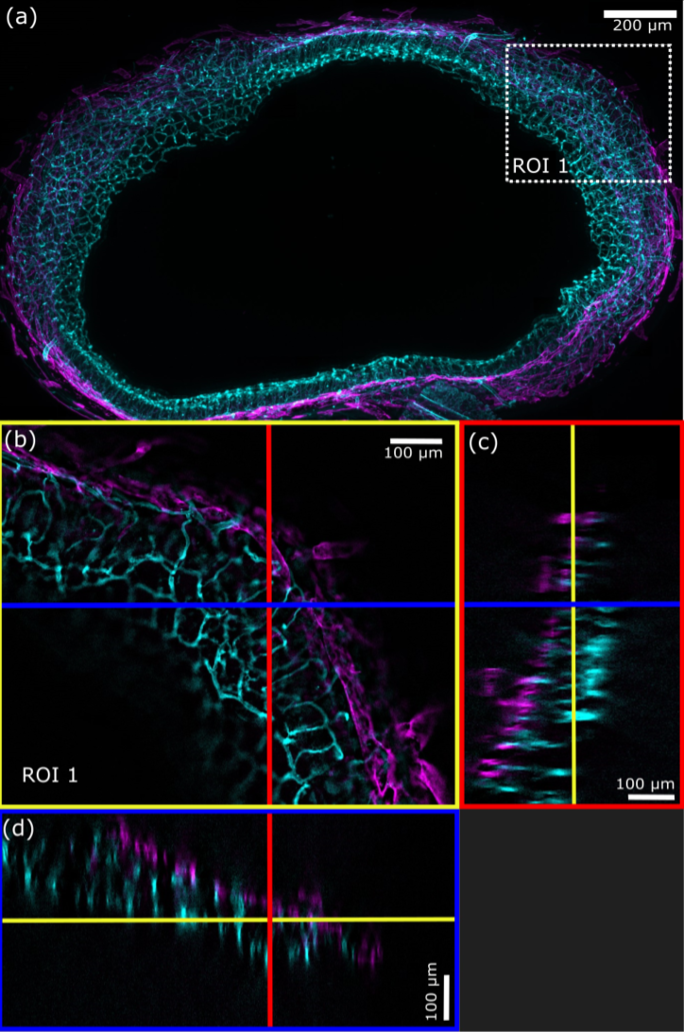
Figure 6 – a) Projection d’intensité maximale (MPI, 188 plans, espacement des coupes Z = 2,36 µm) d’une image SILA (ST = 2) d’un intestin de souris sur laquelle on peut voir les vaisseaux sanguins (cyan) et les vaisseaux lymphatiques (magenta). b) Gros plan de la région d’intérêt 1 délimitée par le carré blanc en pointillé sur la figure (a), avec la ligne bleue correspondant à la position de la vue orthogonale XZ et la ligne rouge correspondant à la position de la vue orthogonale YZ. c) Le rectangle bleu délimite la vue orthogonale dans la direction YZ. d) Le rectangle rouge délimite la vue orthogonale dans la direction XZ. Les lignes jaunes indiquent le plan Z représenté dans la figure (b). (Coupe d’intestin de souris de 450 µm FluoTissue, Sun Jin lab, traitée par RapiClear 1.52).
5. Répétabilité
Le traitement de l’image SILA permet le calcul d’une image avec un sectionnement optique à partir d’une image prise avec un éclairage uniforme et d’une image prises avec un éclairage en tavelures. Dans l’idéal, la structure des tavelures sera totalement éliminée et ne sera pas observable sur l’image SILA finale. Toutefois, cela n’est pas le cas. L’éclairage en tavelures implique de manière intrinsèque une légère variation de l’intensité du signal. Par exemple, une tavelure peut éclairer un détail d’un échantillon sur une image, mais pas sur une autre. Ce phénomène explique les variations de l’intensité résiduelle observées sur l’image finale. Par définition, cette variation est stochastique et constitue un des avantages de la technique (sectionnement optique et profondeur de pénétration) mais aussi une de ses limites (variation de l’intensité du signal).
Afin d’étudier la variation de l’intensité du signal, nous avons enregistré une séquence de 10 balayages (voir la figure 7) pour quatre épaisseurs de sectionnement différentes (voir la figure 8a). Pour chaque échantillon, le coefficient de variation (CV) a été calculé sur plus de 90 régions d’intérêt choisies de manière arbitraire et renfermant des structures pour quantifier la variation de l’intensité tout au long de la séquence de balayage :
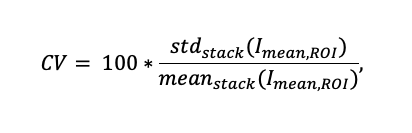
Dans la formule ci-dessus, Imean,ROI est l’intensité de fluorescence moyenne d’une région d’intérêt pour un seul balayage. stdstack et meanstack sont, respectivement, l’écart-type et la valeur moyenne de la Imean,ROI pour toute la séquence des dix balayages. La figure 7c illustre un exemple de 25 régions d’intérêt et de leurs profils d’intensité de fluorescence moyenne sur ces dix balayages.
Le coefficient de variation, calculé pour trois échantillons différents pour les zones contenant des structures, décroît en fonction de l’écart-type (figure 8b) ; lorsqu’une plus grande épaisseur sectionnement est appliquée, la puissance de la filtration spatiale sur l’image prise avec un éclairage en tavelures est plus faible, ce qui fait que les variations de l’intensité sur les images SILA sont plus faibles. Le coefficient de variation des images SILA mesuré sur trois structures différentes avec 90 régions d’intérêt détectées est en moyenne de 3,7 ± 1,4 %. Par comparaison, la variation de l’intensité du signal en mode d’imagerie à grand champ est d’environ 0,3 % et est inhérente au système.
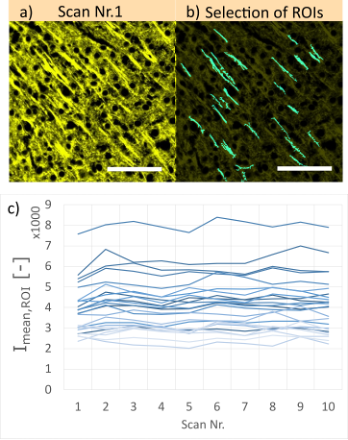
Figure 7 – a) Exemple d’une image d’un échantillon de cerveau de souris (marqué à la Cy3, épaisseur de 100 µm) acquise par imagerie SILA avec une épaisseur de sectionnement de 10 à un grossissement de 40x. Chaque zone a été balayée dix fois sur le même plan focal. b) Les structures (ROI) choisies pour nos mesures de l’intensité de fluorescence moyenne (Imean,ROI) sont représentées en cyan. Les échelles graphiques correspondent à 50 µm. c) Profils d’intensité moyenne des régions d’intérêt sélectionnées indiquées dans la figure b). Chaque ligne correspond à une région d’intérêt. Pour une meilleure interprétation, notez que seule une petite partie de l’image contenant les 25 régions d’intérêt est présentée.
Comparaison avec d’autres techniques de sectionnement optique
Dans les figures ci-dessous, nous comparons l’imagerie SILA à la microscopie à grand champ traditionnelle, aux algorithmes de défloutage, à la déconvolution et à la microscopie confocale à balayage laser. Comparativement à l’imagerie à grand champ traditionnelle utilisant un algorithme de défloutage, l’imagerie SILA permet d’améliorer sensiblement le sectionnement optique et le contraste. Par rapport à la déconvolution, la technologie SILA améliore la qualité de l’image. En outre, ses capacités de sectionnement optique à la volée réduisent la longue durée de traitement souvent associée à l’acquisition de grandes images de lames entières.
Enfin, la qualité d’image produite par la technologie SILA est remarquablement proche de celle de la microscopie confocale. Sans surprise, la microscopie à grand champ souffre de la présence de fluorescence de fond. Les techniques de microscopie confocale et SILA permettent toutes les deux de produire des images sectionnées optiquement qui présentent un meilleur contraste et révèlent des détails fins de l’organisation cellulaire, et ce, malgré la nature diffusante de l’échantillon. Des comparaisons plus poussées des deux techniques doivent être effectuées afin de comparer les détails des images et les variations spatiales de la distribution de l’intensité. Les performances de la technologie SILA sont néanmoins suffisantes pour l’évaluation de la qualité et les études de colocalisation. La méthode SILA agit comme un dispositif d’examen rapide permettant de trier de grandes quantités d’échantillons. Les échantillons avec des structures d’intérêt peuvent ensuite être analysés par imagerie quantitative au microscope confocal.
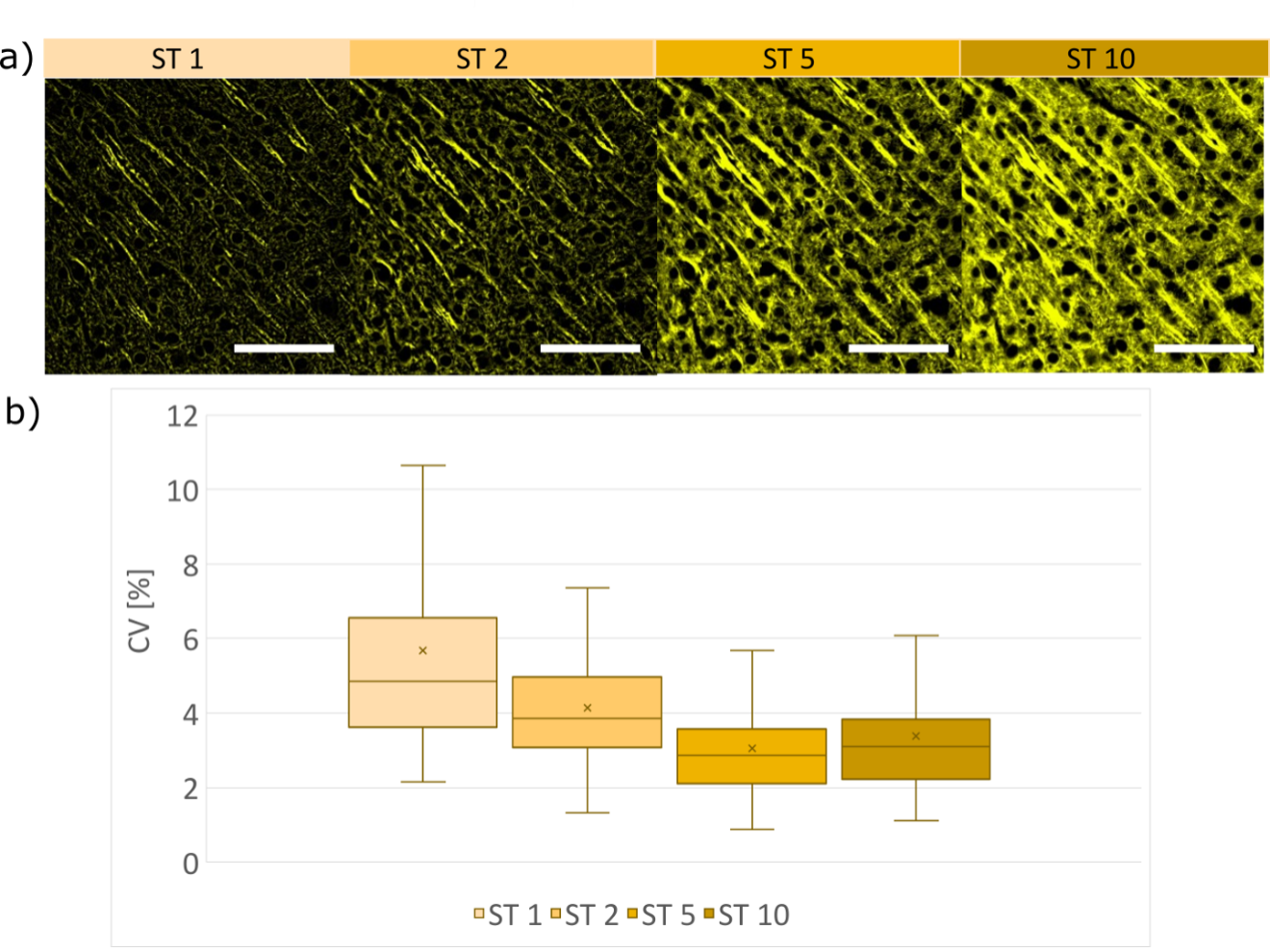
Figure 9 – Images d’une planaire d’eau douce Schmidtea Mediterranea (objectif 20x). Comparaison de trois techniques d’imagerie différentes : a) image à grand champ, b) image à grand champ optimisée à l’aide d’un algorithme de défloutage et c) image SILA avec une épaisseur de sectionnement de 5. Bleu : DAPI ; vert : cellules internes de l’intestin ; rouge : cellules externes de l’intestin. Échantillons fournis par Amrutha Palavalli, Department for Tissue Dynamics and Regeneration, Max Planck Institute for Multidisciplinary Sciences, Goettingen, Allemagne. L’échelle graphique correspond à 500 µm et est valable pour toutes les sous-figures.
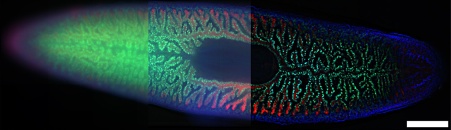
Figure 10 – Image d’un échantillon épais de cerveau de souris avec marquage de MAP2 (objectif 20x). Comparaison de trois techniques d’imagerie différentes : a) Image en grand champ large avec projection de profondeur de champ étendue (EFI), b) image en grand champ avec projection de profondeur de champ étendue et déconvolution et c) image SILA avec projection de profondeur de champ étendue et épaisseur de sectionnement de 2. Les échelles graphiques correspondent à 50 µm.
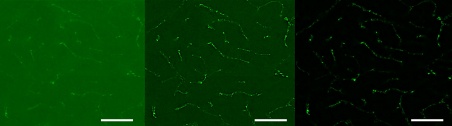
Figure 11 – Image d’un échantillon de cerveau de souris avec mise en évidence des neurones par marquage de la protéine acide fibrillaire gliale (GFAP) (objectif 20x). Comparaison de trois techniques d’imagerie différentes : a) Image confocale acquise à l’aide d’un microscope FLUOVIEW™, b) même image confocale avec déconvolution et c) image SILA avec une épaisseur de sectionnement de 2. L’échelle graphique correspond à 50 µm et est valable pour toutes les sous-figures.
Conclusion
Le dispositif de sectionnement optique SILA compatible avec le scanner VS200 nous permet d’acquérir des images d’échantillons épais avec un meilleur contraste. Par rapport à la microscopie à grand champ, la durée de balayage augmente en moyenne de 53 % lors de l’utilisation de l’objectif à air de 40x. La profondeur optique que nous pouvons atteindre est seulement limitée par la distance frontale de notre configuration optique, puisque nous avons réussi à numériser des échantillons très épais, d’une épaisseur allant jusqu’à 500 µm. La résolution axiale de la méthode SILA est identique à celle de l’imagerie à grand champ, mais le sectionnement optique est nettement meilleur et peut être contrôlé en jouant sur l’épaisseur du sectionnement.
Lorsqu’une épaisseur de sectionnement plus grande est utilisée, la puissance de la filtration spatiale sur l’image prise avec un éclairage en tavelures est plus faible, ce qui fait que les variations de l’intensité sur les images SILA sont plus faibles. En effet, les variations observées dans nos exemples sont de l’ordre de 3,7 ± 1,4 %. La variation d’intensité la plus élevée obtenue avec une épaisseur de sectionnement de 1 peut être limitée par l’augmentation de l’épaisseur. Cet ajustement doit être envisagé lorsque l’on souhaite effectuer une analyse quantitative des intensités de fluorescence.
Le système nous permet de produire rapidement des images comparables à celles obtenues avec la microscopie confocale ou avec une déconvolution. Nous pensons que cette technologie peut être appliquée à la numérisation rapide de lames d’échantillons épais, et qu’elle permet de produire des images parfaitement nettes et contrastées avec des détails bien définis.
Références bibliographiques
- Lim, D., Ford, T., Chu, K.K., and Mertz, J. 2011. "Optically Sectioned In Vivo Imaging with Speckle Illumination HiLo Microscopy." Journal of Biomedical Optics. 16, 016014.
- Lim, D., Chu, K.K., and Mertz, J. 2008. “Widefield Fluorescence Sectioning with Hybrid Speckle and Uniform-Illumination Microscopy.” Optical Letters. 33, 1819–1821.
- Mertz, J. and Kim, J. 2010. “Scanning Light-Sheet Microscopy in the Whole Mouse Brain with HiLo Background Rejection.” J. Biomed. Opt. 15, 016027.
- 4. Goodman, J. W. 2007. “Speckle Phenomena in Optics: Theory and Applications.” Roberts and Company Publishers.
- Schniete, J., Franssen, A., Dempster, J. et al. 2018. “Fast Optical Sectioning for Widefield Fluorescence Mesoscopy with the Mesolens based on HiLo Microscopy.” Sci Rep, 8, 16259.
- Richardson, D. S. and Lichtman, J. W. 2015. "Clarifying Tissue Clearing." Cell. 162.2: 246–257.
Auteurs
Anna Zelená, spécialiste en applications, Evident Technology Center Europe
Wei Juan Wong, responsable de produit, Evident Technology Center Europe
Gabriel Maranon, expert produit, Bliq Photonics
Alicja Gąsecka, directrice de production et R&D, Bliq Photonics
Mariêve Picard, directrice des ventes et marketing, Bliq Photonics
Jeck Borne, ingénieur système, Bliq Photonics
Nous tenons à remercier toute l’équipe VS200 de l’Evident Technology Center Europe.
Produits utilisés pour cette application
a bien été ajouté à vos favoris
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.