Not Available in Your Country
Sorry, this page is not
available in your country.
- Vue d’ensemble
- Technologies appliquées
- Caractéristiques techniques
- Galerie des applications
- Ressources
- Autres systèmes
Vue d’ensemble
 | Super-résolution confocale pour tous les échantillons de cellules vivantesConçu pour une imagerie rapide à super-résolution en 3D et une viabilité prolongée des cellules lors d’expériences à prises d’images par intervalles, le système de microscope IXplore SpinSR offre une résolution XY à 120 nm sans nécessité de recourir à des procédures de marquage spécifiques. |
|---|
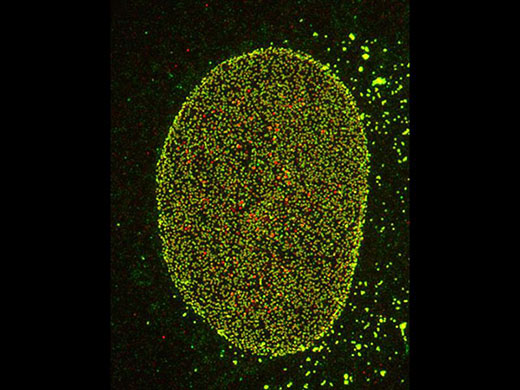
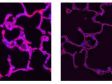
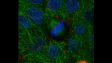
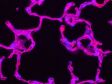
 Gauche : confocal / Droite : super-résolution | Super-résolution globaleObtenez des images confocales d’une résolution XY allant jusqu’à 120 nm à l’aide de la technique confocale et du système Olympus Super Résolution (OSR). * Image : Microfilaments dans une cellule HeLa : coloration par anticorps anti-actine phalloïdine-Alexa488 (vert), anti-chaîne lourde de la myosine Alexa 568 (rouge).
|
|---|
Adapté aux échantillons vivantsLes algorithmes de l’OSR fonctionnent en temps réel pour éliminer les retards causés par le moyennage des trames ou la reconstruction de l’image, en fournissant des images instantanées à super-résolution pour vous permettre d’obtenir les résultats plus rapidement. Cela permet de concevoir des expériences en super-résolution avec des cellules vivantes, qui sont encore davantage améliorées par les vitesses d’imagerie ultra-rapides et les capacités d’acquisition multicanal du disque rotatif confocal. | Protéines EB3 se fixant à l’extrémité des microtubules qui s’étendent dans les cellules HeLa vivantes. Les protéines EB3 ont été marquées à la GFP par transgénèse.*1 Données d’images fournies avec l’aimable autorisation de : Kaoru Kato, PhD, National Institute of Advanced Industrial Science and Technology Biomedical Research Institute |
Optimisez vos recherchesLe système de microscope IXplore SpinSR peut être facilement intégré à vos équipements existants et à vos protocoles d’échantillons. Il est possible de passer d’une option à l’autre (champ large, confocal et super-résolution) en un seul clic pour un même échantillon – le microscope s’occupe du reste. Il est possible d’améliorer encore davantage les données des images au moyen des outils d’analyse des images du logiciel cellSens. Les flux de travaiaux efficaces du logiciel vous permettent de gérer efficacement vos données et d’effectuer des analyses sophistiquées qui vous ouvriront de nouvelles portes. Les algorithmes de déconvolution TruSight sont conçus pour fonctionner harmonieusement avec les algorithmes de l’OSR, ce qui permet d’éviter tout surtraitement. Ensemble, ils fournissent des images plus claires et plus nettes que toute autre technique individuelle. |
|---|
Découvrez des détails en super-résolution dans les échantillonsPour observer les structures intracellulaires, il est nécessaire d’éviter toute fluorescence hors foyer pouvant flouter les véritables données dans l’image finale. Le système de microscope IXplore SpinSR intègre un système optique confocal qui permet d’utiliser plusieurs objectifs, par exemple les optiques à huile de silicone, ce qui permet ainsi l’acquisition d’images en super-résolution nettes avec moins de flous, même dans les échantillons épais. Par conséquent, aucun tampon ou fluorophore spécial n’est requis. Il n’est donc pas nécessaire de changer les échantillons ou les protocoles de préparation lors du passage en super-résolution. | Related VideosImages à prises intermittentes d’un neurone primaire de souris marqué au EGFP après une co-culture avec astrocyte pendant 2 semaines. Il est aisé de constater la différence entre l’épine immature (flèche jaune) et l’épine mature (flèche bleue) et de détecter le changement morphologique au fil du temps. La 3D a été acquise avec un temps d’exposition de 500 ms/image, et un pas de 0,15 µm selon l’axe des Z avec 41 coupes. Les images ont été acquises toutes les 2 minutes pendant 1 heure. 3D affichée par FV31S-DT. Données d’images fournies avec l’aimable autorisation de : Yuji Ikegaya, PhD
|
|---|
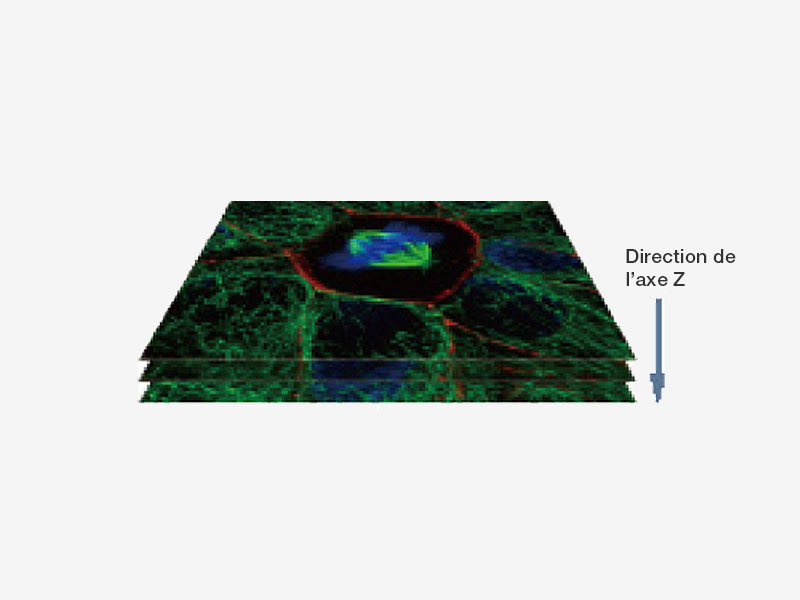
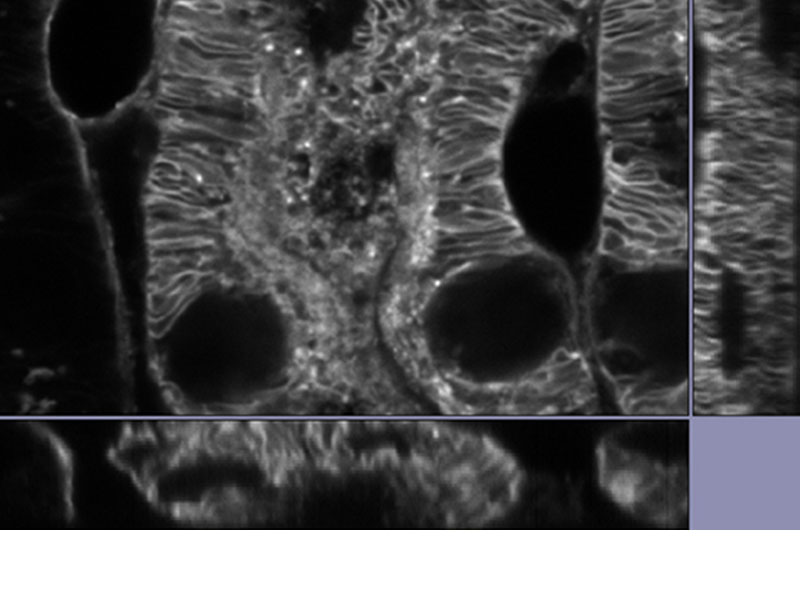   | Données précisesNotre déconvolution TruSight peut être associée à la super-résolution pour offrir des images plus claires et plus nettes qu’avec la déconvolution seule. La déconvolution itérative restreinte en 3D supprime le flou le long de l’axe des Z pour obtenir une image 3D plus nette.
* Image : tissu de rein de souris coloré avec Alexa488 |
|---|
Imagerie bicolore simultanéeLe système IXplore SpinSR peut utiliser deux caméras simultanément pour obtenir rapidement des images de localisation de deux colorants en super-résolution. L’utilisation des fluorophores et lignes laser existants le permet. |
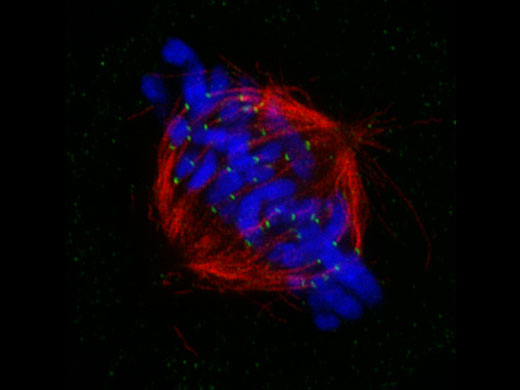
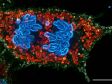
Fuseau mitotique de cellule en métaphase*1 Des cellules HeLa dérivées du cancer de l’utérus humain ont été fixées et colorées respectivement pour α-tubline (microtubules, rouge) et Hec1 (kinétochores, vert). L’ADN a été coloré avec DAPI (chromosomes, bleu). Les chromosomes interagissent avec les microtubules qui forment le fuseau mitotique via des kinétochores qui s’assemblent sur la région centromérique des chromosomes.
|
Complexe de pores nucléaires d’une cellule Hela Nup153(Alexa 488 : vert), Nup62(Alexa 555 : rouge)
|
Références bibliographiquesS. Hayashi et Y. Okada, « Ultrafast superresolution fluorescence imaging with spinning disk confocal microscope optics », Mol. Biol. Cell 26(9), 1743–1751 (2015). S. Hayashi, « Resolution doubling using confocal microscopy via analogy with structured illumination microscopy », Jpn. J. Appl. Phys. 55(8), 082501 (2016). A. Nagasawa-Masuda et K. Terai, « Yap/Taz transcriptional activity is essential for vascular regression via Ctgf expression and actin polymerization », PLoS ONE 12(4), e0174633 (2017). H. Nakajima, et al., « Flow-Dependent Endothelial YAP Regulation Contributes to Vessel Maintenance », Dev. Cell 40(6), 523-536.e6 (2017). K. Tateishi, et al., « Three-dimensional Organization of Layered Apical Cytoskeletal Networks Associated with Mouse Airway Tissue Development », Sci. Rep. 7, 43783 (2017). E. Herawati, et al., « Multiciliated cell basal bodies align in stereotypical patterns coordinated by the apical cytoskeleton », J. Cell Biol. 214(5) 571-586 (2016). M.-T. Ke, et al., « Super-Resolution Mapping of Neuronal Circuitry With an Index-Optimized Clearing Agent », Cell Rep. 14(11) 2718–2732 (2016). |
*1 Bien que la lignée cellulaire HeLa soit devenue l’une des plus importantes dans la recherche médicale, nous devons absolument reconnaître que la contribution de Henrietta Lacks à la science s’est produite sans son consentement. Cette injustice, bien qu’elle ait mené à des découvertes clés en immunologie, en maladies infectieuses et en cancer, a également suscité d’importantes conversations sur la
confidentialité, l’éthique et le consentement en médecine.
|
Besoin d’aide? |
Technologies appliquées
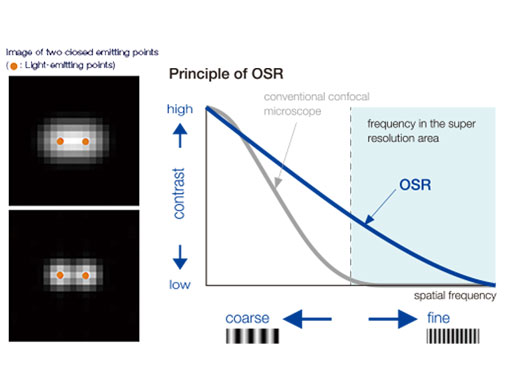
Principe de l’OSRLa technologie Olympus Super Resolution (OSR) permet d’obtenir une résolution latérale (XY) de 120 nm. Elle a été conçue exclusivement pour tirer profit des données spatiales à haute fréquence dans les images confocales. Après le traitement, les images finales sont non seulement plus nettes grâce à une réduction de la taille de point, mais également mieux résolues pour les structures très proches les unes des autres. |
|
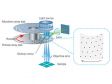
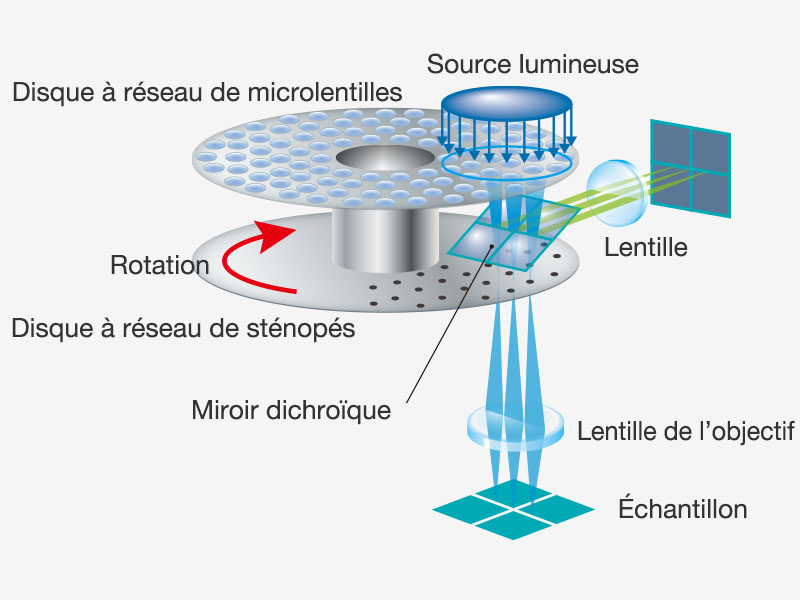  | Une imagerie à super-résolution rapide et un grand champ d’observationAu lieu de balayer laborieusement l’ensemble du champ d’observation, le capteur d’imagerie sensible du microscope SpinSR10 prend un ensemble d’instantanés de toute la surface de l’échantillon en une seule étape pour en acquérir rapidement l’image, ce qui permet aux chercheurs d’observer des phénomènes biologiques très rapides. En mode grand champ et confocal, le système optique du microscope a un indice de champ de 18, ce qui lui permet de prendre des images avec un champ d’observation plus grand, tandis que deux caméras permettent aux utilisateurs d’acquérir simultanément des images bicolores en super-résolution. Fondée sur un système optique confocal, la technologie Olympus Super Resolution (OSR) permet de réaliser des coupes optiques pour acquérir des images en super-résolution d’une grande clarté avec un bruit de fond réduit. Données d’images d’application reproduites avec l’aimable autorisation de : Hatsuho Kanoh, Tomoki Yano et Sachiko Tsukita, Graduate School of Frontier Biosciences et Graduate School of Medicine, université d’Osaka |
|---|
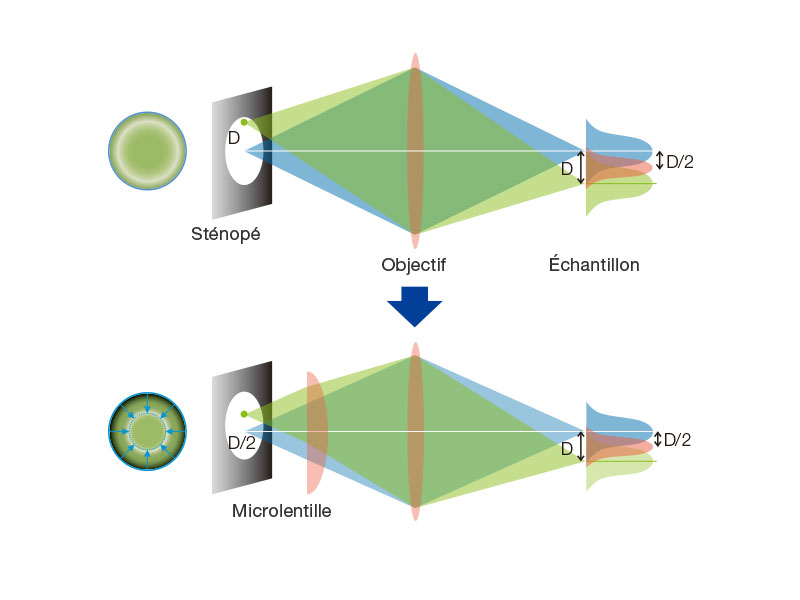
Le disque rotatif produit des images lumineuses des cellules vivantesLe modèle à haute sensibilité équipé du disque SoRa permet d’acquérir des images en super-résolution plus lumineuses grâce au disque rotatif comportant des microlentilles dans les sténopés confocaux. Chaque sténopé confocal permet de prendre des images avec une puissance laser inférieure, ce qui réduit le photoblanchiment et la phototoxicité dans votre échantillon tout en produisant des images en super-résolution lumineuses.
Dans les microscopes confocaux classiques, la formation de l’image est le produit des fonctions d’étalement du point (PSF) d’éclairage et d’étalement du point de détection. La formation de l’image sur le sténopé à la position D de l’axe optique est le produit de la PSF d’éclairage et de la PSF de détection. On peut constater que les informations issues de la position D/2 de l’axe optique sont transmises mais pas résolues. Pour corriger ce problème, une microlentille est installée dans le sténopé, et les points focaux individuels projetés sur le sténopé sont réattribués optiquement au centre, ce qui crée une image idéale et augmente la luminosité et la résolution. Ce processus rend la résolution quasiment égale à celle d’un microscope confocal idéal dans lequel le sténopé a été réduit à une taille infinitésimale. Référence : T. Azuma et T. Kei, « Super-Resolution Spinning-Disk Confocal Microscopy Using Optical Photon Reassignment », Opt. Express 23, 15003-15011 (2015). |
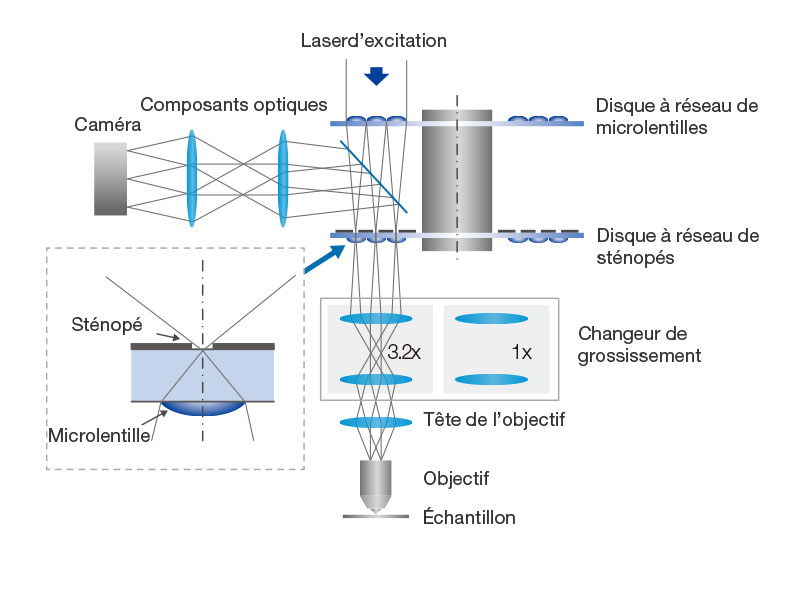
| Un éclairage uniforme de tout le champ d’observationLe changeur de grossissement est conçu pour le microscope inversé IX83P2ZF et fournit un éclairage uniforme de tout le champ d’observation. Le système optique télécentrique du changeur optimise les performances des objectifs tout en permettant une commutation motorisée directe entre le confocal et la super-résolution. |
|---|
Une résolution en Z amélioréeNos objectifs à immersion dans l’huile de silicone sont conçus pour les observations en profondeur dans les tissus. L’aberration sphérique causée par les différences d’indices de réfraction a des répercussions négatives sur la qualité des observations en profondeur. L’indice de réfraction de l’huile de silicone (n=1,40) est proche de celui des cellules vivantes ou des tranches de tissu en culture (n=1,38), ce qui permet de prendre des images en super-résolution de structures intracellulaires à des dizaines de micromètres de profondeur avec une aberration sphérique minimale. | Related Videos |
|---|
| Réduisez l’aberration sphériqueL’unité de bague de correction à distance est utilisée pour ajuster la position des lentilles à l’intérieur l’objectif afin de corriger l’aberration sphérique causée par les différences d’indices de réfraction, ce qui améliore sensiblement le signal, la résolution et le contraste. L’unité IX3-RCC fonctionne avec n’importe quel objectif UIS2 muni d’une bague de correction. |
|---|
Stabilité des imagesLorsqu’il est associé au système de compensation de la dérive en Z TruFocus, le système de microscope IXplore SpinSR peut prendre à intervalles des images d’une grande précision, correctement alignées et parfaitement nettes. | Related Videos |
|---|
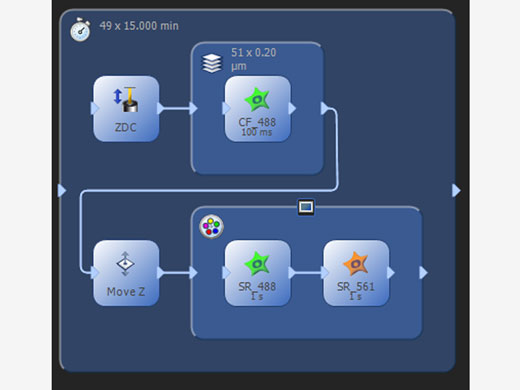 | Gestion des expériences complexesLe gestionnaire de procédures simplifie l’acquisition d’images multicolores, à prises à intervalles ou par empilements de plans Z. Le gestionnaire d’expériences graphique programmable (GEM) permet aux utilisateurs de concevoir une automatisation plus complexe depuis une interface graphique qui prend en charge un large éventail de protocoles d’imagerie expérimentale et de déclenchement de dispositifs. Concevez des protocoles expérimentaux sur mesure pouvant être modifiés facilement à tout moment selon vos besoins au cours du processus d’imagerie. |
|---|
Besoin d’aide ? |
Caractéristiques techniques
| Monture de microscope | IX83P2ZF | |
|---|---|---|
| Méthode d’observation > Très grande résolution | ✓ | |
| Méthode d’observation > Confocal | ✓ | |
| Méthode d’observation > Fluorescence (excitation bleue/verte) | ✓ | |
| Méthode d’observation > Fluorescence (excitation ultraviolette) | ✓ | |
| Méthode d’observation > Contraste interférentiel différentiel (CID) | ✓ | |
| Méthode d’observation > Contraste de phase | ✓ | |
| Méthode d’observation > Fond clair | ✓ | |
| Tourelle porte-objectifs rotative > Motorisée (6 positions) | ✓ | |
| Mise au point > Motorisée |
| |
| Mise au point > Dispositif de compensation de la dérive en Z | ✓ | |
| Têtes d’observation > Champ large (numéro de champ : 22) > Binoculaire inclinable | ✓ | |
| Illuminateur > Illuminateur de Köhler à lumière transmise > Lampe à DEL | ✓ | |
| Illuminateur > Illuminateur de Köhler à lumière transmise > Lampe halogène de 100 W | ✓ | |
| Illuminateur > Illuminateur pour fluorescence > Lampe à mercure de 100 W | ✓ | |
| Illuminateur > Illuminateur pour fluorescence > Éclairage avec guide de lumière | ✓ | |
| Tourelle de miroirs à fluorescence > Motorisée (8 positions) | ✓ | |
| Platine > Motorisée | Contact your local sales representative to hear about motorized stage options | |
| Platine > Mécanique > Platine mécanique IX3-SVR avec molette à droite |
| |
| Platine > Mécanique > Platine mécanique IX3-SVL avec molette courte à gauche |
| |
| Condenseur > Motorisé > Condenseur universel | Distance de travail 27 mm, ouverture numérique 0,55, ouverture motorisée et polariseur | |
| Condenseur > Réglage manuel > Condenseur universel | O. N. : 0,55 / Distance de travail : 27 mm | |
| Condenseur > Réglage manuel > Condenseur à ultra-grande distance de travail | O. N. : 0,3 / Distance de travail : 73,3 mm | |
| Scanner confocal | CSU-W1 | |
| Traitement pour très grande résolution | Filtre Olympus Super Resolution (OSR) | |
| Accessoires |
Contrôleur de bague de correction à distance (IX3-RCC)
| |
| Dimensions (L × P × H) | 323 (L) × 475 (P) × 706 (H) mm (statif de microscope IX83) | |
| Poids | Env. 47 kg (IX83P2ZF) |
Galerie des applications
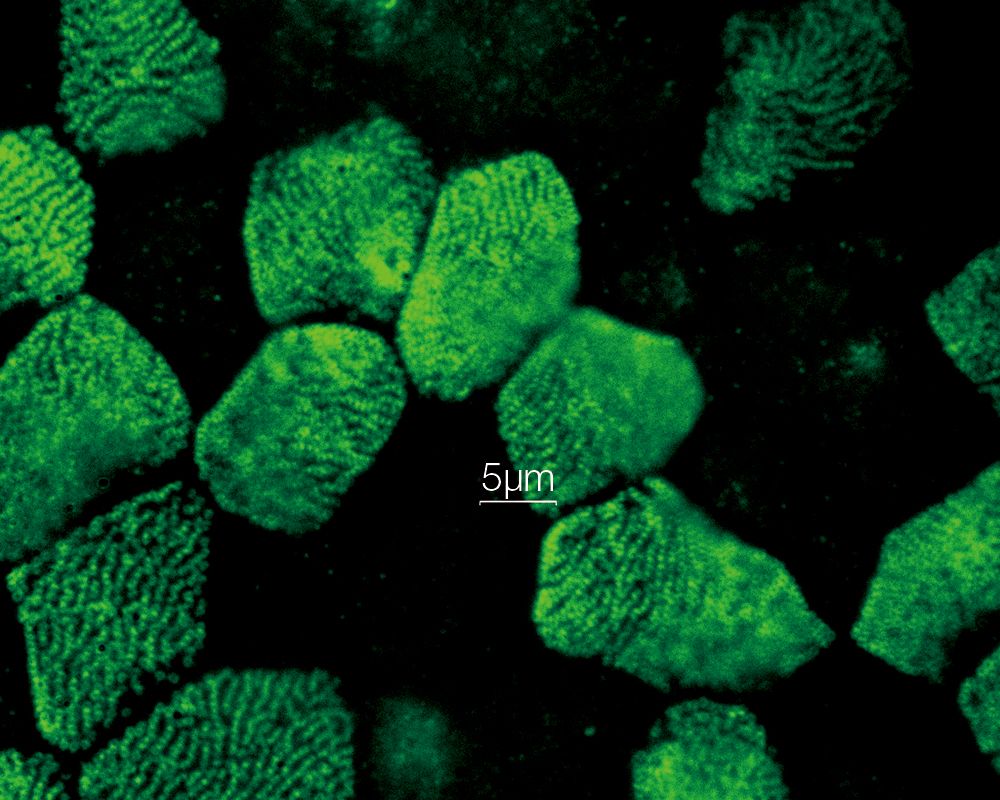
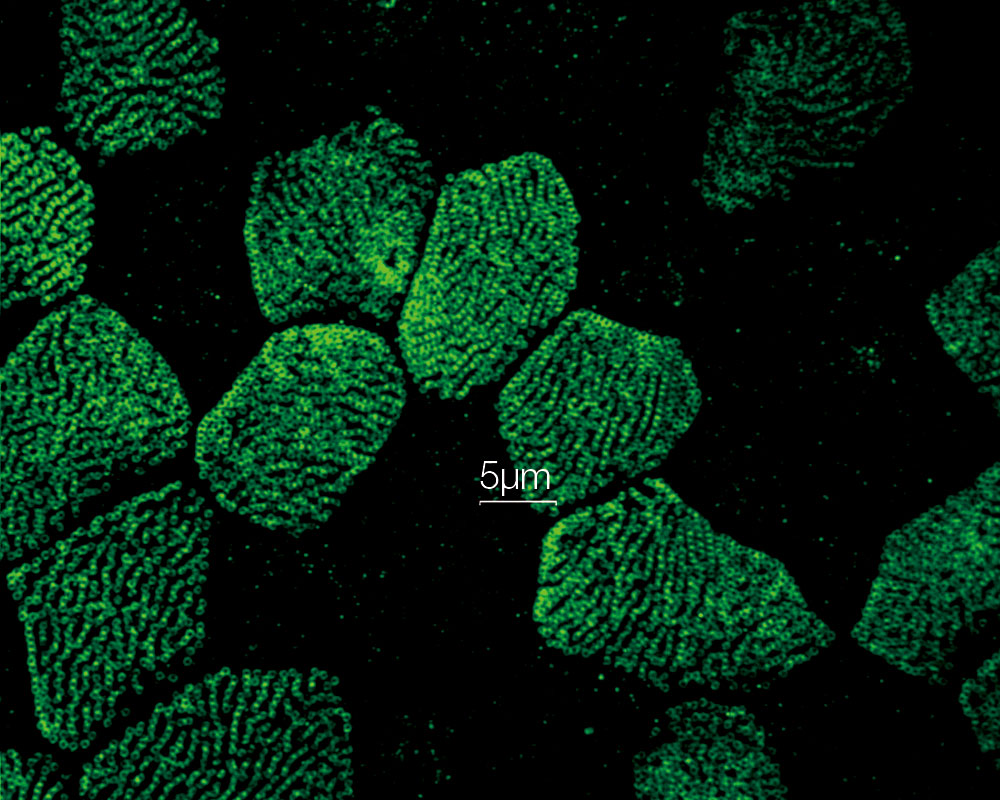
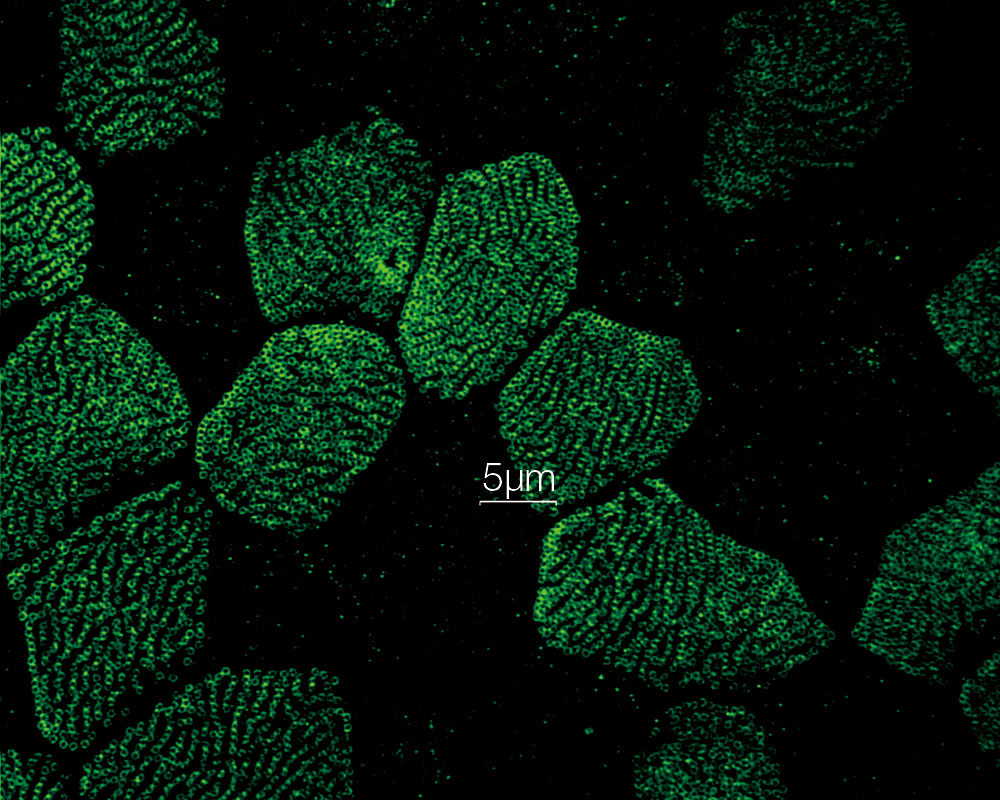
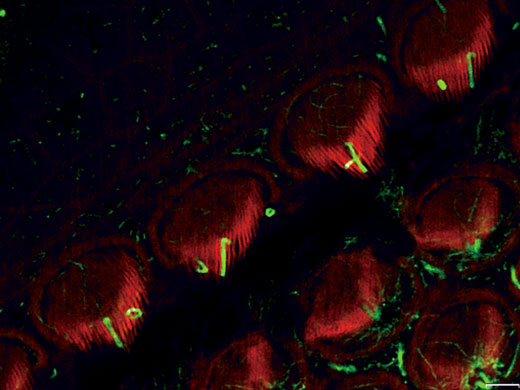
Stéréocils et kinocils de cellules ciliées internes dans l’organe de Corti (actine : orange, tubuline : vert) Données d’images fournies avec l’aimable autorisation de : Hatsuho Kanoh1, Toru Kamitani1,2, Hirofumi Sakaguchi2, Sachiko Tsukita1 |
|
Related Videos | Cellule épithéliale mitotique en culture. (Chromosome : bleu, tubuline : vert, ZO1 : rouge) Données d’images fournies avec l’aimable autorisation de : Hatsuho Kanoh, Tomoki Yano, Sachiko Tsukita
|
|---|
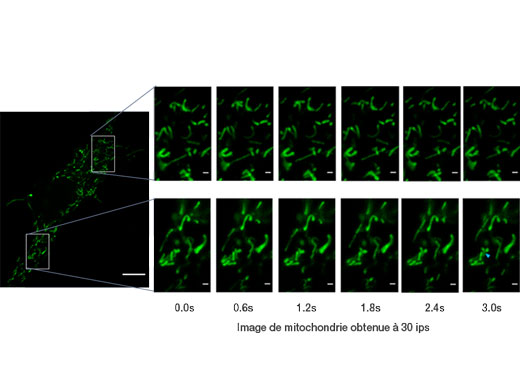
Mitochondrie étiquetée par GFP. Images acquises à 30 ips; permet d’observer les mouvements individuels de la mitochondrie. Données d’images fournies avec l’aimable autorisation de : Kumiko Hayashi, Ph.D., Graduate School of Engineering, Tohoku University |
|
|---|
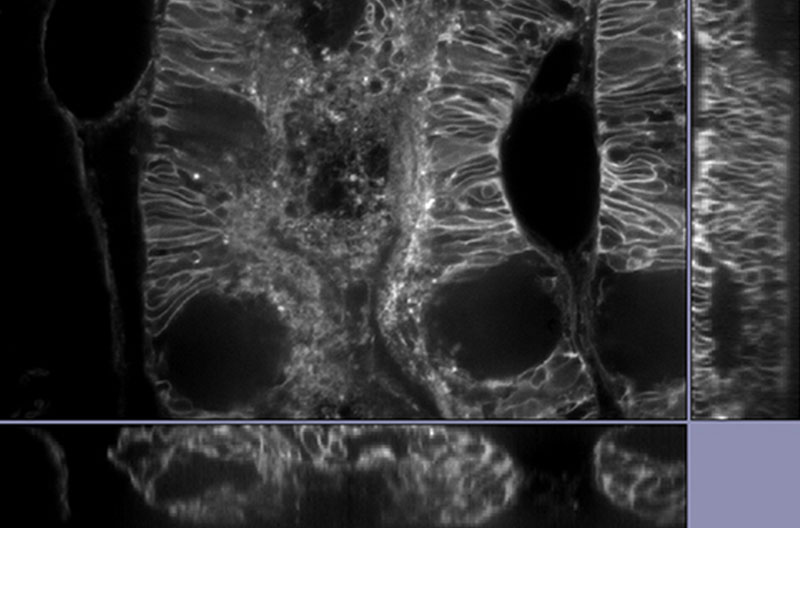
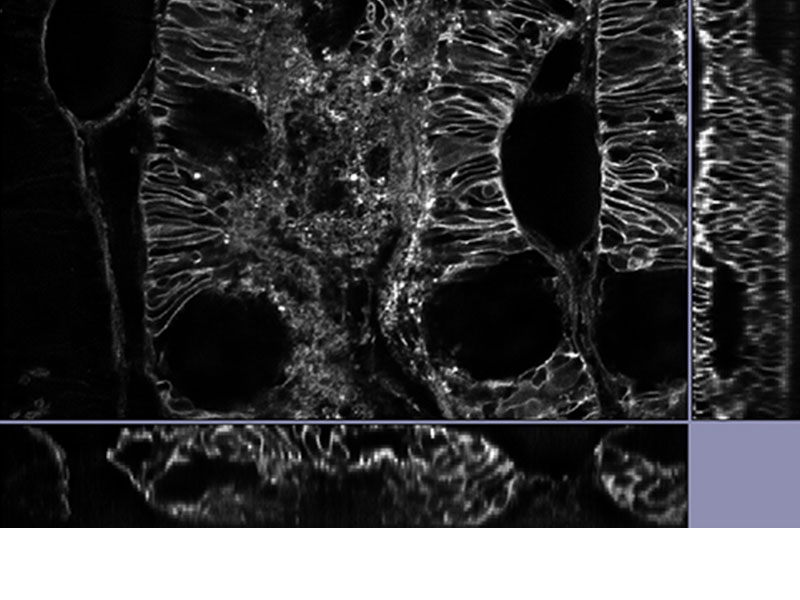
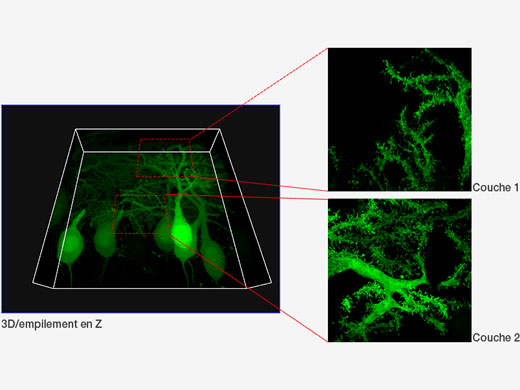 | Cellules de Purkinje marquées avec GFP. Image XYZ avec image confocale et super-résolution dans différentes positions de l’axe Z. Les images à très grande résolution sont projetées sur l’axe Z (10 coupes). 3D affichée par FV31S-DT. Données d’images fournies avec l’aimable autorisation de : Yukari Takeo, Michisuke Yuzaki, PhD., Department of Physiology, School of Medicine, Keio University |
|---|