L’imagerie multimode et le multiplexage de fluorescence sont devenus des méthodes indispensables pour examiner efficacement différents éléments d’un même échantillon en une seule expérience. Mais les résultats quantitatifs de ce type d’expérience ne reposent que sur une chose : votre capacité à extraire des données d’image riches en informations.
L’importance de l’imagerie de lame entière pour la quantification
Le principe de base de l’imagerie de lame entière est de rassembler numériquement des images à fort grossissement avec un petit champ de vision pour former une vue d’ensemble plus grande de l’échantillon. Pourquoi faire cela ?
Pour faire simple, l’intérêt de l’imagerie de lame entière, parfois appelée imagerie de lame numérique ou microscopie virtuelle, est d’obtenir une vision plus complète du contexte biologique d’une image microscopique. L’observation d’une ou deux cellules isolées à fort grossissement peut être informative, mais observer cette cellule dans le contexte plus large de tissus entiers ouvre de plus grandes possibilités de recherche.
Alors, pourquoi ne pas simplement prendre une image macro du tissu ? La puissance de l’imagerie de lame entière, c’est que l’image macro est constituée d’images micro, où la résolution microscopique permet une meilleure quantification de l’image, que ce soit pour dénombrer les noyaux au sein d’un tissu ou pour suivre des axones sur de plus longues distances dans un cerveau.
Grâce à la puissance de cette combinaison de résolution et de contexte biologique, l’automatisation de l’imagerie de lame entière est devenue la pierre angulaire de nombreux programmes de recherche. Continuez votre lecture pour en apprendre plus sur ses puissantes capacités d’observation pour extraire de nouvelles informations de vos échantillons.
Les capacités d’imagerie sur les systèmes de numérisation de lame entière automatisée
Pendant des années, les systèmes d’imagerie de lame entière disposaient de modes d’imagerie limités. De nos jours, les systèmes d’imagerie de lame entière automatisée comme notre scanner de lames pour la recherche VS200 peuvent combiner plusieurs méthodes d’observation pour vous permettre de voir des structures visibles uniquement sous certaines conditions. Cela signifie que vous pouvez combiner et aligner plusieurs méthodes d’observation comme :
- Le fond clair : avec l’imagerie en fond clair, la lumière blanche transmise passe à travers l’échantillon, et les tissus sont visualisés grâce aux colorants chromogènes. Mais la méthode de fond clair ne fournira aucun contraste intrinsèque, sauf si vous utilisez des colorants chromogènes comme l’hématoxyline et l’éosine.
- L’épifluorescence : elle permet de faire des immunomarquages spécifiques et un degré plus élevé de ciblage moléculaire. Elle permet également d’utiliser un plus grand nombre de fluorophores, ce qui élargit le champ de multiplexage.
- Le contraste de phase et la lumière polarisée : il est possible d’incorporer des observations en contraste de phase et en lumière polarisée aux images de lames entières pour révéler divers degrés de contraste intrinsèque.
- Le fond noir : il utilise les différences entre les indices de réfraction dans les structures membranaires des tissus. Même si l’utilisation de certains fluorophores peut optimiser le fond noir, la technique peut être effectuée sans marqueur et procurer un niveau de contraste comparable à la fluorescence. Ce mode d’observation est toutefois sensible à la poussière.
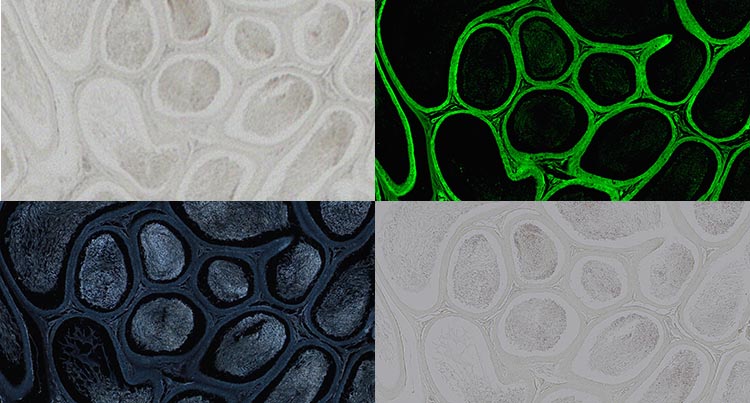
Testicules en milieu de montage Permount, sans coloration, prises avec un objectif x20. Fond clair (en haut à gauche), fluorescence (en haut à droite), fond noir (en bas à gauche), lumière polarisée (en bas à droite). Images reproduites avec l’aimable autorisation de Robin Wacker, Günthersleben, Allemagne.
Mais ce n’est pas tout, les derniers scanners de lames virtuelles sont équipés d’autres outils d’imagerie pour vous aider à extraire de meilleures données de vos expériences. Par exemple, notre scanner de lames VS200 peut faire la mise au point sur plusieurs plans de tissu pour :
- acquérir plusieurs plans à la résolution maximale,
- acquérir des images d’échantillons ayant jusqu’à 100 µm d’épaisseur,
- numériser des images à l’aide de toutes les méthodes d’observation disponibles,
- obtenir facilement des informations dans toutes les dimensions de votre échantillon,
- calculer les projections (déconvolution, Z maximal ou EFI).
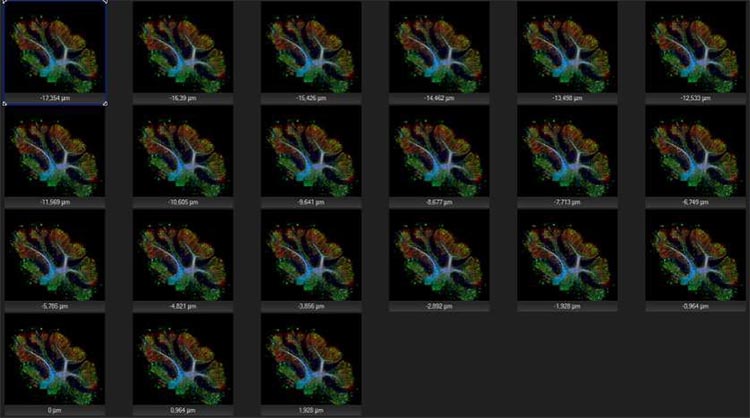
L’empilement selon l’axe Z permet d’acquérir jusqu’à 35 plans en résolution maximale, ce qui facilite l’obtention d’informations dans toutes les dimensions de votre échantillon.
Un autre outil utile est le mécanisme de distribution automatisé de l’huile, qui permet au système d’optimiser la résolution.
La combinaison de ces différents modes d’imagerie et de ces fonctionnalités est encore plus puissante lorsqu’elle est utilisée avec la spécificité moléculaire conférée par les techniques d’immunomarquage, à cela près qu’il peut être encore difficile de marquer efficacement et quantitativement avec l’immunofluorescence.
En gardant ces limites à l’esprit, je vais maintenant vous présenter des technologies d’imagerie qui peuvent faciliter les applications de fluorescence multiplex.
Les propriétés technologiques indispensables pour l’observation multiplex des tissus
La fluorescence multiplex est devenue un outil très utile dans la recherche en immuno-oncologie en raison de l’extrême complexité du micro-environnement tumoral, mais elle nécessite un logiciel, un personnel et un équipement spécialisés pour pouvoir mettre au point une méthode d’analyse qui marche et l’appliquer à une tumeur d’intérêt.
Les fabricants ont développé de nouvelles technologies qui répondent aux différents besoins et problèmes qui empêchent l’utilisation massive de ce type d’analyse. Les propriétés indispensables de ces technologies incluent :
Un multiplexage de haut niveau qui répond à :
| Une compatibilité avec les procédures qui offre :
|
Une imagerie de lame entière qui capture :
| Un logiciel qui peut identifier des phénotypes complexes :
|
Présentation du test d’analyse de biomarqueurs UltiMapper™ Multiplex Marker
Une autre technologie utile pour les expériences d’imagerie multiplexée est le test d’analyse de biomarqueurs UltiMapper I/O.
Les tests d’analyse UltiMapper I/O utilisent la technologie InSituPlex® pour assurer un multiplexage haute résolution sur des lames entières pour le phénotypage cellulaire et le profilage spatial de l’activité de biomarqueurs. En tant que solutions pré-optimisées à base de réactifs, ces kits s’intègrent parfaitement aux équipements et logiciels existants pour les procédures d’immunohistochimie (IHC) et permettent aux chercheurs de réaliser l’immunomarquage, l’acquisition des images et l’évaluation de ces images en une seule journée.
L’image ci-dessous illustre les quatre étapes de la procédure :
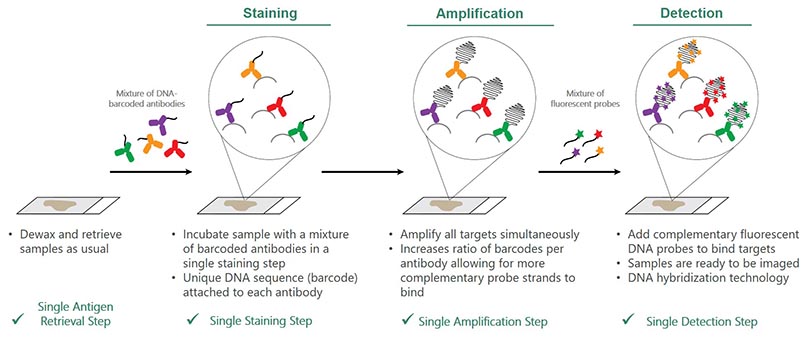
Étape 1 : Démasquage :
- Déparaffiner l’échantillon et démasquer les antigènes comme à l’accoutumée
Étape 2 : Immunomarquage :
- Incuber l’échantillon avec un mélange d’anticorps à code à barres en une seule étape
- Le code à barres est une séquence d’ADN unique liée à chaque anticorps
Étape 3 : Amplification
- Amplifier toutes les cibles simultanément
- Augmente la proportion de codes à barres par anticorps pour permettre la liaison de plus de brins de sonde complémentaire
Étape 4 : Détection
- Ajouter les sondes d’ADN fluorescentes complémentaires pour les lier aux cibles
- Les échantillons sont prêts pour l’imagerie
- Technologie d’hybridation d’ADN
Les trois facteurs qui influencent la qualité de l’image pour la quantification
Lors de la conception de votre expérience, choisissez la combinaison de technologies optique et d’immunomarquage la mieux adaptée pour les analyses que vous souhaitez faire. Si vous essayez de faire des analyses sur des images de mauvaise qualité à cause d’un mauvais ensemble de réactifs ou d’une mauvaise configuration optique, vous ne parviendrez pas à de bons résultats.
Voici les trois facteurs optiques qui influencent la qualité de l’image pour la quantification :
- Un éclairage avec des couleurs justes : il est important que la représentation des couleurs de la coloration H&E soit fidèle et reproductible. Les composants optiques pour la lumière transmise doivent avoir des caractéristiques spectrales qui imitent les sources lumineuses halogènes pour reproduire le violet, le cyan et le rose.
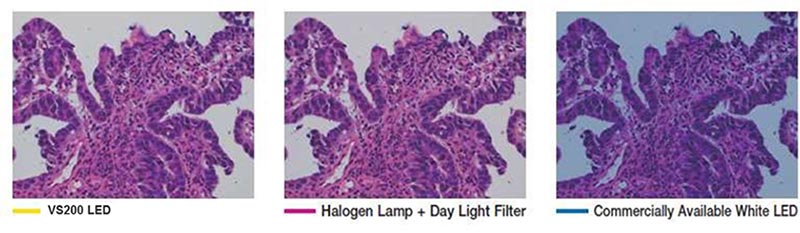
L’éclairage à DEL à couleurs naturelles du système VS200 pour l’observation en lumière transmise possède les mêmes caractéristiques spectrales et la même puissance qu’une lampe halogène, de sorte que les colorants violets, cyan et roses sont correctement représentés, numérisés et rendus.
- La fidélité et la précision des couleurs : en plus d’un éclairage avec les bonnes caractéristiques spectrales, la caméra du microscope doit assurer une excellente fidélité et précision des couleurs. Assurez-vous d’utiliser une caméra à correction de couleur avec le bon équilibre pour représenter fidèlement les tissus. L’examen empirique des images numériques peut être subjectif, car les différents paramètres d’acquisition entraînent différents résultats d’image, mais les caméras à correction de couleur et les profils ICC reproduisent les couleurs et l’intensité avec fidélité sur les écrans d’ordinateur.
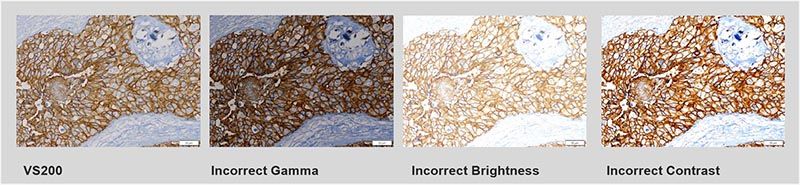
L’examen empirique des images numériques peut être subjectif, car les différents paramètres d’acquisition entraînent différents résultats d’images. Le scanner VS200 utilise des caméras à correction de couleur et offre des profils ICC pour la reproduction fidèle des couleurs et de l’intensité sur les écrans d’ordinateur.
- La planéité du champ : prendre une série d’images sur lesquelles le champ n’est pas plat, ou sur lesquelles aucune correction n’est intégrée, peut causer un effet de halo sur chaque champ de vision, ce qui est problématique pour la quantification. Dans un tel cas, vous devez utiliser un équilibrage non linéaire et filtrer chaque champ de vision, ce qui prend du temps et des ressources. Recherchez la configuration optique qui vous permettra de maximiser la planéité du champ afin d’obtenir de meilleurs résultats de quantification.
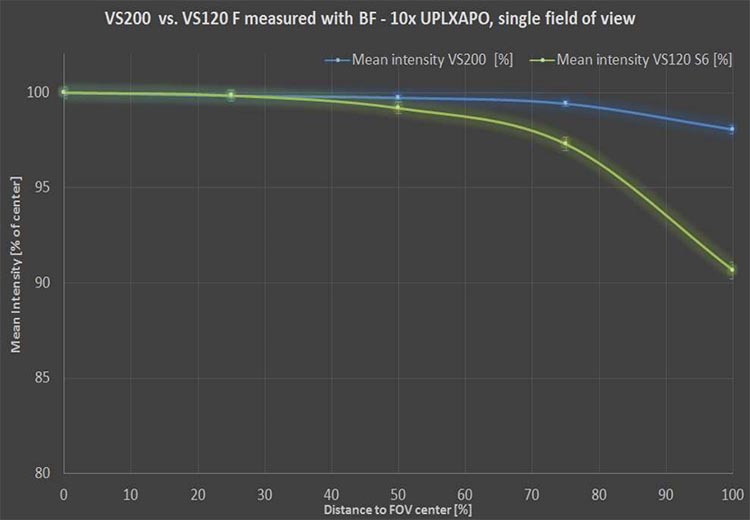
Les objectifs X Line™ haute performance sur le scanner de recherche VS200 contribuent à améliorer la planéité de l’image.
Dernières observations
Comme les images peuvent être acquises dans un volume avec un empilement de plusieurs mises au point selon l’axe Z, vous pouvez améliorer et parfaire le contraste des images à l’aide de méthodes telles que la déconvolution, les projections d’intensité maximale ou les vues focales étendues, qui vous permettent de sélectionner la meilleure mise au point pour une image.
En définitive, la solution pour l’analyse quantitative est une combinaison de bons marqueurs, de bons composants optiques et d’un logiciel qui est assez robuste pour effectuer une analyse par segmentation et pour collecter des informations statistiques biologiquement pertinentes.
Pour en savoir plus sur l’extraction de données riches à partir de votre imagerie multimode et de vos expériences de fluorescence multiplex, rendez-vous sur mon webinaire à la demande, ici.
Contenu connexe
5 Ways the VS200 Slide Scanner Can Benefit Your Research
.jpg?rev=E220)
