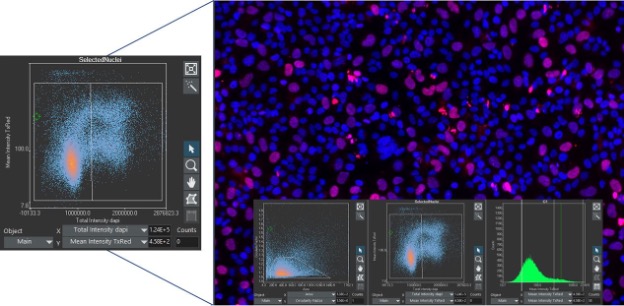
La cytométrie en flux est l’une des principales techniques utilisées pour identifier et segmenter les populations de cellules en raison de sa capacité à évaluer rapidement de grandes populations de cellules à l’aide de marqueurs fluorescents. La cytométrie en flux présente toutefois des limites qui doivent être palliées au moyen d’autres techniques. Grâce au perfectionnement des outils d’analyse d’images, la cytométrie en image est devenue un meilleur moyen d’accéder à encore plus d’informations tout en évaluant de grandes populations de cellules.
Le présent article explore en détail la cytométrie en flux et explique comment la cytométrie en image, une technique en pleine expansion, fournit aux chercheurs des outils puissants pour améliorer leur travail.
Qu’est-ce que la cytométrie en flux ?
Depuis des décennies, la cytométrie en flux est l’un des principaux outils utilisés pour l’identification et l’analyse des marqueurs moléculaires sur les populations de cellules. Dans le cadre de cette technique, on dissocie les cellules pour créer une suspension de cellules individuelles et on les marque avec des anticorps fluorescents qui ciblent les marqueurs d’intérêt. On fait ensuite passer ces cellules dans un cytomètre en flux, où on peut les analyser individuellement pour évaluer l’expression de chaque marqueur. On obtient alors des données quantifiables précieuses sur la population de cellules.
Grâce à cet outil essentiel, les chercheurs peuvent quantifier la présence et la quantité des protéines sur leurs cellules d’intérêt, ce qui permet la segmentation et l’identification des populations de cellules ainsi que le tri des cellules.
Inconvénients de la cytométrie en flux
Alors que la cytométrie en flux peut fournir de grands volumes de données quantifiables au niveau cellulaire, cette technique présente des inconvénients du fait que les mesures doit être effectuées à partir de cellules individuelles en suspension.
Inconvénients de la cytométrie en flux :
- De nombreuses cellules sont cultivées sous forme adhérente à des plaques ou à des supports de culture tissulaire ou au sein de tissus ou de structures avec d’autres cellules. Une fois les cellules dissociées de leur environnement, l’expression de leurs protéines peut changer. De plus, les données sur les interactions protéiques entre les cellules peuvent être perdues.
- Les données sur la morphologie cellulaire, ainsi que sur l’emplacement des marqueurs moléculaires sur la cellule, ne sont pas accessibles.
- Le stress causé aux cellules pendant la cytométrie en flux peut avoir un impact sur leur capacité à continuer à se développer après l’analyse. Souvent, un grand nombre de cellules ne survivent pas au processus.
- Les outils de mesure utilisés dans un cytomètre en flux font que la visualisation est limitée aux données quantitatives affichées dans les graphiques. L’évaluation visuelle des cellules est impossible.
En raison de ces inconvénients, l’analyse par cytométrie en flux est souvent complétée par une coloration immunohistochimique des cellules dans leur environnement. Toutefois, la plupart des outils d’analyse d’images utilisés avec cette coloration ne peuvent pas fournir le même niveau de données quantitatives que la cytométrie en flux, et les caractéristiques structurelles des cellules individuelles ne peuvent pas être corrélées individuellement à leur analyse par cytométrie en flux.
La cytométrie en image, un domaine en expansion, répond à ces problèmes en utilisant des outils d’analyse d’images qui peuvent fournir des données quantitatives sur les populations équivalentes à celles de la cytométrie en flux. Notre station de criblage à haut contenu scanR et le logiciel associé sont des exemples d’outils qui peuvent répondre à ces besoins.
Avantages de la cytométrie en image
En cytométrie en image, les cellules sont photographiées directement dans leur environnement de culture, puis les images sont traitées et traduites en analyses quantitatives sur les paramètres d’intérêt.
Avantages de la cytométrie en image :
- Elle réduit le risque de modifications de l’expression des protéines causée par la dissociation.
- Les données sur la morphologie cellulaire et la localisation des protéines sont conservées et peuvent être intégrées dans des analyses quantitatives. Par exemple, vous pouvez déterminer la population de cellules exprimant des niveaux élevés d’un marqueur particulier dans le noyau.
- Aucun stress physique n’est causé aux cellules pendant l’analyse. De plus, la cytométrie en image peut tirer parti de la technologie de l’intelligence artificielle (IA) pour identifier des cellules et des caractéristiques cellulaires avec très peu ou aucune coloration. La culture des cellules peut donc être poursuivie après l’analyse.
- Les mêmes cellules peuvent être surveillées et suivies dans le temps. Cet avantage peut être utile pour la découverte de médicaments, l’étude de la différenciation cellulaire et plus encore. Par exemple, si un chercheur voulait voir l’effet d’un médicament sur les cellules primaires d’un patient au fil du temps en utilisant la cytométrie en flux, il devrait cultiver et traiter des répliques supplémentaires de l’échantillon pour chaque temps de mesure à cause de la nécessité de dissocier les cellules. Comme les cellules peuvent rester dans un environnement de culture pendant la cytométrie en image, un même échantillon peut être mesuré à plusieurs moments.
Pour les chercheurs qui connaissent bien la cytométrie en flux, l’analyse des données avec la cytométrie en image dans le logiciel scanR est une transition facile, car ce dernier utilise des histogrammes et des nuages de points similaires pour afficher les données. Tout comme dans la cytométrie en flux, il est possible de sélectionner des populations au moyen de fenêtres dans les graphiques pour effectuer des analyses multiniveaux. Mais contrairement à la cytométrie en flux, chaque paramètre évalué peut être corrélé à l’image correspondante afin qu’il soit confirmé visuellement, car les données sont collectées directement à partir des images.
Prenons l’exemple suivant. Dans le logiciel scanR, vous pouvez cliquer sur n’importe quel point de données pour afficher la cellule associée ou créer une galerie d’images à partir d’une population fenêtrée. On peut alors s’assurer visuellement que les populations de cellules sont correctement segmentées et qu’on a identifié les bonnes populations d’intérêt.
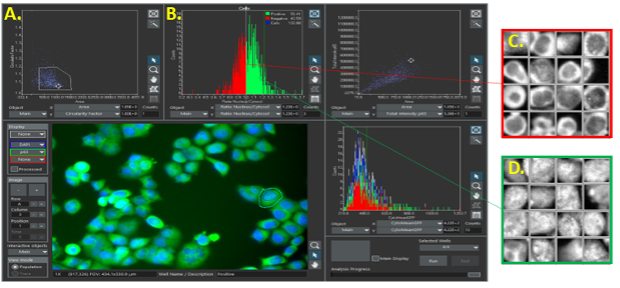
A : Cytométrie en image dans le logiciel scanR. B : Les points identifiés comme des cellules sont fenêtrés puis affichés sous forme d’histogramme.
C et D : Les cellules sont ensuite séparées en deux populations, lesquelles peuvent être visualisées dans des galeries d’images.
En bref, la cytométrie en image avec le logiciel scanR prend certains des meilleurs outils analytiques de la cytométrie en flux et les combine avec les avantages de l’analyse basée sur l’image. Un résumé de ces avantages se trouve dans le tableau ci-dessous :
Comparaison des avantages de la cytométrie en flux et
de la cytométrie en image
| Cytométrie en flux | Cytométrie en image | |
|---|---|---|
| État des cellules | En suspension | Dans un environnement de culture |
| Taille de l’ensemble de données | Illimitée | Illimitée |
| Acquisition et analyse simultanées | ✓ | ✓ |
| Intensité de la fluorescence | ✓ | ✓ |
| Localisation et distribution de la fluorescence | ✓ | |
| Morphologie cellulaire | ✓ | |
| Analyse multiniveau | Limitée | ✓ |
| Tri des cellules | ✓ | |
| Détection sans marquage | Limitée | ✓ |
L’ensemble d’outils polyvalents de cytométrie en image permet aux chercheurs de quantifier et d’évaluer de grandes populations de cellules en fonction de n’importe quelle caractéristique visible dans une image (morphologie, emplacement, intensité et localisation de la fluorescence, etc.) sans nécessiter de manipulation stressante des cellules. Les chercheurs peuvent recueillir des résultats à la fois plus étendus et plus approfondis lors de leurs expériences, ce qui conduit à une recherche de meilleure qualité et plus efficace.
Contenu connexe
Vidéo : Présentation de la station de criblage à haut contenu scanR