Chaque année, notre concours « Image of the Year (IOTY) Global Life Science Light Microscopy Award » récompense les meilleures images de microscopie optique dans le domaine des sciences de la vie. Les images lauréates sont sélectionnées avec soin par un jury international d’experts issus des communautés scientifique et artistique.
Au cours des derniers mois, nous avons passé en revue les images lauréates du concours IOTY 2020 en partageant les histoires derrière chaque image. Jusqu’ici, nous avons partagé les histoires des trois lauréats régionaux des régions Amériques, Asie-Pacifique et EMEA. Il ne nous reste plus qu’une dernière histoire à partager, soit celle du lauréat mondial.
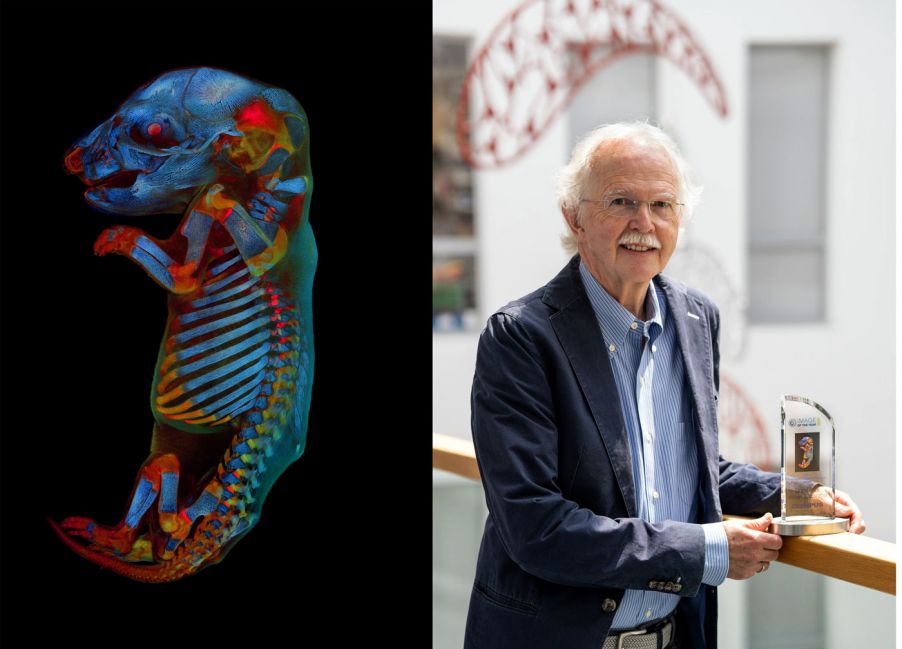
Notre jury a fait de l’Allemand Werner Zuschratter le lauréat mondial pour son image confocale d’un embryon entier de rat. Sur cette image saisissante et riche en couleur, deux canaux montrent des couleurs d'autofluorescence différentes des tissus, tandis que le troisième canal montre le squelette coloré à l’alizarine rouge. Nous avons discuté avec Werner pour en apprendre davantage sur son image lauréate et découvrir sa vision de l’art et de la science.
Q. : Pouvez-vous nous parler de votre parcours ?
R. : J’ai étudié la biologie, en particulier la neurobiologie, à l’université TU Darmstadt. En 1992, j’ai déménagé à Magdebourg, en Allemagne. J’ai alors intégré le Leibniz Institute for Neurobiology (LIN), où je travaille toujours. Je suis aujourd’hui responsable d’un laboratoire dédié à la microscopie électronique et à la microscopie à balayage laser. Le LIN est un institut de recherche spécialisé dans l’apprentissage et la mémoire qui fait appel à de nombreuses techniques d’imagerie pour explorer, à tous les niveaux, les relations structurelles et fonctionnelles de la plasticité (du niveau moléculaire et cellulaire à l’imagerie IRM de petits animaux et de l’homme).
Pour relier les différentes modalités, nous avons ouvert, il y a de cela deux ans, un établissement central appelé Combinatorial NeuroImaging (CNI) Core Facility. Je codirige ce département avec un collègue spécialisé en imagerie humaine. Le CNI fournit des infrastructures et des formations à environ 150 utilisateurs par an. Les scientifiques du CNI conduisent également leurs propres projets de recherche.
Outre l’imagerie à haute résolution et l’observation de processus dynamiques, mes recherches se concentrent sur l’analyse fonctionnelle des processus métaboliques à l’aide de la microscopie de fluorescence résolue dans le temps (FLIM) pour l’imagerie de la nicotinamide adénine dinucléotide (NAD) et de la flavine adénine dinucléotide (FAD). À cette fin, nous avons mis au point un détecteur quantique ultrasensible appelé LINCam.
Q. : Que représente votre image gagnante ?
R. : L’image, qui représente un fœtus de rat, a été enregistrée avec un microscope confocal sous forme de plusieurs empilements d’images (7 x 13 empilements de 168 plans focaux chacun) qui ont ensuite été assemblés pour former une image complète. L’espace mémoire total nécessaire pour l’ensemble de données originales est de 22,9 Go.
Les images individuelles ont été enregistrées séquentiellement dans différentes plages spectrales (bleu, vert et rouge), avec les deux premiers canaux enregistrant l’autofluorescence des tissus et le troisième la coloration du squelette à l’alizarine rouge. L’échantillon a été à l’origine préparé lors d’un précédent projet de recherche pour explorer les effets de médicaments sur le développement embryonnaire.
J’ai réutilisé cet échantillon pour tester la qualité des méthodes de clarification pour faire de l’imagerie de corps entier (avec des microscopes confocaux et à feuillet de lumière), extraire les données d’autofluorescence d’expériences d’imagerie sans marqueur combinées à des marquages histochimiques et discerner différents composants autofluorescents à l’aide de techniques de microscopie spectrales et résolues dans le temps de pointe (par ex., FLIM).
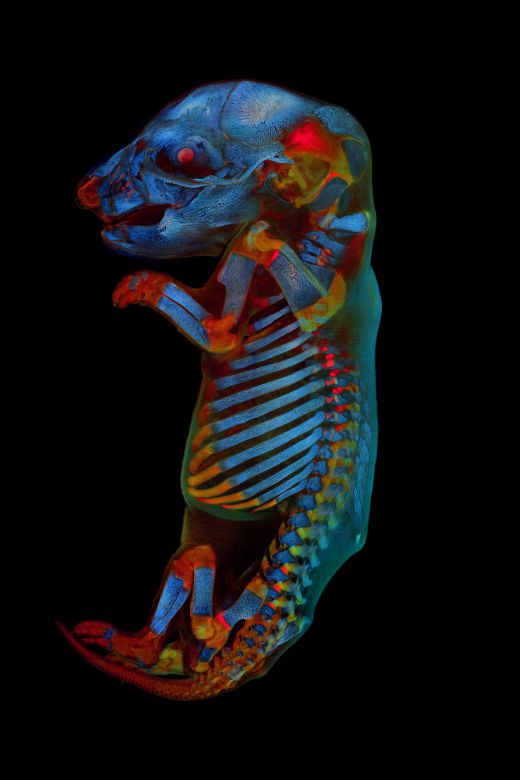
Le lauréat mondial du concours IOTY 2020, Werner Zuschratter, a pris une image confocale
à trois canaux et à grande échelle d’un embryon entier de rat fixé et clarifié.
Voici les détails techniques relatifs aux étapes d’imagerie :
Procédure d’imagerie :
- Numérisation de 7 x 13 empilements de 168 plans focaux chacun tous les 20 µm
- Grossissement : objectif à ON 5 × 0,15
- Valeurs grises : 12 bits
- Taille de l’image : 2329 × 2329 × 3360 µm par empilement
- Résolution en pixels : 512 × 512 par vignette avec un nombre moyen de lignes de 3
- Mémoire requise : 252 Mo par empilement ; 22,9 Go pour tous les empilements
- Excitation : canal 1 : 405 nm ; canal 2 : 483 nm ; canal 3 : 568 nm
- Détection : canal 1 : 430 - 470 nm ; canal 2 : 496 - 541 nm ; canal 3 : 641 - 690 nm
Post-traitement :
Pour le post-traitement (projections selon l’axe Z, assemblage des empilements et ajustement des couleurs/contrastes), j’ai utilisé les logiciels ImageJ/Fiji et Adobe Photoshop.
Q. : Pourquoi avez-vous choisi de soumettre cette image ?
R. : C’est un réel défi que de prendre une image d’un échantillon pratiquement complètement transparent de cette taille entièrement en 3D avec un microscope et de différencier les tissus par leur autofluorescence spécifique (soit par séparation spectrale, soit en fonction de leur durée de vie).
C’est pourquoi nous avons réutilisé d’anciens échantillons initialement préparés pour des études de développement et les avons imagés par microscopie confocale et par microscopie à feuillet de lumière résolue dans le temps. Les numérisations ont produit des images impressionnantes à l’esthétique exceptionnelle et qui incitent également à la réflexion. J’en ai conclu que l’une des images serait assez bonne pour être présentée dans le cadre de ce concours.
Q. : Selon vous, que signifie l’art dans la science ?
R. : C’est un réel défi que de prendre une image d’un échantillon pratiquement complètement transparent de cette taille entièrement en 3D avec un microscope et de différencier les tissus par leur autofluorescence spécifique (soit par séparation spectrale, soit en fonction de leur durée de vie).
À cet égard, la microscopie offre d’innombrables occasions de stimuler la créativité et l’inspiration et d’aiguiser le regard à de nouvelles choses. Par exemple, il y a de cela trois ans, nous avons exposé des images prises par nos utilisateurs au sein d’une galerie d’art afin d’engager le dialogue avec le public sur les thèmes de l’art et de la science. Nous proposons également à nos visiteurs une exposition permanente au sein de notre institut.
Q. : Où et quand avez-vous utilisé un microscope pour la première fois ?
R. : Mon intérêt pour la photographie microscopique est né lors de mes études à l’université TU Darmstadt. À cette époque, il était courant dans le cadre des travaux pratiques de s’asseoir face à un microscope pendant des jours et de dessiner ce que vous observiez à travers loculaires, une méthode que je ne considère plus adaptée pour la collecte de données. Heureusement, mon futur responsable m’a laissé utiliser un microscope de recherche équipé d’une caméra analogique et d’un système de mesure de l’exposition automatique.
Lors de ma thèse doctorale, j’ai pu découvrir le monde de la microscopie électronique. Avec l’avènement des microscopes confocaux dans les années 1990, l’amélioration des fluorophores et l’arrivée des techniques de marquage biologique moléculaire, je me suis de nouveau intéressé à la microscopie optique et, notamment, aux processus dynamiques à l’aide de l’imagerie de cellules vivantes.
Étant donné que l’imagerie fonctionnelle des cellules vivantes doit utiliser peu de lumière pour réduire au maximum la phototoxicité, notre institut a concentré ses recherches sur les processus d’imagerie ultrasensibles fondés sur le principe du comptage de photons uniques. Au final, ces efforts ont permis de mettre au point une nouvelle caméra pour la microscopie FLIM, à savoir la LINCam.
Q. : Quels microscopes utilisez-vous pour votre travail, et qu’aimez-vous dans les microscopes Olympus ?
R. : Outre un microscope électronique, notre département possède de nombreux microscopes à fluorescence. Aussi, nous possédons plusieurs microscopes FLIM, STED, à feuillet de lumière et confocaux provenant de différents fabricants.
Cependant, les microscopes Olympus présentent une structure modulaire et une grande transparence et sont dotés d’optiques de très grande qualité, ce qui est appréciable. Pour ces raisons, nous utilisons un microscope inversé IX81 d’Olympus avec microscopie de fluorescence par réflexion totale interne dans l’une de nos configurations FLIM. En outre, l’un de nos microscopes à feuillet de lumière est basé sur un microscope à zoom MVX10 d’Olympus. Lors d’une récente visite au siège social européen d’Olympus à Hambourg en Allemagne, nous avons pu tester notre LINCam sur un microscope confocal à disque rotatif SpinSR10 et voir les excellentes performances et possibilités dont dispose ce système pour les applications 3D FLIM.
Q. : Y a-t-il quelqu’un que vous aimeriez remercier pour son soutien ?
R. : Tout d’abord, j’aimerais remercier les membres du jury pour tout ce que ce prix mondial du concours IOTY représente. J’aimerais également remercier mon équipe du CNI Core Facility pour leur coopération exemplaire.
La recherche des meilleures images de microscopie optique continue
Les histoires qui se cachent derrière les images lauréates du concours IOTY continuent de nous inspirer et de pousser à voir les merveilles qui se cachent sous le microscope. Si vous souhaitez partager vos propres images de microscopie, nous vous encourageons à soumettre vos plus beaux clichés (jusqu’à trois images) dans le cadre de notre concours IOTY 2021 !
Et pendant que vous êtes encore là, n’oubliez pas de télécharger notre collection d’images IOTY pour vous aider à trouver l’inspiration. Trouvez des fonds d’écran virtuels pour ajouter un fond à vos réunions en ligne ou un fond d’écran à vos écrans de téléphone portable et d’ordinateur.