Vous avez été tenu éloigné de vos recherches à cause de la fermeture de votre laboratoire, de congés ou d’une urgence. Peu importe la situation, le retour au laboratoire après un certain temps peut s’avérer intimidant. Comment vous organiser, préparer vos expériences et atteindre vos objectifs ?
Pour vous aider à préparer votre retour au laboratoire, nous avons rédigé ce guide en quatre étapes pour redémarrer vos expériences
1. Mise sous tension de l’équipement
Cela peut paraître anodin, mais une mise sous tension incorrecte de votre équipement peut avoir un impact négatif sur les performances de votre système. Voici quelques recommandations générales à suivre :
- Mise sous tension de l’ordinateur : votre ordinateur étant le « cerveau » de votre système de microscopie, la première chose à faire est de l’allumer et de vous y connecter.
- Mise sous tension de tous les composants du système : en fonction de votre système, l’ordre dans lequel vous mettez sous tension les composants peut être important. Par exemple, le boîtier de commande (CBH) des systèmes Olympus doit être mis sous tension avant le contrôleur à panneau tactile (TPC). Consultez votre guide d’utilisation pour obtenir des instructions précises.
- Lancement du logiciel : si le lancement du logiciel provoque des erreurs, nous sommes là pour vous aider. Contactez votre représentant commercial ou contactez-nous pour obtenir une aide technique.
2. Préparation pour l’imagerie
Une fois votre équipement mis sous tension, prenez le temps de correctement préparer, charger et mettre d’aplomb l’échantillon en vue de l’imagerie. Voici quelques conseils utiles :
Préparation de l’échantillon
Tout d’abord, choisissez la lamelle couvre-objet adaptée. Les lamelles couvre-objet doivent présenter une épaisseur de 1,5 ou 0,17 mm (170 µm). Pour les objectifs Olympus conçus pour les observations avec lamelles couvre-objet, les lamelles doivent avoir la bonne épaisseur si vous voulez acquérir des images de bonne qualité. Si la lamelle couvre-objet est trop épaisse ou trop fine, des artefacts optiques peuvent apparaître.
Assurez-vous d’avoir vérifié l’épaisseur de vos lamelles couvre-objet et d’utiliser des lames en verre standard. Pour certaines applications, des lames en plastique peuvent être utilisées. Le plastique est cependant très autofluorescent et donc déconseillé pour l’imagerie de fluorescence. Les lames en plastique produisent un fort bruit de fond dans les teintes bleues, vertes et, parfois, rouges.
Il est également important de nettoyer la lamelle couvre-objet et la lame avant toute application d’imagerie. Nous vous conseillons de les nettoyer à l’éthanol dilué à 70 % dans de l’eau distillée. Vous pouvez aussi utiliser un nettoyant optique tel que le Sparkle Optical Lens Cleaner offert par A.J. Funk and Co.
Pour le nettoyage des composants optiques, utilisez toujours du papier d’optique. En effet, les mouchoirs en papier ou les lingettes de laboratoire sont abrasifs et peuvent endommager les surfaces optiques.
Chargement de l’échantillon
Ensuite, chargez l’échantillon préparé dans le bon sens pour votre microscope. Chargez toujours les lamelles couvre-objet orientées vers le haut sur un microscope droit et vers le bas sur un microscope inversé.
Avec les microscopes inversés, il est important de vérifier que votre échantillon est correctement scellé. Si l’échantillon n’est pas correctement scellé, du liquide peut s’écouler sur vos objectifs ou la tourelle porte-objectifs. Ce liquide peut être corrosif ou oxyder les revêtements optiques, la colle optique ou tout autre pièce ou composant électronique du microscope.
Lors du chargement de l’échantillon, apportez une attention toute particulière à la distance de travail de l’objectif. La distance de travail est la distance à laquelle l’objectif doit se rapprocher de l’échantillon pour que ce dernier soit net. Les distances de travail peuvent varier d’un peu plus de 100 µm à plusieurs millimètres.
Avez-vous besoin de connaître la distance de travail de votre objectif ? Consultez simplement les caractéristiques techniques inscrites sur l’objectif ou notre catalogue d’objectifs en ligne.

Figure 1. Sur les microscopes inversés, les lames doivent être chargées avec la lamelle orientée vers le bas. Une erreur courante consiste à charger les lames sur un microscope inversé avec la lamelle orientée vers le haut, ce qui conduit à l’acquisition d’images floues. Vérifiez que les surfaces optiques sont propres et utilisez un papier d’optique pour nettoyer ces surfaces.
Mettre l’échantillon d’aplomb
La plupart du temps, les chercheurs n’ont pas besoin de s’inquiéter de la planéité de l’échantillon. La platine est fixe et plane, le porte-échantillon est plan et la lame est plane.
Cependant, lors d’applications plus sensibles telles que la microscopie confocale, la microscopie de fluorescence par réflexion totale interne (TIRF) ou la production de mosaïques, la planéité de l’échantillon est essentielle. Lorsque l’échantillon est incliné, des ombres peuvent apparaître. Les ombres peuvent favoriser l’apparition d’artefacts lors de l’assemblage des images ou des variations d’intensité selon la position sur l’image.
Il est possible d’améliorer la planéité de l’échantillon grâce aux vis de réglage situées sur certains inserts de platine. Celles-ci sont en général situées au niveau des coins de l’insert de platine. Des vis de réglage mal alignées sont souvent à l’origine de l’inclinaison de l’échantillon. Si vous pensez que l’échantillon est incliné à cause de l’insert de platine, vous pouvez dévisser complètement ces vis.
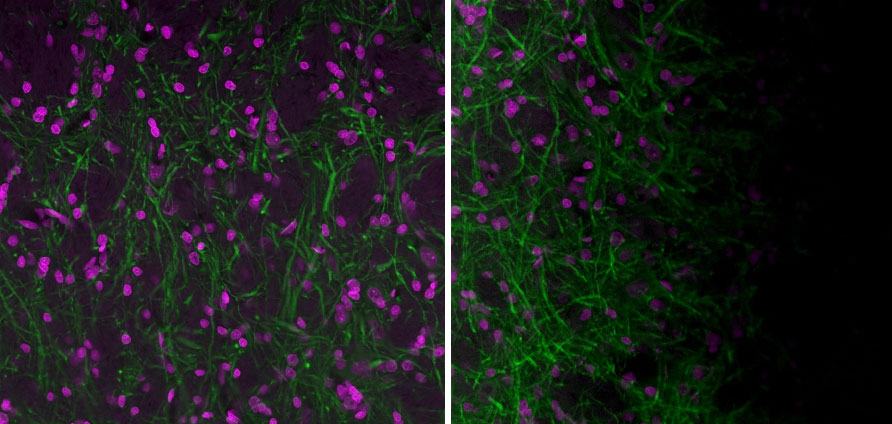
Figure 3. Gauche : image acquise avec un microscope confocal à balayage laser FV3000 d’Olympus correctement aligné et un échantillon plan. Droite : image acquise avec un microscope FV3000 correctement aligné, mais un échantillon qui n’est pas plan. Il est souvent difficile de déterminer la source des artefacts d’ombre. Un échantillon qui n’est pas d’aplomb sur le porte-échantillon est souvent à l’origine de l’apparition d’artefacts d’ombre. Images acquises avec un objectif UPlanXApo 20x. La couleur magenta est due à l’Hoechst, un fluorophore, et la couleur verte correspond au marquage de MAP2 (MCA-5H11) à l’Alexa 488.
Détermination de votre milieu d’immersion
Olympus propose cinq types d’objectifs : à sec, immersion dans l’eau, trempage dans l’eau, immersion dans l’huile et immersion dans l’huile de silicone. Si le mauvais milieu d’immersion est utilisé avec l’objectif, la qualité de l’image sera moins bonne. En outre, des dégâts peuvent être causés si de l’huile pénètre à l’intérieur de certaines pièces d’un objectif non conçu pour être utilisé dans l’huile.
Pour toutes ces raisons, il est important de connaître pour quel milieu d’immersion vos objectifs ont été conçus. Nos objectifs portent un code couleur de sorte que vous puissiez rapidement connaître le milieu d’immersion à utiliser.
De surcroît, pensez à la façon dont vous menez votre observation. Il n’est pas souhaitable d’acquérir des images à un grossissement de 60X avec un objectif à immersion dans l’huile, puis de passer directement à un objectif à immersion dans l’eau à grossissement de 60X. En effet, le mélange de l’huile de silicone et de l’eau ne vous permettra pas d’obtenir des images nettes. En outre, la lame devra être retirée et nettoyée avant d’utiliser l’immersion dans l’eau.
Enfin, assurez-vous d’utiliser de l’huile commercialisée par le fabricant d’objectifs, celle-ci étant la mieux adaptée à vos objectifs.

Figure 4. Huile standard ou huile d’immersion de type F (gauche) et huile de silicone pour immersion (droite). Olympus propose une large gamme d’objectifs pour l’immersion dans l’huile standard et quelques-uns pour l’immersion dans l’huile de silicone. L’utilisation de la bonne huile est essentielle pour la réussite de l’imagerie. Évitez de mélanger ces deux huiles sur une lamelle porte-objet.
3. Acquisition d’images
Maintenant que votre échantillon est prêt, vous pouvez passer à l’étape d’acquisition des images. Voici quelques conseils utiles pour la prise d’images :
Meilleures pratiques pour l’acquisition d’images
Lors de l’acquisition d’images en microscopie à champ large ou confocale, il est préférable d’utiliser un éclairage faible et un gain et une sensibilité de détection accrus. Cela permet de réduire l’éclairement énergétique du laser ou de la lampe à arc à l’origine du photoblanchiment et des altérations en biologie.
Certains canaux ioniques et certaines voies de l’apoptose peuvent être activés par la lumière d’excitation. Il est toutefois nécessaire d’utiliser une quantité de lumière suffisante pour acquérir une image de qualité adéquate. Un éclairage intense permet de produire des images de bonne qualité. Pensez à comment trouver l’équilibre entre la lumière d’excitation, la lumière de détection et l’objectif de l’expérience.
Bague de correction
Certains de nos objectifs sont dotés d’une bague de correction, dont l’utilisation peut être déroutante en l’absence d’une formation adaptée. Les recommandations générales sont les suivantes :
- Utiliser 0.0 en l’absence de lamelle couvre-objet ou 0,17 pour les lamelles porte-objet de type 1.5.
- Vérifier si la bague de correction est marquée pour la température. Certains objectifs sont dotés d’échelles différentes en fonction de la température ambiante ou lorsque la température est de 37 °C (98,6 °F). Réglez la bague de correction, commencez l’imagerie et affinez le réglage de la bague de correction tout en maintenant la mise au point pour optimiser la luminosité des images. Cette dernière étape nécessite de s’exercer. Si l’optimisation est impossible, restez dans un premier temps proche des graduations 0.0 ou 0.17 de la bague de correction.

Figure 5. Trois objectifs 60X. L’objectif 60X UplanXApo (droite) utilise une huile standard et n’est pas doté d’une bague de correction. L’objectif à immersion dans l’huile UplanApo 60X (gauche) est doté d’une bague de correction réglée sur 0.17 (lamelles couvre-objet de type 1.5). L’objectif UPlanSApo 60X (milieu) utilise de l’huile de silicone et est doté d’une bague de correction réglée sur 0.17 (type 1.5) à 37 °C (98,6 °F). L’optimisation du réglage de la bague de correction peut être décisive pour acquérir une image nette.
Alignement du condenseur
Si vous utilisez principalement la fluorescence, vous n’avez pas besoin du condenseur. Dans ce cas, utilisez les boutons du condenseur pour écarter le condenseur de l’échantillon.
Si vous projetez de faire des images en fond clair, en contraste de phase ou en CID, la première étape à suivre est généralement de vérifier l’alignement du condenseur. En mode fond clair, faites la mise au point sur l’échantillon, puis fermez le diaphragme de champ pour visualiser les lamelles du condenseur. Cette procédure est plus facilement réalisée avec un grossissement de 10X ou 20X.
Si les lamelles du condenseur ne sont pas nettes ou centrées, alignez le condenseur en hauteur et/ou centrez-le en utilisant la méthode de Köhler. Pour trouver plus d’informations sur l’alignement du condenseur par la méthode de Köhler, visitez notre centre de ressources relatif à la microscopie en ligne.
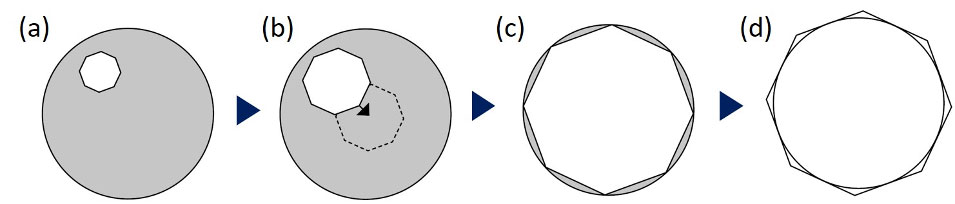
Figure 6. Procédure d’alignement du condenseur : (a) fermer le diaphragme de champ, (b) centrer le centre des lamelles du diaphragme d’ouverture, (c) vérifier que le centre est bien centré en ouvrant le diaphragme d’ouverture jusqu’à ce que les lamelles s’inscrivent dans la circonférence du champ de vision, (d) puis ouvrir davantage jusqu’à ce que les lamelles encerclent le champ.
Taille des fichiers
Les fichiers de microscopie peuvent être assez volumineux. Vous pouvez toutefois prendre certaines mesures pour réduire la taille des fichiers. Par exemple, si vous n’avez pas absolument besoin des données, évitez d’acquérir tout « au cas où » pour ne pas vous compliquer la vie.
Acquérez les images dont vous avez besoin avec la résolution, la profondeur de bits et le champ de vision requis. Évitez d’acquérir trop ou trop peu d’images. En effet, lorsque vous acquérez des fichiers plus grands que nécessaire, vous créez une charge non souhaitée pour le stockage des données et le traitement des données.
Stockage des fichiers
Enregistrer les fichiers dès que possible. Les défaillances d’ordinateur et de disque dur pouvant survenir à tout moment, enregistrez vos fichiers sur plusieurs supports différents.
Soyez précautionneux lors de l’utilisation d’une clé USB ou d’un disque dur externe. Ceux-ci sont facilement infectés par des virus informatiques ou des logiciels malveillants et peuvent les propager d’un ordinateur à un autre.
Il est alors possible que vous ne vous rendiez pas compte de suite que l’ordinateur du système d’imagerie est infecté. Le système peut être lent ou tomber en panne de manière inopportune. De nombreux systèmes d’imagerie ne possèdent pas de logiciel antivirus capable de maintenir leur niveau de performances. Par conséquent, les ordinateurs des systèmes d’imagerie se retrouvent facilement infectés par des virus.
Pour réduire les risques, analysez les disques durs externes avant de les brancher sur l’ordinateur du système d’imagerie.
Formats de fichier
Olympus utilise des formats de fichier propriétaires tels que OIR, OIF, VSI et OIB. Ces formats :
- Offrent des images pleine résolution non compressées
- Maintiennent l’architecture des fichiers de sorte qu’elle reste compatible avec le système d’imagerie Olympus
- Enregistrent des métadonnées à partir des paramètres d’imagerie
Les packs FIJI/ImageJ permettent d’ouvrir ces fichiers Olympus dès lors que les bons plug-ins sont installés. Nous vous recommandons de conserver les images au format Olympus si possible. Toutefois, gardez à l’esprit qu’il est parfois nécessaire d’exporter les fichiers au format TJFF, JPEG 2000 ou autre.
Veuillez noter qu’il est possible que l’image soit compressée et que la résolution d’image soit réduite au moment d’exporter le fichier ou de changer le format dudit fichier. Évitez d’utiliser des images JPEG car ces images sont souvent compressées. De plus, cela s’accompagne souvent d’une perte des données.
4. Arrêt du système
Arrêter correctement votre système est tout aussi important que de bien l’allumer. Voici quelques conseils pratiques :
Nettoyage du système de microscope après utilisation
Une fois l’acquisition des images terminée, le nettoyage du système n’est pas seulement une marque de politesse, c’est une opération essentielle pour éviter d’endommager les composants du microscope.
Par exemple, l’huile d’immersion standard peut sécher et durcir s’il en reste sur les objectifs. Cette huile restée pendant plusieurs jours sur les objectifs est difficile à nettoyer et peut même se répandre sur d’autres surfaces du microscope. Apprenez à nettoyer les lentilles d’objectifs en consultant notre article Six conseils pour éliminer correctement l’huile d’immersion de vos objectifs.
Il n’est pas rare de retrouver des traces de vernis à ongles ou de réactifs de clarification corrosifs provenant des lames sur la platine ou la zone d’imagerie. Veillez à nettoyer ces surfaces, notamment celles sur lesquelles vous voyez des traces de liquide ou tout autre résidu. Les surfaces principalement concernées comme les oculaires, le contrôleur à panneau tactile et les manettes de mise au point sont toutes des surfaces potentielles de contamination et d’infection entre les utilisateurs.
Le nettoyage de ces surfaces est particulièrement important pour éviter la propagation des virus. Nous recommandons d’utiliser une solution d’éthanol dilué à 70 % dans l’eau distillée sur du papier d’optique pour nettoyer le contrôleur à panneau tactile et les oculaires. Assurez-vous d’avoir enlevé l’œilleton en caoutchouc situé autour de chaque oculaire pour éviter d’endommager le caoutchouc avec la solution d’alcool. Nous recommandons également de nettoyer la platine, la table à air ou la paillasse avec la solution d’éthanol dilué à 70 % dans l’eau distillée et de l’essuie-tout.
La bonne attitude à avoir est de laisser le système de microscope dans un meilleur état que celui dans lequel vous l’avez trouvé. Retirez tout échantillon du microscope une fois l’acquisition des images terminée. La plupart des échantillons se conservent mieux à 37 °C, à température ambiante, à 4 °C, à -20 °C ou à -80 °C. La majorité des lames ou des récipients doivent être rangés pour empêcher toute casse et conservés dans le noir. Certains échantillons doivent être remis dans l’incubateur de culture cellulaire.
Pour obtenir d’autres conseils de nettoyage, lisez notre guide : Comment nettoyer et désinfecter votre microscope.
Mise hors tension du système de microscopie
L’exécution correcte de l’arrêt du système permet :
- De garantir une bonne maintenance du matériel
- De s’assurer que le système est prêt pour l’utilisateur suivant
Avant d’arrêter le système, vérifiez la date de la prochaine utilisation du système. Si le système doit être utilisé immédiatement, déconnectez-vous, mais laissez le système allumé. S’il n’est pas utilisé avant une heure, il est conseillé d’éteindre complètement le système. Cela permet de diminuer la durée d’utilisation des lasers, des lampes, des ventilateurs et de tout autre composant qui doit être remplacé et entretenu en fonction de sa durée de fonctionnement.
Quittez toujours le logiciel avant d’éteindre les composants du système. Par exemple, si vous éteignez le boîtier de commande du microscope avant de quitter le logiciel, cela peut entraîner une erreur et d’éventuels problèmes pour l’utilisateur suivant. Gardez toujours à l’esprit que le logiciel est le cerveau du système d’imagerie.
Guide rapide de résolution des problèmes pour accompagner votre retour au laboratoire
Si vous rencontrez des problèmes d’imagerie, nous sommes là pour vous aider ! Voici quelques solutions à des problèmes qu’un microscopiste peut rencontrer à son retour au laboratoire :
Problème 1 : mon image est floue. Je peux faire la mise au point sur l’échantillon, mais l’image n’est jamais nette.
Suggestions : utilisez du papier d’optique pour nettoyer les objectifs, la lamelle porte-objet ainsi que les oculaires avec une solution d’éthanol dilué à 70 % dans de l’eau distillée. Assurez-vous que vous utilisez des lamelles couvre-objet de type 1.5. Enfin, vérifiez que vous utilisez le milieu d’immersion adapté à l’objectif utilisé.
Problème 2 : lorsque je change d’objectif, je perds totalement la mise au point.
Suggestions : vérifiez que les corrections parfocales sont définies dans le contrôleur à panneau tactile (TPC) ou le logiciel, le cas échéant. Assurez-vous que les objectifs sont correctement vissés. Vérifiez si l’objectif doit être utilisé avec un milieu d’immersion, si vous utilisez le bon milieu d’immersion et que celui-ci n’est pas mélangé à un autre milieu. Il n’est pas anormal de devoir procéder à des réglages de la mise au point lorsque vous passez d’un faible à un fort grossissement. Toutefois, si vous perdez la mise au point lorsque vous passez d’un fort à un faible grossissement, cela peut indiquer un problème lié à la parfocalité.
Problème 3 : lorsque je regarde mes images de fluorescence, celles-ci sont lumineuses d’un côté et sombres de l’autre. Je pense qu’il y a un problème.
Suggestions : En premier lieu, vérifiez que ce côté lumineux et ce côté sombre continuent d’apparaître lorsque vous déplacez la platine ou l’échantillon sur l’axe des abscisses et l’axe des ordonnées. Si ce problème persiste, il se peut que votre échantillon ne soit pas d’aplomb. Si l’échantillon est d’aplomb, il est possible que le laser ou la lampe à arc ne soient pas correctement alignés. Si le problème semble venir du laser ou de la lampe à arc, contactez notre assistance avant d’essayer d’aligner le trajet optique de la lumière d’excitation de fluorescence. Contactez votre représentant commercial ou le centre d’assistance technique Olympus.
Problème 4 : lorsque j’ouvre mes images dans un autre logiciel, celles-ci ne sont pas aussi belles que lorsque je les ouvre dans le logiciel Olympus.
Suggestions : pouvez-vous ouvrir les fichiers sur une autre installation du logiciel Olympus ? La manière la plus simple de ne pas dégrader la résolution ou les métadonnées est d’utiliser les solutions logicielles Olympus. Si le logiciel d’analyse est compatible avec les formats de fichiers TIFF ou génériques, utilisez alors les fichiers bruts au format TIFF pleine résolution. Ces fichiers bruts au format TIFF s’affichent généralement en noir s’ils ne sont pas ouverts avec un logiciel d’imagerie. En outre, certains logiciels Olympus interpolent lors de l’application d’un zoom sur l’image. Toutefois, tous les logiciels ne sont pas capables d’interpoler les pixels lors de l’application d’un zoom suffisant. C’est pourquoi les images peuvent parfois s’afficher de manière différente dans le logiciel Olympus par rapport au pack FIJI/ImageJ.
Problème 5 : mon laboratoire utilise des lamelles couvre-objet de type 1 depuis des années, et nous en avons encore beaucoup. En quoi est-ce important pour nous de passer aux lamelles couvre-objet de type 1.5 ?
Suggestions : les objectifs Olympus sont conçus pour les lamelles couvre-objet de type 1.5 à moins que les objectifs utilisés ne soient à trempage dans l’eau. En l’absence d’une épaisseur suffisante de verre entre l’objectif et l’échantillon, des artefacts optiques apparaîtront. L’inconvénient de ces artefacts dépend de l’expérience réalisée et de la finalité des images. Quoi qu’il en soit, la résolution de vos images ne sera pas aussi optimale qu’elle pourrait l’être. Nous vous recommandons de remplacer dès que possible vos lamelles actuelles par des lamelles couvre-objet de type 1.5.
Contenu connexe
Guide pour un retour au laboratoire dans de bonnes conditions
.jpg?rev=4C75)
