Analyse 3D d’organoïdes tumoraux dérivés de patients
Des images confocales d’organoïdes dérivés de patients (PDO) ont été analysées de manière quantitative à l’aide du logiciel 3D NoviSight™ pour évaluer leurs caractéristiques morphologiques ainsi que la liaison d’anticorps thérapeutiques.
Introduction
Les modèles de tissus 3D sont idéals pour la recherche de nouveaux médicaments, car ils permettent de restituer le microenvironnement in vivo. Les PDO constituent l’un des outils les plus puissants pour reproduire la réponse aux médicaments des patients dont ils sont issus. De fait, une étude récente a révélé que les profils phénotypique et génotypique des PDO présentent un degré de similarité important avec la tumeur d’origine du patient. Mais surtout, les PDO pourraient permettre de prévoir la réponse aux médicaments avec plus de 80 % de fiabilité.
Nous avons développé une nouvelle procédure pour l’étude de la morphologie des PDO et la distribution des médicaments utilisant des organoïdes tumoraux dérivés de patients de Fukushima (F-PDO®), le microscope confocal à balayage laser FLUOVIEW® FV3000 et le logiciel d’analyse 3D NoviSight d’Olympus.
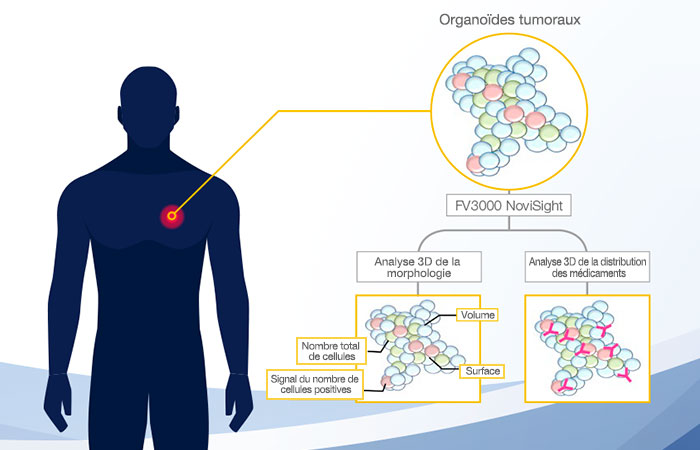
Schéma récapitulatif
Avantages
- Prendre des images des PDO et les analyser tout en préservant les caractéristiques de leur structure 3D.
- Le logiciel NoviSight permet d’identifier les objets 3D, de classer lesdits objets et de produire des données statistiques.
Méthodes
Préparation des cellules
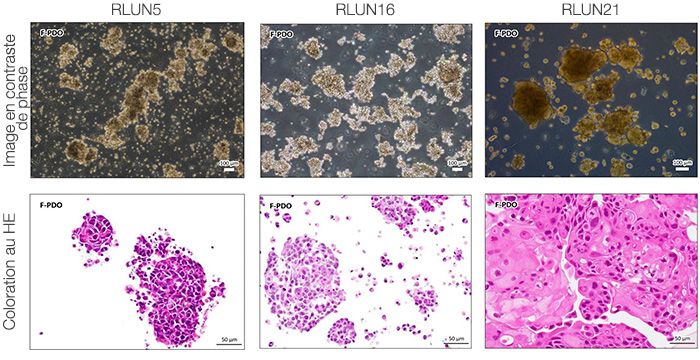
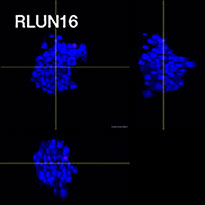
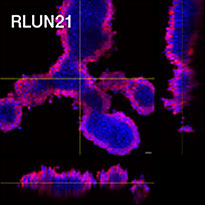
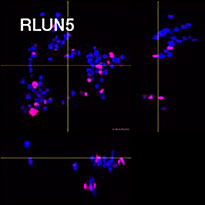
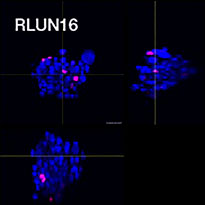
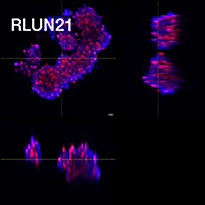
Pour préparer les cellules, nous avons utilisé trois types de F-PDO pulmonaires (RLUN5, RLUN16 et RLUN21). Le F-PDO RLUN5 a été cultivé à partir d’un carcinome adénosquameux tandis que les F-PDO RLUN16 et RLUN21 ont été cultivés à partir d’un carcinome épidermoïde. Le F-PDO RLUN21 forme des agrégats de grandes cellules avec cytoplasme plus grand que celui de cellules des autres organoïdes (fig. 1).
Les F-PDO ont ensuite été centrifugés, collectés et fixés au paraformaldéhyde 4 % pendant une nuit. L’Erbitux®, un inhibiteur du récepteur du facteur de croissance épidermique (EGFR) et l’Herceptin®, un inhibiteur du récepteur 2 du facteur de croissance épidermique (HER2) ont été marqués au Fluor 555 HiLyte™ (Chemical Dojin) et incubés avec des F-PDO pendant trois heures.
Immunomarquage et clarification
Nous avons appliqué le protocole d’immunomarquage de Hama et al. en procédant à quelques modifications (fig. 2). Chaque F-PDO fixé a été incubé pendant une nuit avec un anticorps dirigé contre l’antigène Ki67, un marqueur de prolifération, (Abcam, 16667) puis rincé dans une solution AbScale (0,33 M d’urée et 0,2 % de Triton-X100). Après le rinçage avec la solution AbScale, les F-PDO ont été incubés avec un anticorps secondaire pendant trois heures, puis ils ont été rincés avec la solution AbScale. Après le rinçage avec la solution de rinçage AbScale pendant une heure, les F-PDO ont été à nouveau fixés au paraformaldéhyde à 4 %. Ils ont ensuite été rincés avec un tampon phosphate salin (PBS) et incubés pendant une nuit avec le réactif de clarification ScaleS4 et du DAPI. Des images des F-PDO clarifiés ont alors été prises avec le microscope confocal à balayage laser FV3000 d’Olympus.
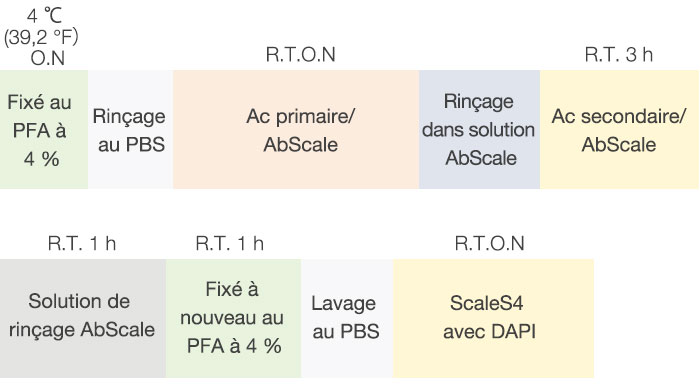
Figure 2 Protocole de clarification et d’immunomarquage des F-PDO
Imagerie et analyse
Pour prendre les images des F-PDO clarifiés en vue d’une analyse 3D, nous avons utilisé le grossissement 10× ou 30× avec un pas sur l’axe Z de 2 μm.
Le choix d’un pas approprié sur l’axe Z est un facteur important pour assurer la précision de l’analyse de cellules 3D. Les images ont ensuite été importées dans le logiciel NoviSight™ et assemblées pour créer une représentation 3D. Le logiciel NoviSight est capable d’identifier des objets 3D tels que des noyaux et de les convertir en données quantitatives.
Résultats
Quantification 3D de la morphologie des F-PDO
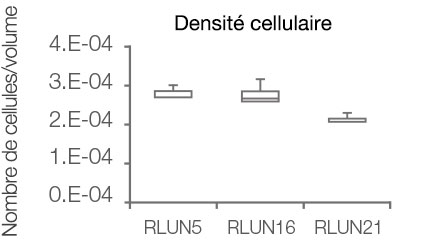
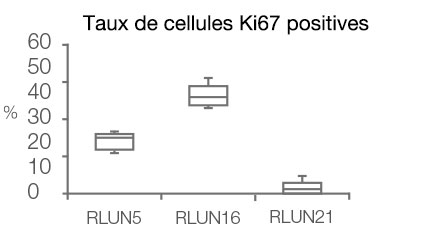
Le logiciel NoviSight nous a permis de quantifier des PDO à partir de plusieurs images de plans Z. Grâce au marquage des noyaux de leurs cellules, le logiciel d’analyse a pu acquérir la structure complète des PDO et en identifier chaque cellule (fig. 3A). Il a également ajouté chaque objet identifié sur le graphique en tant que tracé unique. Une fois que le logiciel avait identifié chaque noyau comme un objet, nous avons extrait les cellules Ki67 positives à la fois graphiquement et en trois dimensions en sélectionnant les pics d’intensité élevée du signal d’immunomarquage par l’anticorps anti-Ki67 (fig. 3B). Grâce à ces méthodes, nous avons pu mesurer le nombre de cellules, le volume, la densité cellulaire et le taux de cellules Ki67 positives des F-PDO (fig. 3C). Nous avons constaté que le taux de cellules Ki67 positives du F-PDO RLUN21 était plus faible que celui des autres F-PDO. Par ailleurs, la faible densité cellulaire du F-PDO RLUN21 est probablement due à la plus grande taille du cytoplasme de ses cellules.
A | |||
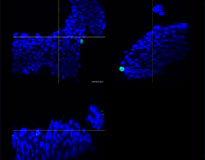 RLUN21 d’origine | 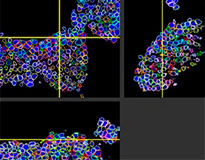 Identification des noyaux | 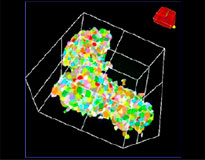 Représentation du volume des noyaux identifiés | 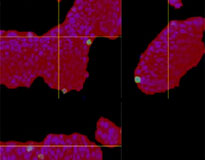 RLUN21 |
B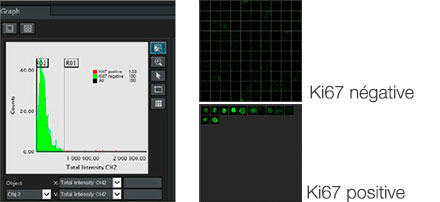 | C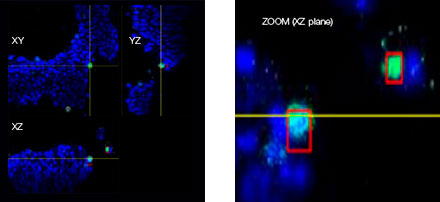 |
D
| RLUN5 | RLUN16 | RLUN21 | |
| Nombre de cellules | 926 (±719) | 294 (±162) | 2595 (±1480) |
| volume (voxels) | 3.35.E+06 (±3.26.E+06) | 1.08.E+06 (±6.85.E+05) | 1.13.E+07 (±9.12.E+06) |
 |  |
| Figure 3 Quantification 3D de la morphologie des PDO |
A. Images originales des trois vues latérales du F-PDO RLUN21, identification des noyaux en 3D par NoviSight (représentations des trois vues latérales et du volume) et identification de la structure par NoviSight.
B. Les cellules Ki67 positives et Ki67 négatives ont été triées selon l’intensité du marquage par l’anticorps anti-Ki67. Le logiciel NoviSight permet d’afficher les cellules triées dans une « galerie d’images ».
C. Les cellules classées comme Ki67 positives peuvent être affichées en 3D avec un cercle rouge.
D. Données quantitatives des F-PDO.
Analyse en 3D de la distribution de médicaments
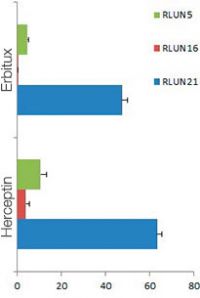
Chaque F-PDO a été incubé avec l’anticorps thérapeutique ’Erbitux ou Herceptin marqué au Fluor 555 Hylight. L’analyse des images révèle que l’Erbitux se lie de manière uniforme à la zone externe du F-PDO RLUN21 tandis que l’Herceptin se lie au F-PDO RLUN21 sans spécificité spéciale. Le module d’identification du volume du logiciel NoviSight™ nous a permis d’évaluer le taux de volume positif au marquage par les anticorps thérapeutiques (fig. 4A). Nous avons ensuite utilisé le logiciel NoviSight pour quantifier les différences entre les profils de liaison des deux anticorps afin d’approfondir notre analyse de leurs zones cibles. Pour ce faire, nous avons créé deux zones cibles : une zone externe à volume réduit entre la surface de l’organoïde et jusqu’à un certain pourcentage de la surface et une zone interne correspondant au volume limité par la zone externe. Nous avons calculé l’intensité du marquage par les deux anticorps thérapeutiques dans les deux volumes. Nous avons ainsi constaté une importante différence quantitative entre le marquage par l’Erbitux du volume externe et celui du volume interne. Cette différence était bien moindre pour le marquage par l’Herceptin. Cela signifie que l’Erbitux se lie préférentiellement dans la zone externe du F-PDO RLUN21 tandis que l’Herceptin se lie uniformément dans tout le F-PDO RLUN21. Cette méthode nous a permis de montrer de manière quantitative la distribution des anticorps.
A
 |
 |
 | Identification du volume marqué par l’anticorps 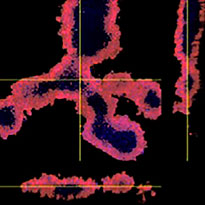 |
 |
 |
 | Identification du volume marqué par l’anticorps 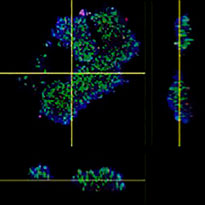 |
Volume positif à l’anticorps (%)
B
 | 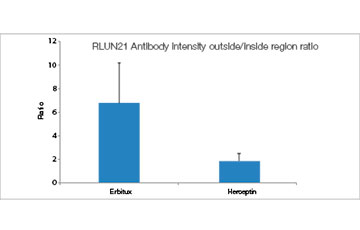 |
| Figure 4 Quantification 3D de la distribution des anticorps |
A. Trois images latérales des F-PDO marqués par l’Erbitux ou l’Herceptin et identification des volumes de liaison des anticorps par le logiciel NoviSight. Le graphique représente le volume de liaison de l’anticorps par rapport au volume total.
B. Module de modification de la région NoviSight. NoviSight permet de modifier la zone cible à analyser pour fournir des données quantitatives sur la zone limitée.
Conclusion
Cette étude montre que le logiciel NoviSight permet de réaliser une analyse quantitative des PDO sur le plan morphologique et pharmacologique à partir d’images acquises à l’aide du microscope confocal à balayage laser FV3000 d’Olympus. Grâce à l’association d’images haute résolution du microscope FV3000 et de la grande précision de l’identification du logiciel NoviSight, nous pouvons produire des résultats quantitatifs plus fiables.
Références
- Vlachogiannis G et al., (2018) Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science. 359(6378):920-926. doi: 10.1126/science.aao2774
- Takahashi et al., (2019) An In Vitro System for Evaluating Molecular Targeted Drugs Using Lung Patient-Derived Tumor Organoids. Cells. 8(5), 481. doi:/10.3390
- Tamura H, et al. Evaluation of anticancer agents using patient-derived tumor organoids characteristically similar to source tissues. Oncol Rep.,40, 635-646, 2018
- Hama et al., (2016) Deep Imaging of Cleared Brain by Confocal Laser-Scanning Microscopy. Nature Protocol Exchange. doi:/10.1038 Mayu
Auteurs
Mayu Ogawa (Olympus)
Remerciements
Cette étude a été financée par le professeur Tagaki de l’université de médecine de Fukushima. Pour en apprendre davantage sur les F-PDO (Fukushima patient-derived organoids, ou organoïdes tumoraux dérivés de patients de Fukushima), visitez le site Internet https://www.fmu.ac.jp/home/trc/en/contract-research-provision/f-pdo/
Produits utilisés pour cette application
a bien été ajouté à vos favoris
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.