Criblage de médicaments à haut débit par analyse spatiale 3D
Des images 3D de sphéroïdes tumoraux acquises à grande vitesse ont été analysées à l’aide du logiciel NoviSight™ afin d’évaluer précisément l’efficacité de médicament sur plusieurs échantillons..
Introduction
L’évaluation de l’efficacité d’un médicament sur des sphéroïdes tumoraux tridimensionnels est d’une grande importance, car ceux-ci ont la capacité de restituer in vitro le microenvironnement complexe des tumeurs in vivo. Les sphéroïdes permettent donc aux chercheurs d’évaluer l’efficacité d’un médicament dans des conditions les plus proches possible de celles de l’environnement naturel
d’une tumeur.. Pour réaliser un criblage de médicaments à grande vitesse sur des sphéroïdes, les chercheurs doivent pouvoir utiliser un protocole simple, un système d’imagerie à grande vitesse semi-automatisé et une analyse 3D sur plusieurs puits.
Au cours de cette étude, nous avons réalisé un test de viabilité des cellules homogène dans une microplaque à 384 puits sans changement de milieu, nous avons pris des images à grande vitesse à l’aide du scanner résonant du microscope confocal FV3000RS et nous avons analysé les images avec le logiciel d’analyse 3D NoviSight. Les sphéroïdes ont été analysés en 3D pour évaluer plus précisément
l’efficacité d’un médicament sur plusieurs échantillons.
Processus
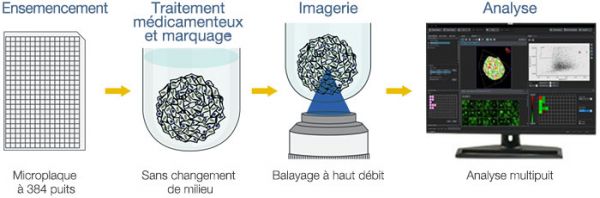
Avantages
- Utilisation d’un protocole simple sans changement de milieu
- Acquisition automatique des images à l’aide d’un scanner résonant à haut débit
- Analyse précise de plusieurs échantillons grâce à l’analyse spatiale 3D
Méthodes
Préparation des cellules
Du milieu Eagle modifié de Dulbecco (DMEM) avec 10 % de sérum de veau fœtal (SVF) a été ensemencé avec des cellules de cancer du col de l’utérus HeLa dans une microplaque à 384 puits à fond plat Corning® (100 cellules par puits), et les cellules ont été cultivées. La microplaque a été délicatement centrifugée pour enlever les bulles d’air.
Préparation des échantillons
Nous avons ajouté aux échantillons de la cisplatine et de la staurosporine (STS) à diverses concentrations différentes et avons laissé les échantillons incuber pendant 24 heures. En exploitant la différence de perméabilité de la membrane cytoplasmique des cellules vivantes et des cellules mortes, nous avons déterminé la viabilité des cellules à l’aide du kit d’imagerie de la viabilité des cellules ReadyProbes™ de Thermo Fisher Scientific® en comptant le nombre total de cellules et le nombre de cellules mortes (nombre total de cellules : bleu/nombre de cellules mortes : vert). Les échantillons ont ensuite été marqués et incubés pendant cinq heures. Cette méthode de préparation simple ne requiert aucun changement de milieu, aucune fixation ni aucun rinçage entre l’ensemencement des cellules et l’imagerie.
Imagerie et analyse
Nous avons acquis des images en fluorescence des sphéroïdes à l’aide du microscope confocal à balayage laser FV3000RS équipé d’un objectif semi-apochromatique LUCPFLN20X. Après avoir défini la zone d’imagerie, le scanner résonant du microscope a acquis de manière automatique les images. Le logiciel NoviSight™ est capable d’importer des données de plusieurs images associées à des informations relatives
à la microplaque, comme la position du puits et l’emplacement de l’échantillon. Une fois les données importées, le logiciel reconstruit les images en 3D. Le logiciel NoviSight reconnaît les objets tels que les noyaux, puis analyse les différents signaux à l’intérieur des objets.
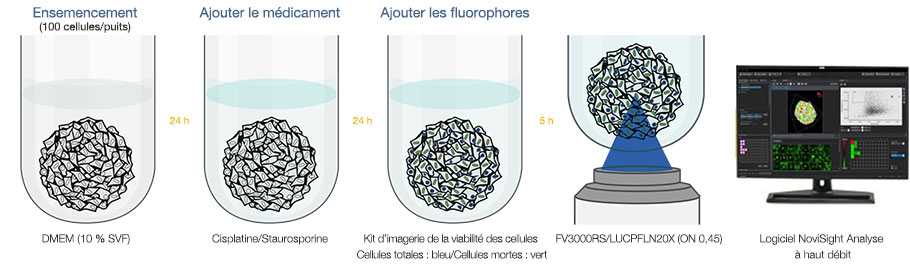
Fig. 1 Méthode de criblage à haut débit de médicaments sans changement de milieu
Résultats
Imagerie 3D à haut débit de plusieurs échantillons
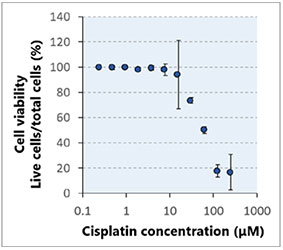
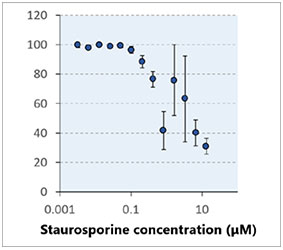
Cela prend environ une minute pour observer un empilement d’images selon l’axe Z d’un seul puits (épaisseur de 2,33 μm, 122 coupes, deux canaux). Le traitement à la cisplatine et à la STS a induit une augmentation du nombre de cellules mortes de manière proportionnelle à la dose (fig. 2*).
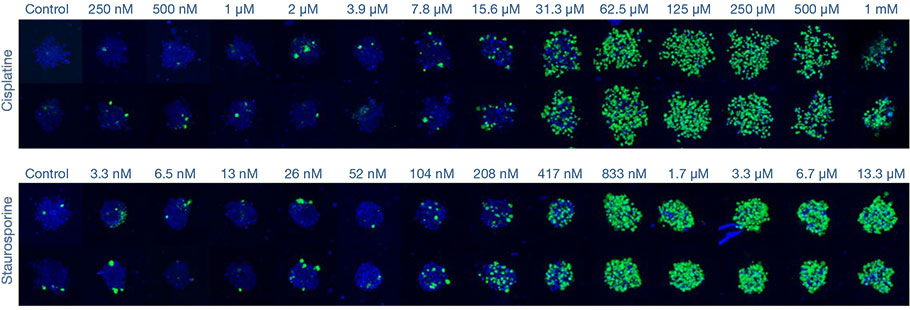
Fig. 2 Imagerie à grande vitesse de la réponse des sphéroïdes aux médicaments*
Analyse 3D à haut débit de la sensibilité des cellules des sphéroïdes aux médicaments
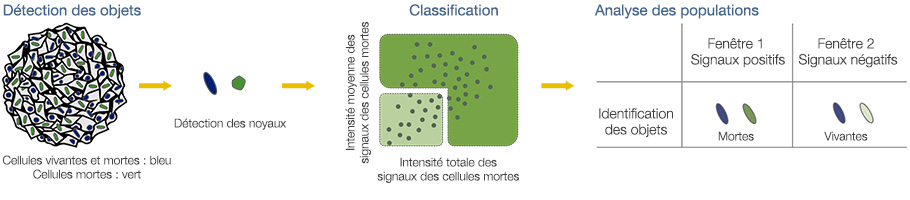
Les noyaux de toutes les cellules sont identifiés par les signaux bleus (fig. 3A*). Toutes les cellules sont ensuite classées en deux catégories, cellules vivantes ou cellules mortes, en fonction de la présence ou de l’absence de signaux verts (signaux positifs : cellules mortes/signaux négatifs : cellules vivantes). Les signaux positifs et négatifs sont classés après vérification de l’image sélectionnée sur le
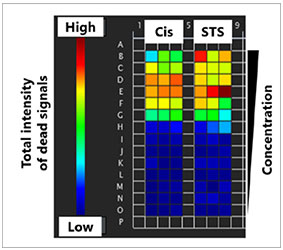
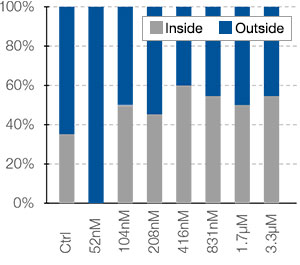
graphique (fig. 3B*). Une fois la classification terminée, vous pouvez facilement vérifier les intensités totales des signaux des cellules mortes présentes dans les sphéroïdes à l’aide de la carte de densité du logiciel (fig. 4A). Le pourcentage de cellules vivantes par rapport au nombre total de cellules est ensuite calculé et représenté graphiquement (fig. 4B). Les résultats indiquent que les cellules HeLa sont
très sensibles aux deux médicaments.
(A)
|
|
|
(B)
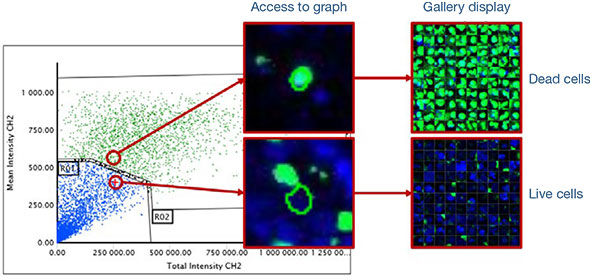
Fig. 3 Identification et classification des objets en fonction des signaux par le logiciel NoviSight™*
(A)
| (B)
|
|
Fig. 4 Carte d’intensité et courbe de réponse en fonction de la dose
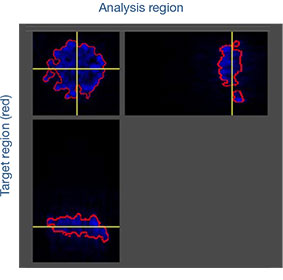
Analyse spatiale à haut débit de la sensibilité aux médicaments
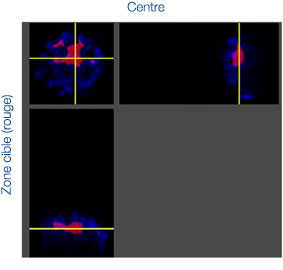
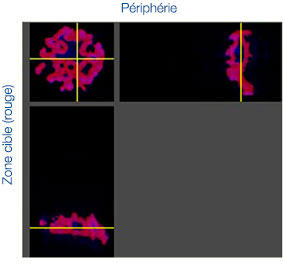
Les images prises au cours de cette étude ont été acquises en trois dimensions afin de procéder à une analyse spatiale approfondie. Avec le logiciel NoviSight™, vous pouvez définir la zone cible à analyser. Nous avons paramétré le logiciel pour qu’il analyse le centre et la périphérie de chaque sphéroïde (fig. 5A). Nous avons ensuite réalisé une analyse des populations de cellules à
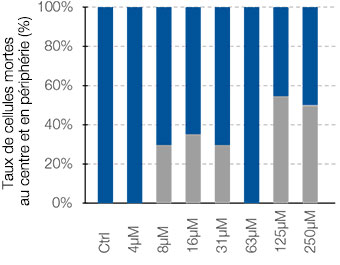
l’intérieur de ces zones. Cette méthode permet de réaliser une analyse spatiale de l’efficacité des médicaments sur un grand nombre de sphéroïdes dans une microplaque avec de nombreux puits. Le logiciel a ensuite calculé le rapport entre le nombre de cellules mortes et le nombre total de cellules au centre et à la périphérie des sphéroïdes (fig. 5B).
Dans le cas étudié, le nombre de cellules mortes a augmenté proportionnellement à la dose appliquée tant au centre qu’à la périphérie des sphéroïdes. Comparée à la cisplatine, la staurosporine est efficace sur les cellules de la partie centrale des sphéroïdes, et ce, même à de faibles concentrations.
(A) |
|
|
(B) |
|
|
Fig. 5. Analyse spatiale approfondie de différentes zones des sphéroïdes par le logiciel NoviSight
Conclusion
Grâce à un protocole simple, à l’imagerie confocale à grande vitesse et au logiciel NoviSight, nous avons pu acquérir des images 3D en haut débit pour classer des cellules de sphéroïdes en fonction de leur viabilité et analyser leur sensibilité à des médicaments. Cette technique d’analyse spatiale permet une meilleure évaluation de l’efficacité de médicaments sur un grand nombre d’échantillons.
Auteur
Hiroya Ishihara, Biological Evaluation Technology 2, Research and Development
*Bien que la lignée cellulaire HeLa soit devenue l’une des plus importantes dans la recherche médicale, nous devons absolument reconnaître que la contribution de Henrietta Lacks à la science s’est produite sans son consentement. Cette injustice, bien qu’elle ait mené à des découvertes clés en immunologie, en maladies infectieuses et en cancer, a également suscité d’importantes conversations sur la confidentialité,
l’éthique et le consentement en médecine.
Pour en savoir plus sur la vie de Henrietta Lacks et sur sa contribution à la médecine moderne, cliquez ici.
http://henriettalacksfoundation.org/
Produits utilisés pour cette application
a bien été ajouté à vos favoris
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.