Comparaison de lignées de cellules souches pluripotentes induites (SPi) humaines à l’aide du système de surveillance de l’incubation CM20 : variations de l’efficacité de la différenciation des organoïdes hépatiques entre les lignées de cellules SPi
Introduction
Les cellules souches pluripotentes induites (SPi) sont largement utilisées tant en recherche fondamentale, notamment en biologie du développement dans les domaines de la différenciation cellulaire et de la formation des organes, qu’en recherche translationnelle, principalement dans la découverte de nouveaux médicaments et la conception d’outils diagnostiques. La technologie utilisée pour la formation de tissus ou d’organes miniatures dérivés de cellules SPi humaines, appelés organoïdes, s’est tellement développée que les tissus tridimensionnels peuvent être utilisés comme des avatars d’organes humains. À ce jour, la majorité des lignées de cellules SPi issues de prélèvements effectués sur des sujets sains et malades du monde entier peuvent être utilisées dans le cadre d’études sur les organoïdes. Ces dernières ont pour objectif de lever le voile sur le contexte génomique des maladies et la prédisposition de chaque patient à telle ou telle maladie en évaluant les différences fonctionnelles et individuelles des organoïdes générés. Cependant, le processus de génération d’organoïdes des organes cibles prend généralement plus d’un mois et est coûteux. Du fait des différences quant à la capacité de différenciation et à la vitesse de prolifération des lignées de cellules SPi utilisées, la stabilité des organoïdes et la reproductibilité de leur génération demeurent une gageure. Il s’agit de l’un des freins au développement des travaux de recherche sur les organoïdes axés sur la comparaison de plusieurs échantillons dérivés de différentes lignées de cellules SPi.
Pour résoudre ce problème, nous avons analysé de manière quantitative des cellules SPi sur une longue période afin de mieux comprendre leurs différences à l’état indifférencié et l’implication de ces différences dans les variations observées entre les lignées cellulaires lors de leur différenciation en organoïdes.
Parmi les lignées de cellules SPi humaines issues de 12 donneurs, la différenciation en organoïdes hépatiques de certaines lignées a souvent échoué malgré le fait que le même protocole de différenciation ait été appliqué à toutes les lignées cellulaires testées. Cette note d’application décrit l’expérience que nous avons menée afin de mieux comprendre le lien entre les propriétés à l’état indifférencié des lignées de cellules SPi avant l’induction de leur différenciation et leur potentiel de différenciation en organoïdes de foie.
Utilisation des données de suivi de cellules SPi collectées par le système CM20 en vue d’évaluer leur différenciation en organoïdes
Le système de surveillance de l’incubation CM20 d’Olympus nous permet de mesurer l’état des cultures et de comparer ces mesures aux précédentes mesures. Le nombre de colonies de cellules SPi et leur densité peuvent facilement être exportés au format de fichier CSV afin de réaliser une analyse plus détaillée.
Au cours de cette étude, nous avons suivi la croissance de lignées de cellules SPi humaines issues de 12 donneurs pendant leur maintien en culture, puis nous avons exporté le nombre de colonies et leur densité en fonction du temps pour chaque lignée cellulaire. Nous avons ensuite appliqué le protocole de différenciation que nous avons récemment mis au point (*1) afin d’obtenir des organoïdes hépatiques. Après un mois environ, nous avons compté le nombre d’organoïdes formés et avons mesuré le taux d’albumine sécrétée pour vérifier la fonction hépatique des organoïdes. Nous avons également comparé, pour chaque lignée cellulaire, les données de croissance des cellules SPi avant différenciation avec les données obtenues avec leurs organoïdes de foie respectifs.
Protocole de culture et analyse des données
Douze lignées de cellules SPi humaines ont été maintenues dans une microplaque à six puits sans cellules nourricières. Près d’une semaine après le repiquage, les cellules ont été dissociées en cellules individuelles avec de l’Accutase et ont ensuite été ensemencées dans une nouvelle microplaque. Elles ont été stimulées avec de l’activine A et de la protéine BMP4 afin de les faire se différencier de leur état indifférencié en endodermes. Nous les avons ensuite traitées avec le facteur de croissance des fibroblastes FGF4 et l’agoniste de la voie Wnt afin d’obtenir des sphéroïdes de l’extrémité postérieure du segment antérieur du tube digestif. Pour passer à une culture tridimensionnelle, nous avons inclus ces sphéroïdes dans du Matrigel, une matrice de membrane basale, puis dans de l’acide rétinoïque (AR) pendant le premier stade de formation des organoïdes. Les cellules ont ensuite été mises en culture dans un milieu de différenciation hépatique pendant un mois environ, ce qui a conduit à la formation d’organoïdes hépatiques (figure 1A).
Nous avons ensuite compté les organoïdes et mesuré par ELISA les concentrations d’albumine sécrétée dans des échantillons de milieu de culture. Nous avons intégré les données relatives à la prolifération des cellules SPi indifférenciées obtenues à l’aide du moniteur CM20 et avons analysé la corrélation entre les caractéristiques de la culture de maintien et l’efficacité de la différenciation en organoïdes de chaque lignée cellulaire SPi (figure 1B).
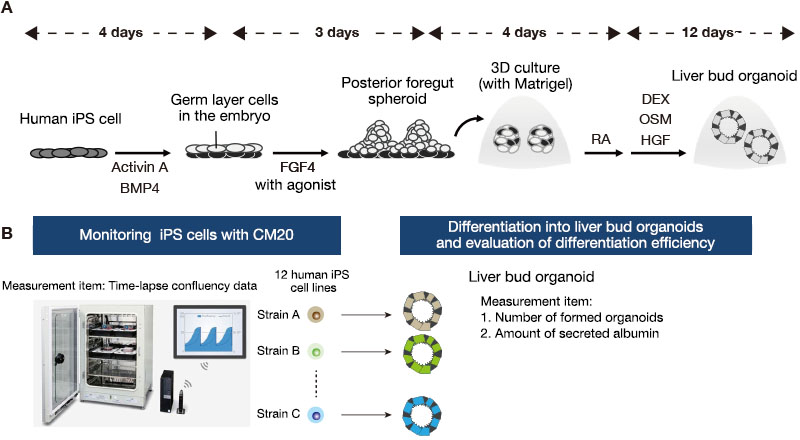
Figure 1. Suivi des cellules SPi humaines pendant la culture de maintien et évaluation l’efficacité de la différenciation en organoïdes hépatiques.
(A) Protocole de culture utilisé pour différencier les cellules SPi humaines en organoïdes hépatiques.
(B) Résumé de l’analyse comparative des caractéristiques pendant le maintien en culture des cellules SPi et de l’efficacité de leur différenciation en organoïdes hépatiques de 12 lignées de cellules SPi issues de donneurs différents.
Suite à de nombreuses tentatives de différenciation des 12 lignées de cellules SPi humaines en organoïdes hépatiques, nous avons été capables d’obtenir des organoïdes à partir de la plupart des lignées cellulaires. Toutefois, la différenciation des lignées de cellules SPi I et J a souvent échoué (figure 2A). Même si les concentrations en albumine sécrétée (quantité sécrétée par organoïde) varient en fonction du lot d’induction de la différenciation, les organoïdes hépatiques issus des lignées de cellules SPi I et J, dont l’efficacité de formation d’organoïdes était extrêmement faible, présentaient eux aussi des niveaux de sécrétion d’albumine faibles (figure 2B). Parmi les lignées de cellules SPi montrant une forte efficacité de formation d’organoïdes, nous avons remarqué que certaines lignées, comme la lignée C, présentent des niveaux de sécrétion d’albumine plutôt faibles. Pour confirmer la différenciation, nous avons vérifié que les organoïdes hépatiques dérivés des lignées de cellules iPS autres que les lignées I et J expriment des marqueurs spécifiques des hépatocytes (données non présentées). Sur les 12 lignées cellulaires testées, ces données ont montré que les lignées de cellules SPi I et J ont une moindre capacité à se différencier en lignée hépatique.
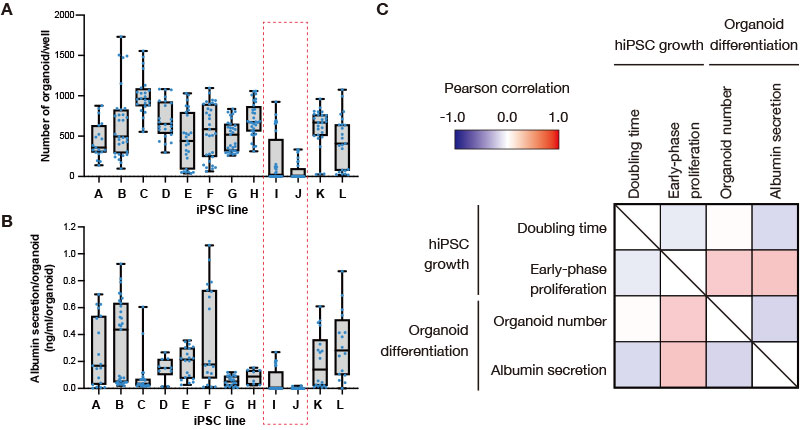
Figure 2. Analyse de la corrélation entre la prolifération des cellules des lignées de cellules SPi humaines avant l’induction de leur différenciation et l’efficacité de leur différenciation en organoïdes hépatiques.
(A, B) Le nombre d’organoïdes hépatiques générés pendant plusieurs expériences d’induction de la différenciation (A) et la concentration en albumine sécrétée (B) ont été représentés sur un diagramme de quartiles pour chaque lignée de cellules SPi. Les points bleus correspondent au nombre de puits mesurés pendant les expériences indépendantes les unes des autres.
(C) Table de corrélation entre les paramètres de croissance des cellules SPi humaines pendant le maintien en culture (temps de doublement et prolifération en phase précoce) et la différenciation en organoïdes hépatiques (nombre d’organoïdes et sécrétion d’albumine).
Ensuite, pour déterminer si l’état des cellules SPi avant l’étape d’induction de la différenciation a un impact sur l’efficacité de la différenciation en organoïdes hépatiques, nous avons analysé la corrélation entre les paramètres de prolifération acquis avec le moniteur CM20, le nombre d’organoïdes formés et leur niveau de sécrétion d’albumine pour chaque expérience d’induction de la différenciation. Nous avons calculé les coefficients de corrélation entre le temps de doublement des cellules SPi avant l’induction de différenciation (calculés grâce aux données de confluence fournies par le moniteur CM20), l’efficacité de la croissance au stade précoce de la prolifération (calculée à partir d’une formule définie par le Dr Takebe), le nombre d’organoïdes hépatiques formés et les concentrations en albumine sécrétée pour chaque expérience. Nous avons déterminé les variations dépendantes du lot en analysant les ensembles de données de chaque expérience (figure 2C). Alors que l’analyse n’a révélé quasiment aucune corrélation entre d’une part le nombre d’organoïdes hépatiques formés et les concentrations d’albumine sécrétée et d’autre part le temps de doublement des cellules SPi, une corrélation a bien été observée avec les paramètres d’efficacité de la prolifération au stade précoce de prolifération des cellules SPi. Cela indique que, bien qu’il ne soit pas possible d’utiliser les faibles différences de temps de doublement entre les lignées de cellules SPi pour déterminer si les organoïdes hépatiques générés sont de bonne ou mauvaise qualité, il est possible que certaines différences observées aux stades précoces de la prolifération des cellules SPi entre les lignées cellulaires ont un impact sur l’efficacité de la différenciation en organoïdes hépatiques.
Conclusion
Les données quantitatives du moniteur CM20 nous ont permis d’obtenir des informations depuis les cultures cellulaires jusqu’à la différenciation en organoïdes et même au-delà. Les images et les données sont faciles à exporter, ce qui permet de réaliser de nombreuses analyses pouvant mener à la découverte de nouvelles informations tout au long du processus de culture.
Lors de cette étude, nous avons appris que l’efficacité de la différenciation des lignées de cellules SPi en organoïdes hépatiques peut être fortement impactée par l’efficacité de la croissance des cellules SPi durant leur maintien en culture, notamment au cours du stade précoce de croissance, d’où sa grande variabilité. Cela suggère que pour générer des organoïdes hépatiques plus stables et de meilleure qualité, il est important de surveiller l’état des cellules SPi juste après le repiquage afin de savoir si elles sont prêtes pour l’induction de la différenciation. D’après cette corrélation, il est également possible de prédire si l’efficacité de la différenciation d’une lignée cellulaire sera bonne ou mauvaise en surveillant l’état de prolifération des lignées de cellules SPi.
Olympus continuera d’utiliser le moniteur CM20 dans le cadre de ses travaux de recherche pour développer des méthodes capables de faciliter le contrôle de la qualité et la gestion des données.
Commentaires du Dr Takebe et du Dr Yoneyama
Dr Takanori Takebe (gauche)
| Lors de l’utilisation de plusieurs lignées de cellules SPi issues de différents donneurs et de l’évaluation des différences entre les donneurs à l’aide d’organoïdes dérivés de ces cellules SPi, nous avons souvent pu observer des variations au niveau de l’efficacité de la différenciation d’une lignée de cellule Spi à l’autre. Les avantages du moniteur CM20, notamment le suivi continu des états de prolifération et la capacité du moniteur à exporter les données, nous ont été très utiles pour réaliser simultanément l’analyse de la corrélation entre la prolifération de 12 lignées de cellules SPi et l’efficacité de leur différenciation en organoïdes. |
Référence :
*1) Ouchi R, Togo S, Kimura M, Shinozawa T, Koido M, Koike H, Thompson W, Karns RA, Mayhew CN, McGrath PS, McCauley HA, Zhang RR, Lewis K, Hakozaki S, Ferguson A, Saiki N, Yoneyama Y, Takeuchi I, Mabuchi Y, Akazawa C, Yoshikawa HY, Wells JM, Takebe T. Modeling Steatohepatitis in Humans with Pluripotent Stem Cell-Derived Organoids. Cell Metabolism, 30(2): 374–384 (2019)
Produits utilisés pour cette application
a bien été ajouté à vos favoris
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.
