Comparaison de lignées de cellules CSPi humaines à l’aide du système de surveillance de l’incubation CM20 : observation de la différenciation des cellules CSP en organoïdes hépatiques i
Introduction
Les cellules souches pluripotentes induites (CSPi) sont largement utilisées dans le cadre de travaux de recherche fondamentale en embryologie, notamment sur la différenciation cellulaire et la formation des organes, mais aussi pour la recherche et le développement de nouveaux médicaments et de méthodes de diagnostic médical. À ce jour, de nombreuses lignées de cellules CSPi ont été établies dans le monde. Toutefois, leurs propriétés, notamment en matière de potentiel de différenciation et de vitesse de croissance, diffèrent d’une souche à une autre. Bien que toutes ces différences soient connues, celles-ci n’ont jamais été quantifiées à partir de cellules ayant toutes été cultivées dans les mêmes conditions ambiantes. Ainsi, il est difficile de déterminer si ces variations sont dues à des différences entre les conditions ambiantes et les procédures des laboratoires ou si elles sont inhérentes aux lignées cellulaires elles-mêmes. Les différences de propriétés entre les cellules différenciées à partir de cellules CSPi ne sont découvertes qu’à la fin de la culture et peuvent être dues à des anomalies présentent dans les cellules dont la différenciation a été induite. Dans ce contexte, il est essentiel de disposer d’un outil capable de surveiller les cellules CSPi sur le long terme et de garantir un contrôle de la qualité et une gestion des données efficaces dès le début du processus jusqu’à l’induction de la différenciation.
Analyse des données quantitatives des cultures cellulaires à l’aide du système de surveillance de l’incubation CM20
Grâce aux mesures quantitatives fournies par le système de surveillance de l’incubation CM20 Olympus, nous avons analysé les points de contrôle responsables des différences observées dans la genèse des organoïdes par les cellules CSPi et établi une méthode d’analyse du génome basée sur la comparaison entre plusieurs échantillons en vue d’identifier d’éventuelles pathologies génétiques. Au cours de cette étude, 12 souches de cellules CSPi humaines issues de donneurs différents ont été mises en culture selon le même protocole, et les données relatives à la croissance de chaque lignée cellulaire ont été acquises grâce au système de surveillance de l’incubation CM20.
Protocole de culture
Le maintien des cellules CSPi humaines en culture a été réalisé dans une plaque à 6 puits sans cellules nourricières dans du milieu StemFit AK02N (Ajinomoto Co., Inc.) et la matrice de revêtement de plaque iMarix-511 (Matrixome Inc.). Les cellules ont été dissociées à l’aide d’une solution d’accutase, repiquées à une concentration d’ensemencement de 1,0 - 2,0 × 104 cellules/puits.et cultivées pendant 24 heures dans un milieu StemFit AK02N avec l’inhibiteur Y-27632. Pour induire la prolifération des cellules CSPi humaines, le milieu de culture a été remplacé par du milieu StemFit AK02N sans inhibiteur Y-27632, puis les cellules ont été cultivées pendant une semaine environ, avec remplacement du milieu une fois tous les deux jours (fig. 1).
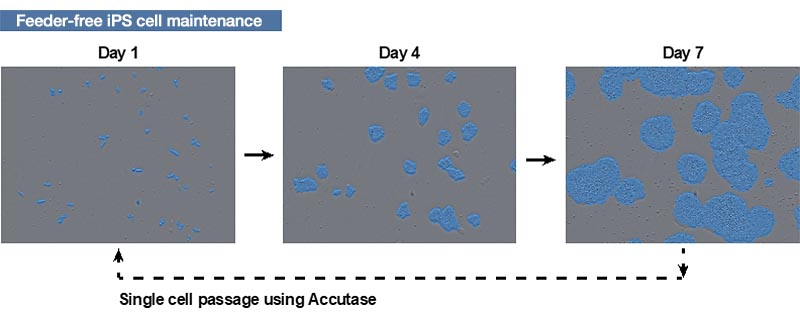
Figure 1. Protocole de culture des cellules CSPi
Images des cellules CSPi humaines acquises à l’aide du moniteur CM20 au bout de 1, 4 et 7 jour(s) après le passage. Les zones bleues ont été identifiées par la fonction de reconnaissance automatique des colonies du système de surveillance.
Les zones bleues ont été identifiées par la fonction de reconnaissance automatique des colonies du système de surveillance.
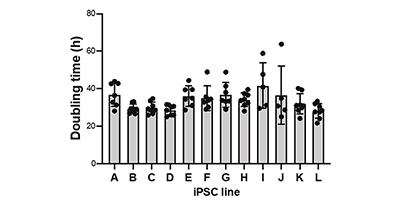
Le processus de croissance des 12 souches de cellules CSPi humaines a été surveillé de façon continue à l’aide du système CM20 pendant cinq à huit passages (fig. 2 A, B). Les changements de milieu et les repiquages de toutes les lignées de cellules CSPi ont été effectués en même temps. Il en est ressorti que le temps de doublement de la population des cellules de chaque lignée CSPi est d’environ 30 heures, avec des vitesses de prolifération est légèrement différentes d’une lignée à l’autre. Nous avons également observé que certaines des lignées de cellules CSPi humaines (comme les souches B et C) ont un temps de doublement quasiment constant d’un passage à l’autre. Cela confirme que les procédures de culture, comme le remplacement du milieu et le repiquage, ont été correctement exécutées (fig. 2 C).
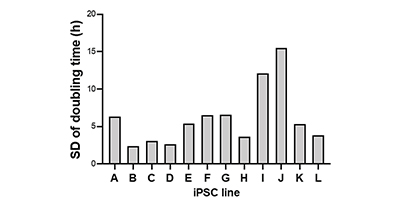
D’autres lignées de cellules CSPi, telles que les souches I et J, ont en revanche un temps de doublement très irrégulier d’un passage à l’autre (fig. 2D). Ces résultats montrent que les 12 lignées cellulaires de cellules CSPi ont des propriétés de croissance différentes.
A
| B
|
C
| D
|
Figure 2. Surveillance quantitative de la progression de la prolifération pendant le maintien de cellules CSPi humaines en culture
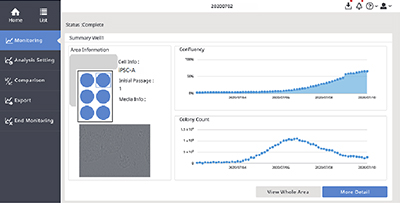
(A) Interface logicielle du système de surveillance CM20.
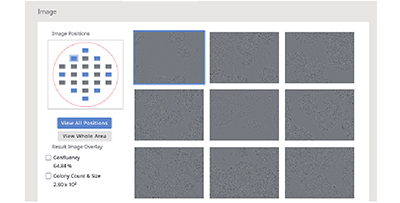
(B) Observation d’un seul puits à l’aide du système de surveillance CM20. Les images des neuf champs visuels des puits sont automatiquement acquises toutes les 3 heures tous les jours.
(C) Représentation graphique des temps de doublement de chaque lignée de cellules CSPi lors des différents passages. Les barres de l’histogramme représentent la moyenne ± l’écart-type (EC).
(D) Représentation graphique de la variation des temps de doublement de chaque lignée de cellules CSPi exprimée en écart-type.
Avantages de l’analyse quantitative
Étant donné que le système de surveillance CM20 collecte des données quantitatives sur la croissance cellulaire, il est possible de mesurer et de comparer suivant les mêmes critères les données issues des différentes lignées cellulaires. Le système de surveillance facilite la collecte des données de différentes souches maintenues selon la même procédure par un ou plusieurs chercheurs. Il est ainsi facile de vérifier si la procédure a été correctement réalisée en comparant les images des cellules et les mesures de leur croissance.
Par le passé, lorsque la qualité des cellules variait, il était difficile de déterminer si cette variation était due à des différences de propriétés des différentes lignées cellulaires ou à une erreur de procédure pendant la culture, en particulier dans les études utilisant des cellules CSPi, qui nécessitent de nombreuses heures de travail pour arriver à obtenir les cellules différenciées souhaitées. Il était difficile de mesurer dans quelle mesure les changements qui peuvent se produire au cours du maintien en culture des cellules CSPi ont une incidence sur les résultats d’évaluation des cellules différenciées.
Olympus continuera d’effectuer ses travaux de recherche avec le système CM20 avec l’objectif de mettre au point des méthodes pour un contrôle de la qualité et une gestion des données efficaces.
Commentaire du Dr Takebe et du Dr Yoneyama
Dr Takanori Takebe (gauche) | With the CM20 monitor, which can be permanently installed in the incubator, 6 to 12 iPS cell strains can be constantly monitored simply by placing the culture vessel or plate on the monitor. The growth data is captured and recorded without having to remove the cells from the incubator. It was useful for acquiring data on the differences between the cell lines. In addition, it takes a lot of effort to manually take photos of multiple stocks over time, but one of the advantages of the CM20 monitor is that it automatically stores and organizes the photos. |
Produits utilisés pour cette application
a bien été ajouté à vos favoris
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.