Utilisation de la microscopie multiphotonique intravitale pour visualiser des interactions dynamiques entre les neutrophiles et les monocytes/macrophages dans les voies respiratoires d’une souris infectée par le virus de la grippe
Le système immunitaire inné de l’organisme constitue la première ligne de défense contre les infections virales. L’une de ses principales fonctions consiste à collecter plusieurs types de leucocytes sur les sites d’infection (par exemple, les voies respiratoires). Tous ces leucocytes, y compris les neutrophiles et les monocytes/macrophages, agissent en coordination pour renforcer la défense de l’organisme contre le virus. En approfondissant leur compréhension des mécanismes de ce processus immunitaire inné, les chercheurs pourront améliorer l’efficacité des vaccins et des traitements.
Cette note d’application explique comment le Dr Minsoo Kim et ses collègues ont utilisé la microscopie multiphotonique intravitale pour examiner la dynamique des neutrophiles et des monocytes/macrophages in vivo dans la trachée d’une souris infectée par le virus de la grippe. L’observation 3D et l’analyse des images ont révélé des schémas de mobilité des interactions entre les neutrophiles et les monocytes/macrophages jusqu’alors inconnus.
Reconstruction 3D des images montrant la migration des neutrophiles dans la trachée d’une souris infectée par le virus de la grippe. Rouge, neutrophile ; blanc, vaisseau sanguin. Échelle graphique, 50 μm. La fluorescence du tdTomato a été excitée par une longueur d’onde de 975 nm et détectée dans le canal rouge (575-630 nm). La fluorescence de l’Alexa Fluor 647 a été excitée par une longueur d’onde de 1 200 nm et détectée dans le canal rouge lointain (645-685 nm). (Données d’après la référence [1])
Migration des neutrophiles dans la trachée d’une souris infectée par le virus de la grippe
Pour visualiser les neutrophiles dans la trachée d’une souris infectée par le virus de la grippe, des souris Ly6G-Cre/ROSA-tdTomato ont été infectées par le virus de la grippe. Dans les 3 à 6 jours suivant l’infection, une infiltration massive et transitoire de neutrophiles et de monocytes dans la trachée a été observée. Pour marquer les vaisseaux sanguins, un anticorps CD31 conjugué à de l’Alexa Fluor 647 a été injecté par voie intraveineuse aux souris avant l’imagerie. La microscopie multiphotonique intravitale a été réalisée sur la trachée canulée chirurgicalement de souris anesthésiées. Comme le montre la vidéo 1, la visualisation des neutrophiles tdTomato+ (rouge) et des vaisseaux sanguins (blanc) a permis d’observer la migration des neutrophiles autour des vaisseaux sanguins voisins dans la trachée des souris infectées par le virus de la grippe.
Schémas de mobilité et d’interactions des neutrophiles et des monocytes/macrophages
Pour visualiser les neutrophiles et les monocytes/macrophages dans la trachée de souris infectées par le virus de la grippe, des souris Ly6G-Cre/ROSA-tdTomato/Csf1r-EGFP ont été infectées par le virus de la grippe. Les neutrophiles expriment à la fois la GFP et le tdTomato (fluorescence rouge/orange), tandis que les monocytes/macrophages expriment uniquement la GFP (fluorescence verte). Comme le montre la vidéo 2, les neutrophiles GFP+/tdTomato+ (rouge/orange), les monocytes/macrophages GFP+ (vert) et les vaisseaux sanguins (blanc) ont été observés dans la trachée des souris infectées par le virus de la grippe. Le cinquième jour après l’infection, la plupart des monocytes/macrophages sont devenus non mobiles, tandis que la plupart des neutrophiles sont restés très mobiles et se déplaçaient constamment à proximité des monocytes/macrophages environnants.
Migration et interactions des neutrophiles et des monocytes/macrophages dans la trachée des souris infectées par le virus de la grippe. Rouge/orange, neutrophile ; vert, monocytes/macrophages ; blanc, vaisseau sanguin. Barre d’échelle : 50 μm. Les fluorescences de la GFP et du tdTomato ont été excitées par une longueur d’onde de 975 nm, puis détectées respectivement dans le canal vert (495-540 nm) et le canal rouge (575-630 nm). La fluorescence de l’Alexa Fluor 647 a été excitée par une longueur d’onde de 1 200 nm et détectée dans le canal rouge lointain (645-685 nm). (Données d’après la référence [1])
Un examen plus approfondi à fort grossissement a révélé davantage de détails du schéma d’interaction entre les neutrophiles et les monocytes/macrophages. La vidéo 3 montre la reconstruction 3D de la migration des neutrophiles parmi les monocytes/macrophages dans la trachée des souris au cours du sixième jour suivant l’infection. Cette vidéo montre que les neutrophiles hautement mobiles (rouge) rencontrent activement les monocytes/macrophages environnants non migrateurs (vert) et s’y déplacent. Ces rencontres fréquentes ont conduit à l’engloutissement des neutrophiles par les monocytes/macrophages, révélant ainsi le mécanisme d’élimination des neutrophiles mourants de la trachée infectée.
Reconstruction 3D des images montrant les interactions détaillées entre les neutrophiles et les monocytes/macrophages dans la trachée des souris infectées par la grippe (jour 6 post-infection). Rouge, neutrophile ; vert, monocytes/macrophages. Les fluorescences de la GFP et du tdTomato ont été excitées par une longueur d’onde de 975 nm, puis détectées respectivement dans le canal vert (495-540 nm) et le canal rouge (575-630 nm). (Données d’après la référence [1])
Comment le microscope multiphotonique FVMPE-RS a rendu possible la conduite de notre expérience
Système à lasers jumelés FVMPE-RS pour l’imagerie multiphotonique multilongueur d’onde simultanée
Système de microscope à portique pour l’imagerie in vivo de la souris
Objectif dédié à l’excitation multiphotonique XLPLN25XWMP2
| Les objectifs dédiés à l’excitation multiphotonique sont optimisés pour l’imagerie multiphotonique en profondeur dans les tissus. Le revêtement optique assure une bonne transmission de 400 à 1 600 nm afin de garantir à la fois une excitation efficace dans le proche infrarouge et la captation de la fluorescence visible. L’objectif XLPLN25XWMP2 à immersion dans l’eau d’Olympus possède une grande ouverture numérique (NA 1,05), une longue distance de travail (2 mm) et un large champ de vision (FN 18 mm) qui assurent d’excellentes performances en matière d’imagerie multiphotonique in vivo/intravitale. | 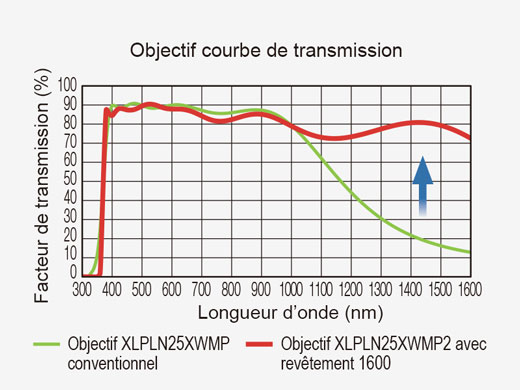 |
|---|
Biographie du Dr Minsoo Kim
Remerciements
Cette note d’application a été préparée avec la collaboration des Dr Minsoo Kim et Kihong Lim du département de microbiologie et d’immunologie, David H. Smith Center for Vaccine Biology and Immunology, Université de Rochester, NY, États-Unis.
Référence
Produits utilisés pour cette application
a bien été ajouté à vos favoris
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.


