Surveillance de l’effet des composants du milieu sur la croissance et la différenciation des organoïdes de diverticules hépatiques dérivés de CSPi humaines à l’aide du système de surveillance de l’incubation Olympus Provi™ CM20
Introduction
Les organoïdes sont utilisés dans la recherche en biologie du développement afin de comprendre l’organogenèse et dans la recherche pour la découverte de médicaments afin d’élucider le mécanisme pathogène des maladies et de trouver des traitements efficaces. L’optimisation des conditions de culture comme les facteurs de croissance et les petites molécules est essentielle pour réussir la culture des organoïdes. Actuellement, les conditions de culture optimales sont déterminées de façon empirique, et il est important d’observer attentivement les changements dans le comportement et la morphologie des cellules cultivées dans chaque condition expérimentale. Dans cette note d’application, nous montrons comment l’Olympus Provi™ CM20 fournit des résultats qualitatifs essentiels pour établir les conditions optimales de culture des organoïdes hépatiques.
Plan expérimental
L’intérêt potentiel de la création d’organoïdes hépatiques dérivés de cellules souches pluripotentes induites (CSPi) humaines pour diverses applications a été montré dans plusieurs études (Koido M et al., Nature Medicine 2020 [PMID: 32895570], Takebe T et al., Nature 2013 [PMID: 23823721]). Pour cette expérience, les organoïdes de diverticules hépatiques ont été différenciés à partir de CSPi humaines dans un système de culture tridimensionnelle. Cinq conditions expérimentales différentes dans lesquelles les composants du milieu ont été modifiés pour altérer les stades ultérieurs de la différenciation des diverticules hépatiques (nommés ici A, B, C, D et E) ont été testées. La différenciation et la morphologie des organoïdes ont été analysées afin d’établir l’effet des différents composés et de déterminer la condition de culture optimale. Le système de surveillance de l’incubation CM20 a été utilisé pour recueillir des données sur les organoïdes en culture tridimensionnelle placés dans une plaque à 24 puits pendant une période d’environ deux semaines (figure 1).
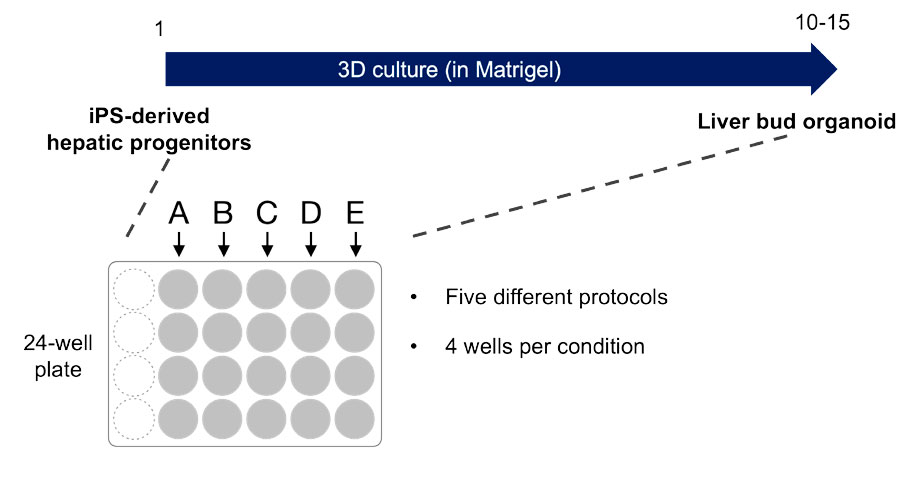
Figure 1. Vue d’ensemble des conditions expérimentales
Résultats
Dans la condition A déjà établie, il a été observé que des organoïdes sphériques se formaient et que des structures auto-organisées se développaient progressivement. Dans les conditions B et C, on a observé une formation d’organoïdes morphologiquement semblables à ceux de la condition A. En revanche, l’application des conditions D et E a entraîné une augmentation du diamètre et de la quantité des organoïdes (figure 2). Les données temporelles obtenues avec le système CM20 ont également révélé que la dilatation luminale observée dans les conditions D et E se produisait environ 4 à 5 jours après l’ajout du composé (figure 3).

Figure 2. Observation d’organoïdes de diverticules hépatiques humains cultivés dans une plaque multipuits et exposés à cinq petites molécules différentes ayant affecté leur différenciation et leur croissance
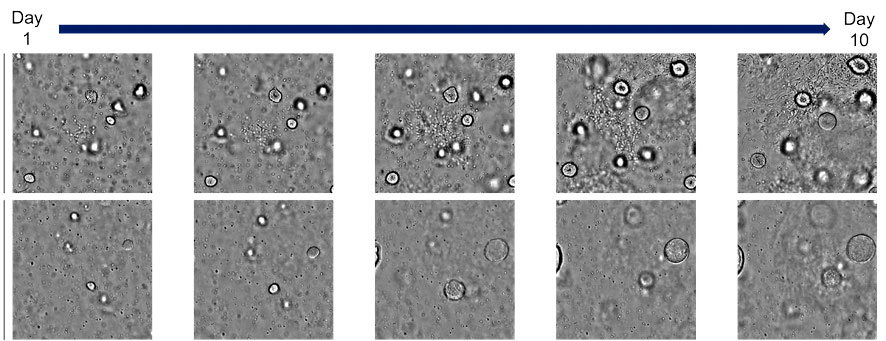
Figure 3. Changements morphologiques observés dans des organoïdes de diverticules hépatiques humains en réponse à l’ajout de composés
Conclusion
En conclusion, il a été constaté que le système de surveillance CM20 rendait possible la surveillance de l’état d’organoïdes tridimensionnels cultivés dans des plaques multipuits au fil du temps et l’observation comparative entre différentes conditions.
Commentaires des Dr Takebe et Yoneyama


Dr Takanori Takebe (à gauche), Dr Yosuke Yoneyama (à droite),
Tokyo Medical and Dental University Institute of Research.
Bien qu’il soit important d’analyser l’expression des marqueurs moléculaires dans l’évaluation de l’efficacité de la différenciation des organoïdes, les changements morphologiques des organoïdes peuvent également être des indicateurs utiles pour connaître leur qualité et les résultats futurs. Avec le système CM20, l’état des organoïdes est constamment surveillé, de sorte que nous ne ratons pas le moment où les changements morphologiques se produisent.
Produits utilisés pour cette application
a bien été ajouté à vos favoris
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.