Application of the Z-Drift Compensation System IX-ZDC to multidimensional cell-based assay at the single cell level
Multidimensional cell-based assay at the single cell level
A cell-based assay system that facilitates efficient multi-sample data collection enables researchers to observe dose-dependent physiological activity at the single-cell level to study physiological reactions and cell response. In this type of assay, cells are typically cultured in a multiwell plate. Inverted microscopes are then used to observe physiological reactions of how cells respond when different doses of drugs are added to an individual well.
Inverted microscopes with z-drift compensation systems can perform fully automated, continuous observation over several days, which is important for monitoring cell growth or testing the toxicity of drugs. The ability to image multidimensional drug dose-dependent cell growth and intracellular physiological activity is important for advancing cell-based assays.
Using the IX-ZDC z-drift compensator to help analyze resistance of cancer cells to MEK inhibitors using FRET biosensor
1)Visualization of extracellular signal-regulated kinases (ERKs) using Förster resonance energy transfer (FRET) biosensor
The Ras-Raf-MEK-ERK signaling pathway is well known for its association with cancer development and is a target for molecular chemotherapy drugs. However, the pathway’s association with anticancer drug resistance is unclear. In order to better understand the role of the Ras-Raf-MEK-ERK signaling pathway in anticancer drug resistance, researchers at the Graduate School of Medicine, Kyoto University, Japan analyzed resistance to MEK inhibitors in multiple cancer cell lines using a FRET biosensor that enables researchers to visualize the activity of the ERK protein kinase, which is a component of the Ras-Raf-MEK-ERK signaling pathway.
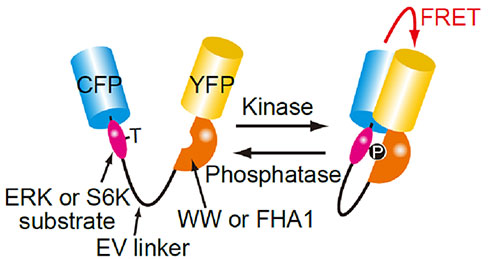
Fig 1. Structure of the FRET biosensor for visualization of ERK or S6K activity
Phosphorylation of ERK or S6K substrate in the FRET biosensor molecule causes it to intra-molecularly bind to the phosphopeptide-binding domain (WW or FHA1) resulting in an increase in the FRET efficiency between the cyan fluorescent protein (CFP) and yellow fluorescent protein (YFP).
2)Using the IX-ZDC z-drift compensator to construct a multidimensional cell-based assay system
HT-29 cells (with BRAF V600E mutation) expressing FRET (Fig. 1) were cultured in a 96-well glass plate. After adding different doses of an MEK1/2 inhibitor (AZD6244) to individual wells, a fully-motorized, inverted Olympus IX Series microscope was used to continually observe the change in intracellular ERK activity and cell growth in each well for 3 days. The IX-ZDC z-drift compensator automatically adjusted the focus each time one of the wells was imaged, enabling researchers to capture images that were always in focus, even during long-term observation.
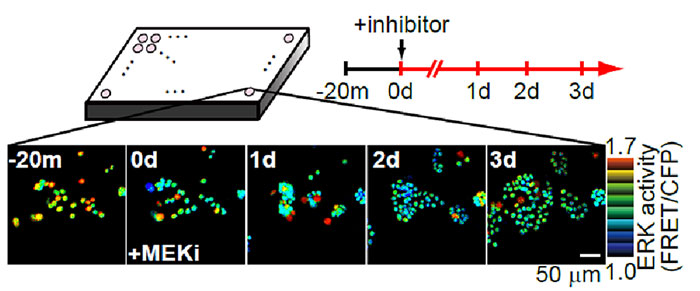
Fig 2. Using the IX-ZDC Z-drift compensator with a multidimensional cell-based assay system
Bright spots in the images correspond to the nuclei of cells expressing the FRET biosensor for detecting ERK activity.
The warmer and cooler colors indicate higher and lower levels of ERK activity, respectively.
3)Quantitative analysis of MEK1/2 inhibitor dose-dependent ERK activity and cell growth rate
In order to analyze the dose-dependent response of HT-29 cells (with BRAF V600E mutation) to the MEK1/2 inhibitor (AZD6244) from the data obtained by the multidimensional cell-based assay described above (Fig. 2), the researchers generated a graph (Fig. 3) by plotting the MEK1/2 inhibitor (AZD6244) concentration on the x-axis, growth rate (/day) on the left y-axis, and ERK activity on the right y-axis (using a data set generated up to one day after the addition of the MEK1/2 inhibitor). To analyze the relationship between the MEK1/2 inhibitor dose-dependent ERK activity and the growth rate, they generated a second graph (Fig. 4) by plotting the ERK activity on the x-axis and growth rate on the y-axis. These graphs revealed that HT-29 cells exhibited almost identical IC50 values for both ERK activity and cell growth rate and that there was a linear correlation between ERK activity and cell growth rate.
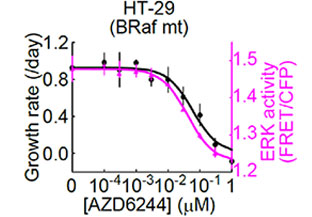 | 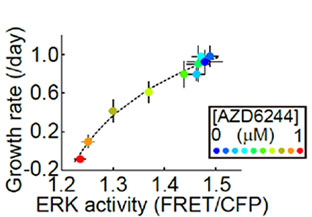 |
Fig 3. Dose-dependent response of ERK activity and cell growth rate on the MEK1/2 inhibitor (AZD6244) in HT-29 cells | Fig 4. Relationship between the MEK1/2 inhibitor (AZD6244) dose-dependent ERK activity and cell growth rate in HT-29 cells |
4)MEK1/2 inhibitor dose-dependent ERK activity and cell growth rate in multiple cancer cell lines
By repeating the same analysis in cancer cell lines other than HT-29 cells, researchers found that the IC50 values of the MEK1/2 for ERK activity were similar to each other in various cancer cell lines (~0.01 μM); and in MEK1/2 resistant cancer cell lines (KRas-mutant cell lines), the IC50 for the cell growth rate was more than 10 times higher than the IC50 for ERK activity, resulting in a nonlinear correlation between ERK activity and cell growth rate.
This study required large volumes of imaging data, and the efficient analysis of resistance to the MEK inhibitor in cancer cells would not have been possible without the IX-ZDC z-drift compensator for the inverted IX Series microscope.
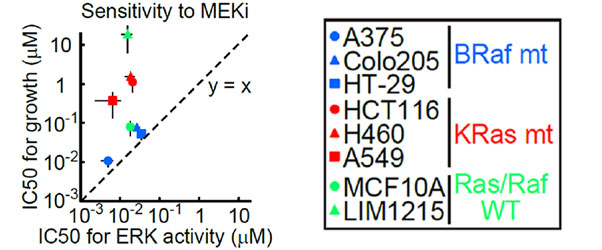 |
Fig 5. Comparison of IC50 values of the MEK1/2 inhibitor (AZD6244) for ERK activity and cell growth rates in multiple cancer cell lines |
Imaging conditions
Microscope: Motorized inverted IX Series microscope.
Z-drift compensation system: IX-ZDC
Objective: UPLSAPO20X, dry
Microplate: 96-well glass microplate
Conclusion
IX-ZDC z-drift compensator supports multidimensional cell-based assays
Olympus’ IX-ZDC z-drift compensator and the motorized, inverted IX Series microscope enable the material in individual wells within a microplate to be imaged clearly for experiments lasting multiple days. With the autofocus function, a 96-well plate can be completely imaged in about 2 minutes,* supporting a highly precise and rapid cell-based assay.
*For serial imaging of one spot in each well of a 96-well plate with a 30 ms exposure time.
Movie of UCPLFLN20XPH to multidimensional cell-based assay at the single cell level
This application note was prepared with the help of:
Dr. Naoki Komatsu, Assistant Professor, Laboratory of Bioimaging and Cell Signaling, Graduate School of Biostudies, Kyoto University, Japan and Dr. Kazuhiro Aoki, Designated Associate Professor, Imaging Platform for Spatio-Temporal Information, Graduate School of Medicine, Kyoto University, Japan.
For more details on the study in this application note, please see:
Komatsu, N., Y. Fujita, M. Matsuda, and K. Aoki. "mTORC1 upregulation via ERK-dependent gene expression change confers intrinsic resistance to MEK inhibitors in oncogenic KRas-mutant cancer cells." Oncogene 34, no. 45 (2015): 5607–5616
Produits utilisés pour cette application
a bien été ajouté à vos favoris
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.