Détermination de la prolifération cellulaire et de la cytotoxicité avec une précision et une facilité accrues grâce au système de surveillance de l’incubation CM20
Introduction
Le test d’évaluation de la prolifération cellulaire et de la cytotoxicité est l’un des essais les plus fréquemment utilisés dans le cadre des travaux de recherche impliquant des cellules cultivées. Il s’agit d’un essai préliminaire essentiel pour déterminer les concentrations de médicaments à utiliser pour les traitements et l’efficacité et la sécurité des médicaments dans divers domaines de recherche, tels que l’oncologie et la mort cellulaire.
Traditionnellement, les tests au WST-8 ou de mesure de l’ATP, qui utilisent l’activité métabolique comme indicateur, et les tests au BrdU ou à la thymidine, qui utilisent le taux de synthèse de l’ADN comme indicateur, étaient utilisés pour l’évaluation quantitative des caractéristiques de croissance des cellules. Même si ces tests sont avantageux en raison de leur simplicité et de leur cadence, ils constituent tous des méthodes d’évaluation indirectes et, par conséquent, il est possible que leurs résultats ne soient pas corrélés au nombre réel de cellules. Dans de nombreux cas, il s’agit d’évaluations en fin d’expérience, qui ne permettent pas toujours de détecter les variations dans le temps et risquent donc d’échouer à mettre en évidence des événements importants.
En raison de ces limites, nous considérons que la mise au point d’une méthode d’évaluation directe et temporelle de la prolifération cellulaire et de la cytotoxicité est importante pour les domaines de recherche qui utilisent des cellules cultivées.
Plan expérimental
Pour vérifier l’aptitude du système de surveillance de l’incubation OLYMPUS Provi CM20 à évaluer la prolifération cellulaire ou la toxicité, nous avons effectué les deux tests suivants pour comparer le système CM20 à un test conventionnel (WST-8) :
- un test d’évaluation de la mort de cellules d’adénocarcinome pulmonaire humain A549 induite par un anticancéreux (5-FU ;
- un test d’évaluation de la mort de cellules de neuroblastome humain SH-SY5Y induite par une neurotoxine (6-OHDA).
Procédures expérimentales
Test d’évaluation de la mort de cellules cancéreuses induite pat un anticancéreux (5-FU)
Des cellules d’adénocarcinome pulmonaire humain A549 ont été ensemencées dans une plaque multipuits puis, 24 heures après l’ensemencement, traitées par 5-FU (400 μM) pendant 72 heures, le système CM20 prenant des images et comptant le nombre de cellules toutes les heures. La concentration de 5-FU utilisée pour le traitement a été fixée de manière à obtenir un équilibre entre la prolifération cellulaire et la mort cellulaire, un groupe non traité par 5-FU servant de témoin. Des méthodes conventionnelles ont été utilisées pour mesurer la viabilité cellulaire à 0, 24, 48 et 72 heures après le début du traitement au moyen du test au WST-8.
Test d’évaluation de la la mort cellulaire induite par une neurotoxine (6-OHDA)
Des cellules de neuroblastome humain SH-SY5Y ont été ensemencées dans une plaque multipuits puis, 24 heures après l’ensemencement, traitées par 6-OHDA (60 μM) pendant 24 heures, le système CM20 prenant des images et comptant le nombre de cellules toutes les heures. La concentration de 6-OHDA utilisée pour le traitement a été fixée de manière à induire une mort cellulaire rapide, un groupe non traité par 6-OHDA servant de témoin. La méthode conventionnelle a été utilisée pour mesurer la viabilité des cellules à 0, 6, 12 et 24 heures après le début du traitement au moyen du test au WST-8.
Résultats
Test d’évaluation de la mort cellules A549 induite par un anticancéreux (5-FU)
Figure 1. Images de cellules A549 après les traitements par 5-FU.
Rangée du haut : groupe non traité par 5-FU. Rangée du bas : groupe traité par 400 μM de 5-FU.
Dans le groupe non traité par 5-FU, le nombre de cellules a augmenté en fonction de la durée de la culture, et il a été observé que les cellules devenaient confluentes à 100 % après environ 72 heures. Dans le groupe traité par 5-FU, le nombre de cellules mortes a augmenté en fonction de la durée du traitement, sans variation significative de la densité cellulaire après 24 heures de traitement.
|
|
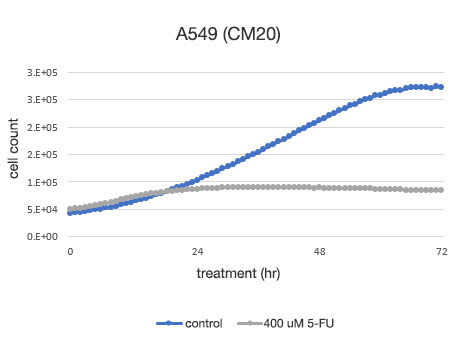
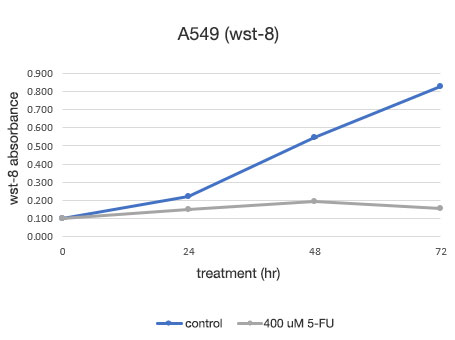
Figure 2. Détermination quantitative de la viabilité des cellules A549.
À gauche : nombre de cellules déterminé par le système CM20. À droite : nombre de cellules déterminé par la méthode d’analyse conventionnelle (WST-8).
L’analyse avec le système CM20 a montré que le nombre de cellules a augmenté selon une courbe sigmoïde dans le groupe non traité par 5-FU, tandis que le nombre de cellules n’a pas changé de manière significative après 24 heures de traitement dans le groupe traité par 5-FU, ce qui indique que la prolifération cellulaire et la mort cellulaire étaient en équilibre. Ces résultats sont cohérents avec l’observation visuelle des cellules. Ils sont également concordant avec les résultats obtenus par la méthode conventionnelle (test WST-8).
Test d’évaluation de la mort cellules SH-SY5Y induite par une neurotoxine (6-OHDA)
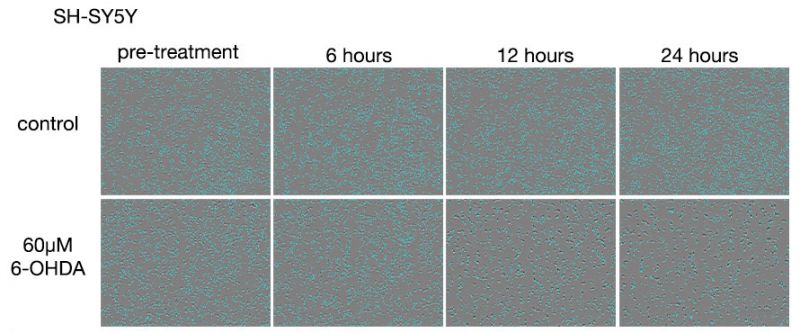
Figure 3. Images des cellules SH-SY5Y après les traitements par 6-OHDA.
Rangée du haut : groupe non traité par 6-OHDA. Rangée du bas : groupe traité par 60 μM de 6-OHDA.
Dans le groupe non traité par 6-OHDA, il a été observé une légère augmentation du nombre de cellules au bout de 24 heures. Dans le groupe traité par 6-OHDA, une diminution du nombre de cellules a été observée au bout de 6 heures de traitement, et au bout de 12 heures de traitement, nous avons constaté que la plupart des cellules étaient mortes.
|
|
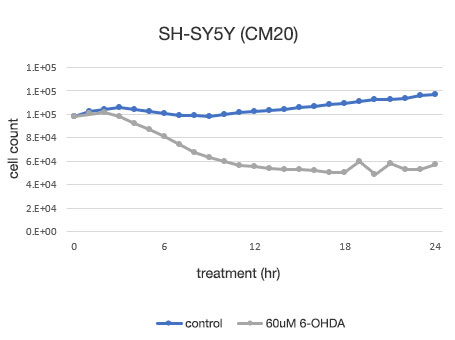
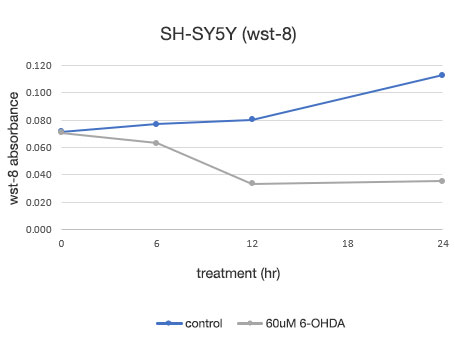
Figure 4. Détermination quantitative de la viabilité des cellules SH-SY5Y.
À gauche : nombre de cellules déterminé par le système CM20. À droite : nombre de cellules déterminé par la méthode d’analyse conventionnelle (WST-8).
L’analyse effectuée à l’aide du système CM20 a montré que le nombre de cellules a légèrement augmenté en 24 heures dans le groupe non traité par 6-OHDA, tandis que dans le groupe traité par 6-OHDA, le nombre de cellules a commencé à diminuer au bout de 3 heures de traitement et a continué à diminuer par la suite. Le nombre de cellules n’a pas varié de manière significative après 12 heures de traitement, ce qui indique que presque toutes les cellules sont mortes au bout d’environ 12 heures de traitement. Ces résultats sont cohérents avec l’observation visuelle des cellules. Ils sont également concordant avec les résultats obtenus par la méthode conventionnelle (test WST-8).
Discussion sur les résultats obtenus par le système CM20 par rapport au test conventionnel
L’analyse effectuée à l’aide du système de surveillance CM20 de l’effet du médicament anticancéreux sur des cellules cancéreuses et de la neurotoxicité d’un autre médicament pour des cellules du système nerveux a généré des résultats quasiment identiques à ceux obtenus par l’observation d’images et une méthode conventionnelle (test au WST-8).
Avantages des évaluations effectuées à l’aide du système de surveillance de l’incubation CM20
L’un des avantages de l’utilisation du système CM20 pour mener cette évaluation est que le court intervalle entre chaque mesure permet de déterminer précisément les variations temporelles. Par exemple, le test utilisant des cellules SH-SY5Y montre que presque toutes les cellules sont mortes environ 12 heures après le traitement par 6-OHDA. En revanche, les tests en fin d’expérience ne fournissent pas de telles informations.
Un autre avantage du système CM20 est qu’il permet d’obtenir des données sur l’effet d’un médicament au cours du temps dans une seule plaque. La méthode conventionnelle nécessite la préparation d’une plaque pour chaque point de mesure temporel, ce qui augmente la quantité de travail par le nombre de points temporels et limite le nombre de plaques pouvant être analysées. De plus, l’augmentation du nombre de points de mesure lors de l’utilisation d’une méthode d’analyse conventionnelle accroît également la complexité de l’analyse des données, alors que le système CM20 permet l’observation automatique de plusieurs points et la production automatique de graphiques des résultats.
Un avantage supplémentaire du système CM20 provient de sa fonction d’acquisition d’images automatique qui permet d’examiner l’état de la prolifération des cellules et leurs modifications morphologiques même après le début de l’étape d’analyse des données. Le système CM20 enregistre les images des cellules tout au long de l’analyse, de sorte que des informations supplémentaires et potentiellement cruciales peuvent être recueillies et analysées. Même dans les cas où la méthode conventionnelle nécessite de procéder à une estimation de la durée appropriée des traitements en analysant plusieurs points et en refaisant des tests, l’analyse à l’aide du système CM20 permet de déterminer la durée appropriée des traitements ultérieurement à partir d’un seul test, puis d’extraire les données pour la durée déterminée.
Commentaires du Dr Yamaguchi
Tout d’abord, j’ai été impressionné par la précision du comptage cellulaire lorsque j’ai utilisé le système de surveillance de l’incubation CM20. Les cellules reconnues par le système CM20 étaient affichées séparément sur un écran, une par une. J’ai pu vérifier que ce test permet d’effectuer des évaluations quantitatives hautement reproductibles lorsque les paramètres initiaux sont correctement définis.
Contrairement à la méthode conventionnelle de mesure indirecte du nombre de cellules, le système CM20 ne nécessite aucun marquage. Comme le marquage peut avoir un impact sur les cellules, le fait d’éviter ce processus fait du système CM20 une méthode fiable pour l’évaluation du nombre de cellules. En outre, l’intérêt du système CM20 est qu’il permet l’acquisition quasi automatique de données de nombreux points temporels dans une même plaque, ce qui réduit considérablement la quantité de travail et contribue à éliminer le risque de manquer des données importantes.
Selon les types et les concentrations des médicaments utilisés dans les expériences, certaines variations peuvent être observées au cours des traitements même dans le cas où, par exemple, aucune différence n’est observée au stade final lorsque les cellules sont toutes mortes ou ont atteint la confluence. Je pense que l’utilisation du système CM20 peut réduire considérablement le temps et les efforts nécessaires pour estimer la durée du traitement dans ces circonstances, ce qui pourrait améliorer l’efficacité et la rapidité des travaux de recherche.
Remerciements
Cette note d’application a été rédigée avec l’aide du chercheur suivant :
Dr Takahiro Yamaguchi, chercheur principal, ACEL, Inc.
Produits utilisés pour cette application
a bien été ajouté à vos favoris
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.