Comprender la relación entre los datos de imagen digitales y las muestras biológicas
Este informe técnico explora la relación entre las señales de las muestras biológicas y los datos digitales de las cámaras microscópicas. Su comprensión permite establecer condiciones ideales de adquisición de imagen para obtener imágenes y datos de la más alta calidad.
Los principios fundamentales del procesamiento de imágenes digitales
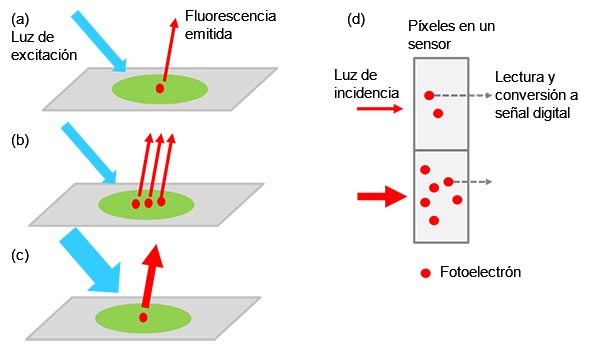
Una cámara microscópica monocromática es un dispositivo que detecta y representa la luz de las muestras biológicas. El microscopio observa la luz de fluorescencia emitida por las tinciones o proteínas fluorescentes, y después la cámara detecta esta luz, convirtiéndola en fotoelectrones para ser detectada como señal digital.
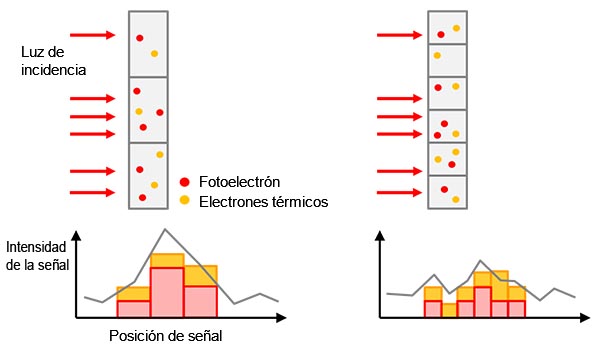
El valor de la señal detectada es un factor de multiplicación complejo de la cantidad de objetivos etiquetados (p. ej., proteínas de interés), la intensidad de la luz de excitación y las eficiencias de emisión/recepción de la fluorescencia, incluyendo la eficiencia de conversión de la cámara desde la luz hasta señal digital (vea Figura 1).
Al usar un mismo sistema y los mismos ajustes de adquisición de imágenes para diferentes muestras en un experimento, todos los componentes (a excepción de la cantidad del objetivo) se convierten en valores constantes, haciendo que el valor de la señal detectada sea proporcional a la cantidad del objetivo. Por ejemplo, esto significa que podría ser comparada de modo cuantitativo con su tipo silvestre.
Figura 1: De la muestra a la señal digital: a) objetivo excitado con etiquetado que emite luz de fluorescencia. |
Anatomía de señal y ruido de fondo
En esta sección se explicarán los factores fundamentales que favorecen a la calidad de la imagen y se explicará la importancia de una captura de imágenes concienzuda durante un experimento.
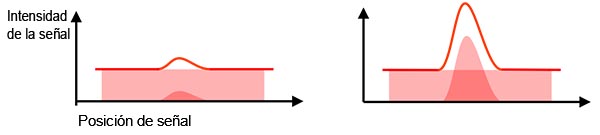
Señal real versus señal de fondo: La señal detectada contiene una señal real y una señal de fondo (ruido de fondo). Para detectar el objetivo a partir de una identificación de señal de fondo, se requiere un índice suficientemente bueno de intensidad de la señal real en función de la señal de fondo (Figura 2). A esto se le denomina relación entre señal-ruido (SNR). Tener en perspectiva una SNR optimizada conlleva a la obtención de una mejor calidad de imagen y análisis cuantitativos.
En general, optimizar la señal real (p. ej., con un objetivo de A. N. más alta) y minimizar las señales de fondo (p. ej., con un cuarto oscuro, un enfriamiento más profundo o una cámara de alta eficiencia cuántica) son formas comunes de mejorar la SNR.
Tenga en cuenta que el valor de ganancia, que determina el factor de amplificación en una cámara dedicado a las señales, no mejora la SNR; ya que, éste afecta tanto a la señal real como a aquella de fondo.
Figura 2 - Izquierda: SNR deficiente: el ruido de fondo dificulta la identificación de la señal real. |
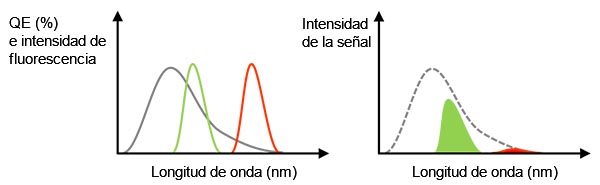
Señal real: Tal como se ha mencionado anteriormente, el uso de un objetivo de alta A. N. permite mejorar la SNR. Otro factor fundamental para obtener una señal más fuerte es una alta eficiencia cuántica (QE). La QE indica la eficiencia de conversión de la luz incidente al fotoelectrón. Tenga en cuenta que una cámara no puede captar la luz si su valor QE es de 0 % en una determinada longitud de onda. Por ejemplo, se debe seleccionar una cámara con una sensibilidad superior a 720 nm que soporte el uso de tinciones en el infrarrojo cercano (NIR) —como Cy7— para una ventana NIR en tejidos biológicos o para evitar la diafonía durante la multiplexación.
Figura 3 - Izquierda: línea gris que representa la QE de una cámara. Las líneas verdes y rojas indican el espectro de emisión de fluorescencia. Derecha: valor de la señal detectada que es igual al tamaño del área, representando un multiplicador de los espectros QE y de fluorescencia en la figura lateral izquierda. En este caso, incluso si la luz de fluorescencia tiene suficiente intensidad, la señal detectada podría ser débil para la fluorescencia roja debido a la baja QE. |
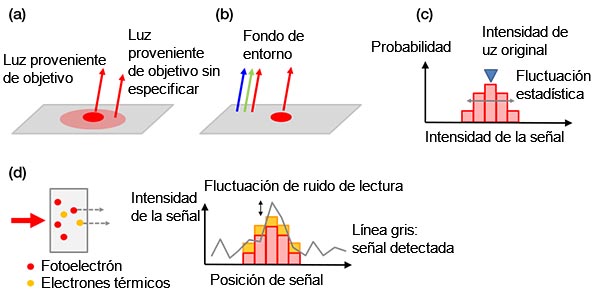
Ruido de fondo: Las señales de fondo pueden clasificarse como:
a) Señales de fondo biológicas
b) Señales de fondo no biológicas
c) Fluctuación estadística de un fotoelectrón (ruido de emisión)
d) Ruidos en una cámara
El ruido de la emisión es único y puede ser comparado con el lanzamiento de una moneda. Así como en dos tiros de moneda existe la probabilidad de que se muestre «cara» en un 50 % y «cruz» en el otro, cualquier ensayo con el número N tiene una fluctuación estadística de ±√(N). La cantidad de fotoelectrones detectados sigue la misma regla.
Todos los ejemplos de ruido de fondo se muestran en la Figura 4 a continuación.
Figura 4 - Ejemplos de ruidos de fondo: a) Fondo biológico provocado a partir de una mancha no específica o autofluorescencia; b) luz ambiental de la habitación reflejada en un portaobjetos; c) ruido de emisión, d) ruidos en una cámara que contiene electrones térmicos generados en un sensor (izquierda) y ruido de lectura (derecha). Los electrones térmicos pueden reducirse enfriando el sensor. |
Resolución: Un tamaño de píxel más grande o la adquisición de una imagen por agrupamiento puede capturar más luz y proporcionar una relación entre señal-ruido más óptima; sin embargo, el tamaño de píxel más grande reduce la resolución (Figura 5). Identifique el mejor tamaño de píxel que sea congruente con la resolución óptica.
Figura 5 - Izquierda: tamaño de píxel más grande que proporciona mayor sensibilidad pero menor resolución. |
Mejores prácticas de uso para cámaras microscópicas
A pesar de que la idoneidad de ciertos parámetros para la adquisición de imágenes varía según la aplicación y la muestra, existen dos parámetros que se aplican generalmente: la intensidad de la luz de excitación y el tiempo de exposición. Un tiempo de exposición más prolongado o una luz de excitación más fuerte proporcionan una fluorescencia más brillante, conllevando a una SNR más elevada. Sin embargo, esto a su vez empeora la fototoxicidad. Esta condición conlleva a formularse una pregunta importante: ¿cómo se establece el mejor parámetro de adquisición de imágenes para desarrollar experimentos de imágenes de células vivas más prologados, reduciendo al mismo tiempo el daño que la luz de excitación puede causar en la células?
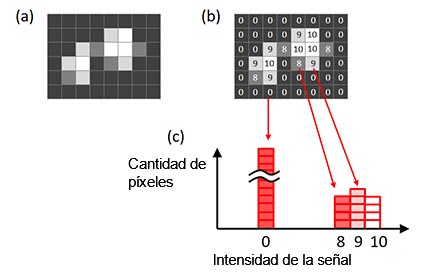
A fin de determinar el tiempo de exposición ideal, utilice un histograma de imagen. El eje X del histograma es la intensidad de la señal. La altura del histograma en cada valor X muestra el número de píxeles para la intensidad de la señal (Figura 6).
Figura 6 - Histograma de una imagen. a) Imagen original; b) intensidad de la señal de cada píxel proyectado en la imagen original; |
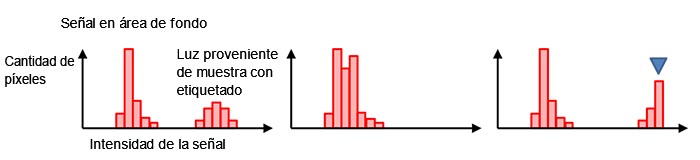
Por lo general, los píxeles de fondo negro tienen un valor de señal digital distinto de cero incluso sin luz de fondo (Figura 7, izquierda). Esto permite evitar una señal de valor negativo causada por la fluctuación del ruido de lectura que ha sido mencionado en la Figura 4 (d). La forma y distribución del histograma confirma si el tiempo de exposición aplicado es apropiado. Si el histograma se presenta demasiado colmado en una escala de baja señal, significa que el tiempo de exposición es demasiado corto (Figura 7, centro). Si se muestra una caída pronunciada en el nivel máximo de la señal, significa que el valor de la señal está saturado (Figura 7, derecha). En este caso, es posible reducir la intensidad de la excitación o acortar el tiempo de exposición.
Figura 7 - Histograma bajo exposición normal (izquierda), exposición deficiente (centro), |
Algunos softwares de adquisición de imágenes cuentan con una función de ajuste automático de pantalla que proporciona una mejor visibilidad, manteniendo al mismo tiempo los datos de la imagen original. En la mayoría de los casos, el rango dinámico de la señal de una cámara monocromática (p.ej., 16 bits = 65, 536 niveles) es más extenso que el rango dinámico de la pantalla, cuyo valor suele ser de 8 bits (= 256 niveles).
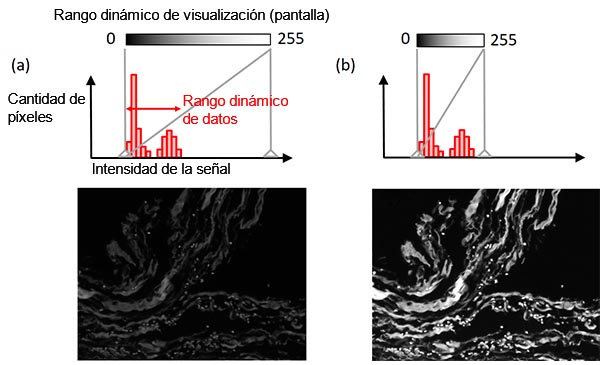
La función de ajuste de pantalla determina la relación entre la intensidad de la señal y el brillo de la pantalla. Por lo general, la intensidad de la señal más brillante, proveniente de la muestra, es mucho menor que la intensidad máxima soportada por la cámara. En este caso, conjuntar el rango dinámico de la pantalla con el rango dinámico de los datos (el rango desde el nivel de fondo hasta la señal más brillante) permite obtener una mejor visibilidad, preservando a la vez los datos de la imagen original (Figura 8). Un histograma permite ilustrar este ajuste.
Figura 8 - Ajuste de pantalla: (arriba) histograma con el indicador de ajuste de la pantalla en una línea vertical gris continua; (centro) relación entre el brillo de la pantalla y la intensidad de la señal; (abajo) imagen de ejemplo. Imagen de ejemplo de la izquierda: Ajuste original de la pantalla. Imagen de ejemplo de la derecha: Condición de visualización ajustada mientras se mantienen los datos de la imagen original. |
Seis pautas para configurar los parámetros de adquisición de una cámara microscópica
En resumen, se otorga a continuación seis pautas generales para configurar adecuadamente una cámara microscópica para un experimento. Tome en cuenta que el mejor procedimiento depende de su aplicación específica y de las muestras.
- Determinar la magnificación de la observación.
- Ajustar el enfoque de su muestra y encontrar el objetivo de observación. Considere el uso de una mayor ganancia o modo de agrupamiento de imagen en la cámara para acortar el proceso y minimizar la fototoxicidad. Asimismo, se recomienda el uso de un ajuste automático o manual de pantalla para observar la señal en su mejor condición y cerrar el obturador de luz de excitación cuando la imagen no esté bajo observación.
- Volver a ajustar la ganancia y el modo de agrupamiento para la adquisición imágenes.
- Probar la intensidad de luz de excitación más suave, y comprobar si puede observarse la señal en un tiempo de exposición realista. Si es imposible identificar la señal, o si la SNR es demasiado deficiente, intente un tiempo de exposición más prolongado.
- Si el tiempo de exposición muestra una prolongación irrealista o mayor al tiempo de exposición máximo permitido en función de la velocidad de adquisición de la imagen, pruebe una intensidad de excitación ligeramente más alta paso a paso.
- Revisar el histograma para confirmar la ausencia de saturación.
Conclusión
Aunque muchos factores complejos contribuyen a la calidad de la imagen y los datos durante el proceso de microscopía, el conocimiento de estos principios básicos y consejos de imagen digital puede permitirle determinar el mejor ajuste de adquisición en cada experimento. Maximizar la señal, minimizar el fondo y optimizar la condición de la muestra son elementos esenciales para mejorar la calidad de los datos en cualquier aplicación y experimento.
Autor
 |
Takeo Ogama
Scientific Solutions Division OLYMPUS CORPORATION OF THE AMERICAS |
Sorry, this page is not
available in your country.