El Dr. Conor L. Evans es profesor, investigador y experto en microscopía; aplica sus conocimientos y habilidades en la resolución de problemas para desarrollar nuevas herramientas ópticas y de procesamiento de imágenes destinadas al cuidado del paciente. La entrevista al Dr. Evans se centró en su trayectoria como investigador clínico, en la importancia que la microscopía tiene en su trabajo y cómo usa los sistemas para resolver los desafíos que plantean la medicina y la biología. Obtenga más información sobre el Dr. Evans a través de la entrevista a continuación.
Conor L. Evans
El Dr. Conor L. Evans posee una licenciatura en Física-Química otorgada por la Universidad de Brown y un doctorado en Química de la Universidad de Harvard. Es profesor asociado en la Escuela de Medicina de Harvard, miembro afiliado de facultad bajo el Programa de Biofísica de la Universidad de Harvard y miembro de facultad para el Centro de Investigación Biomédica Láser.
El Dr. Evans dirige el Laboratorio Evans en el Centro Wellman de Fotomedicina del Hospital General de Massachusetts (MGH). El laboratorio desarrolla y usa una variedad de herramientas y métodos de microscopía a fin de detectar, medir y cuantificar información oculta que permita abordar las necesidades insatisfechas en la atención al paciente. La investigación y las innovaciones en el laboratorio le han otorgado numerosos premios y patentes al tiempo que trabaja para trasladar sus tecnologías al campo clínico.
P: Su formación académica se concentra en la física-química y química. ¿Cómo esta trayectoria profesional ha ido orientándose hacia la investigación referente a la atención al paciente? ¿Y cómo aprendió tanto sobre microscopía?
Dr. Evans: Siempre me ha interesado la biomedicina, y evaluaba la posibilidad de obtener un título en neurociencia antes de quedar prendado con la química y la química física. Cuando comencé mi doctorado, deseaba trabajar en la investigación interdisciplinaria aplicada, en la que la química física podría servir como puente para resolver problemas de mayor magnitud.
Me uní al laboratorio de Sunney Xie en Harvard, donde tuve la increíble oportunidad de formar parte de un equipo focalizado en el desarrollo de una sólida técnica de microscopía para la biomedicina empleando la espectroscopía Raman coherente Anti-Stokes (CARS). En el laboratorio de Sunney, tuve la suerte de trabajar en estrecha colaboración con Eric Potma mientras era estudiante posdoctoral, quien me enseñó prácticamente todo lo que sé sobre microscopía. ¡Debo haber montado, desmontado y remontado unos 15 microscopios con Eric a lo largo de casi tres años!
Posiblemente, hubiera continuado con una investigación más académica en química si no fuera por dos cosas. Primero, Sunney vio mi interés en la investigación aplicada y me animó a explorar las aplicaciones médicas de la microscopía CARS. Tras evaluar todas las oportunidades, ¡me decidí! En segundo lugar, me inspiró mi hermano, que se convirtió en médico de urgencias. Su pasión por la atención al paciente me motivó a dar un salto de fe para hacer un posdoctorado en el Hospital General de Massachusetts (MGH), donde tuve por primera vez la oportunidad de trabajar en una investigación centrada en el paciente.
P: ¿Puede exponer los ámbitos prioritarios de su laboratorio? ¿Qué espera lograr con cada programa de investigación?
1. Sensores de oxígeno
Dr. Evans: El trabajo de mi laboratorio en sensores de oxígeno tiene como objetivo el desarrollo de nuevas herramientas para medir cuantitativamente la concentración de oxígeno en los tejidos, más conocida como pO2. Si bien este programa de investigación comenzó en respuesta a los desafíos planteados en la terapia del cáncer, nuestro enfoque cambió después de que tuve la oportunidad de visitar el Centro para los Intrépidos en el Centro Médico de San Antonio.
Conocer a soldados heridos y saber la gran cantidad de desafíos que enfrenta su atención nos llevó a mi equipo y a mí a lanzar un programa de investigación para desarrollar sensores de oxígeno molecular que podrían aplicarse directamente a la atención del paciente. Junto a Manolis Rousakis, un instructor de mi equipo, se creó una serie de sensores de oxígeno de porfirina ultrabrillante y aprendimos a incorporar y conjugar estos sensores en una amplia gama de materiales y factores de forma con el fin de visualizar y cuantificar directamente el oxígeno tisular.
Hemos creado películas, vendajes que pueden ser pintados y rociados, materiales de vendaje de hidrogel, sensores ponibles y, más recientemente, sensores basados en agujas y catéteres, cada uno de los cuales se orienta a diferentes necesidades de atención médica de pacientes y militares. Ahora estamos trabajando con socios comerciales para transformar estas tecnologías en productos reales en busca de mejorar la salud de los pacientes.
2. Herramientas para visualizar y medir la captación de fármacos y los efectos terapéuticos in vivo
Dr. Evans: Uno de los mayores desafíos en el desarrollo de fármacos es asegurar el alcance de sus objetivos celulares y subcelulares. Si bien las moléculas más grandes, como los productos biológicos, pueden marcarse fácilmente, esto puede ser un desafío para los medicamentos de moléculas pequeñas, ya que el marcado tradicional puede ser más grande que la molécula en sí y alterar por completo su farmacocinética. [Ciertas] técnicas como el marcado radiográfico y los métodos de espectrometría de masas ofrecen información sobre la captación de fármacos, pero estas técnicas no son compatibles con la investigación clínica o requieren una biopsia.
Estamos interesados en técnicas que permitan el procesamiento de imágenes y la cuantificación de medicamentos en función de las propiedades intrínsecas de la molécula, como los parámetros de fluorescencia y las vibraciones químicas. Desarrollamos métodos de procesamiento de imágenes que emplean la persistencia de la fluorescencia y técnicas de imágenes por dispersión Raman coherente con aplicaciones actuales en la cuantificación dermatológica tópica. Mediante la estrecha colaboración con nuestros socios comerciales y la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA), estamos creando nuevos métodos de imágenes por dispersión coherente Raman para medir la biodisponibilidad y la bioequivalencia de los medicamentos, la última de las cuales podría ser una herramienta importante para el desarrollo de medicamentos tópicos genéricos.
Para llevar estas herramientas del laboratorio a la clínica, hemos construido un sistema de dispersión Raman coherente basado en un carrito que en los próximos meses debería iniciar con los primeros estudios clínicos en humanos. Nuestro objetivo es hacer la correspondencia entre la observación de la absorción del medicamento y los efectos terapéuticos posteriores, a fin de crear una comprensión integral a nivel de célula-tejido de la respuesta al tratamiento farmacológico. Consideramos este enfoque de procesamiento de imágenes clínico como el primer paso para evaluar directamente la captación de fármacos tanto en individuos sanos como en pacientes enfermos con el propósito de desarrollar mejores terapias e intervenciones.
3. Análisis de imágenes por aprendizaje profundo
Dr. Evans: El aprendizaje profundo ha sido una herramienta extraordinaria para superar algunos de nuestros mayores desafíos tanto en el análisis de imágenes como en el análisis de señales. Nuestros microscopios y sensores generan enormes cantidades de datos —a veces cientos de gigabytes por día— que exigen un análisis automatizado.
Simplemente no hay forma de que una persona, o incluso un equipo de científicos, pueda clasificar manualmente tantos datos de imágenes. Era frustrante trabajar con métodos de visión artificial y de análisis computacional que, a pesar de ser efectivos, podían fallar o introducir sesgos en el análisis, en especial si se considera que al mirar una imagen se podía saber al instante qué había salido bien o mal.
El aprendizaje profundo ha permitido transferir nuestra experiencia e intuición a una computadora/un ordenador, y ello ha conducido a la automatización completa de nuestras complejas tareas analíticas. Hemos podido aplicar el aprendizaje profundo a nuestro estudio de farmacocinética, así como a nuevas áreas, por ejemplo, a nuestros sensores de oxígeno ponibles. Nos emociona lograr progresos en la computación periférica, en la que los modelos de aprendizaje profundo pueden usarse directamente en dispositivos a partir de aplicaciones que van desde el desarrollo de fármacos hasta sensores ponibles en medicina.
P: ¿Cuál es el tema de investigación que le anima más o una pregunta fundamental que le gustaría desvelar?
Dr. Evans: Diría que un tema recurrente en mi investigación ha sido hacer visible y cuantificable lo «invisible». Siempre me ha interesado capturar información que normalmente no es perceptible o está fuera de alcance; es algo así como una peculiaridad profesional. Mi equipo y yo hemos trabajado para crear métodos, herramientas y sensores con el fin de descubrir estos parámetros y hacerlos cuantificables, ya sea a nivel de la concentración de oxígeno en los tejidos, la cantidad del fármaco que alcanza un objetivo o el estado de una célula sometida a terapia.
P: ¿Qué le inspira en la búsqueda de información oculta o «invisible»?
Dr. Evans: Durante mi doctorado, trabajé en un problema complejo relativo al procesamiento de imágenes por espectroscopía Raman coherente, el cual trataba de suprimir la contribución no resonante en la microscopía CARS. Las imágenes CARS sufren esta contribución químicamente imprecisa que ha sido una barrera importante en las aplicaciones de biología y medicina.
La forma en que se supuso que este contexto podría identificarse y eliminarse fue a través de una fase: es decir, la contribución no resonante era matemáticamente «real», mientras que la contribución resonante, químicamente específica, tenía contribuciones tanto «reales» como «irreales» a nivel matemático. Se halló una manera de aislar estos dos componentes (en particular, el componente de imagen del campo CARS) y suprimir la contribución no resonante a través de la interferometría. Brian Saar, que en ese entonces era estudiante del laboratorio de Sunney, comentó a modo de broma que había «hecho real lo imaginario»; eso me encantó y me lo tomé a pecho durante el transcurso de mi carrera.
P: ¿Qué busca aprender a través de su investigación? ¿Y, qué relación tiene con la microscopía?
Dr. Evans: ¡Hay mucho que aprender! Uno de los aspectos extraordinarios y desafiantes de trabajar codo a codo con los médicos es que uno se siente siempre boquiabierto ante los aspectos desconocidos o poco entendibles de la medicina y la biología. Hay una infinidad de cuestiones por resolver. Espero poder continuar mi enfoque en la resolución de problemas asociados a la salud humana y la medicina, y sacar provecho tanto de la fotoquímica como de la fotónica: dos herramientas de desarrollo que se complementan y se traducen de forma inminente.
La microscopía se halla en el cruce de la fotoquímica y la fotónica. La primera proporciona el contraste molecular. Esta última ofrece los medios para ver, detectar y cuantificar. Personalmente, considero que la microscopía es el eje de mi investigación, ya que nos brinda la oportunidad de comprender directamente el proceso espaciotemporal, ya sea en tejidos o células.
Muchos de nuestros objetivos de investigación a corto y largo plazo se ven favorecidos por los continuos avances de las técnicas microscópicas, como es el caso de nuestros esfuerzos en la farmacología y la biología del cáncer. Estos beneficios se transfieren de los microscopios a nuestro trabajo en vendajes y sensores ponibles. A menudo recurrimos al procesamiento de imágenes y la microscopía para comprender los métodos de fabricación, las propiedades de los materiales y otros aspectos. Esto hace que la microscopía sea un recurso fundamental dedicado a respaldar nuestros esfuerzos en la investigación de problemas.
P: ¿Cómo aplica el procesamiento de imágenes multifotón y confocal en su trabajo?
Dr. Evans: Diría que el procesamiento de imágenes multifotón junto con el confocal ha sido el aspecto principal de mi investigación, lo que ha representado un importante cimiento. El procesamiento de imágenes por dispersión Raman coherente, una herramienta fundamental en nuestro trabajo, es una técnica multifotónica que proporciona múltiples ventajas clave para el procesamiento de imágenes de dos y tres fotones: excitación de luz infrarroja cercana, imágenes de tejidos profundos y seccionamiento de profundidad automático. Hemos desarrollado un procesamiento de imágenes por dispersión Raman coherente, en el que interviene tanto la espectroscopía Raman coherente Anti-Stokes (CARS) como la espectroscopía Raman estimulada (SRS) a modo de herramientas de investigación biomédica cuya posición entre las aplicaciones clínicas directas en humanos se halla hoy en la cúspide.
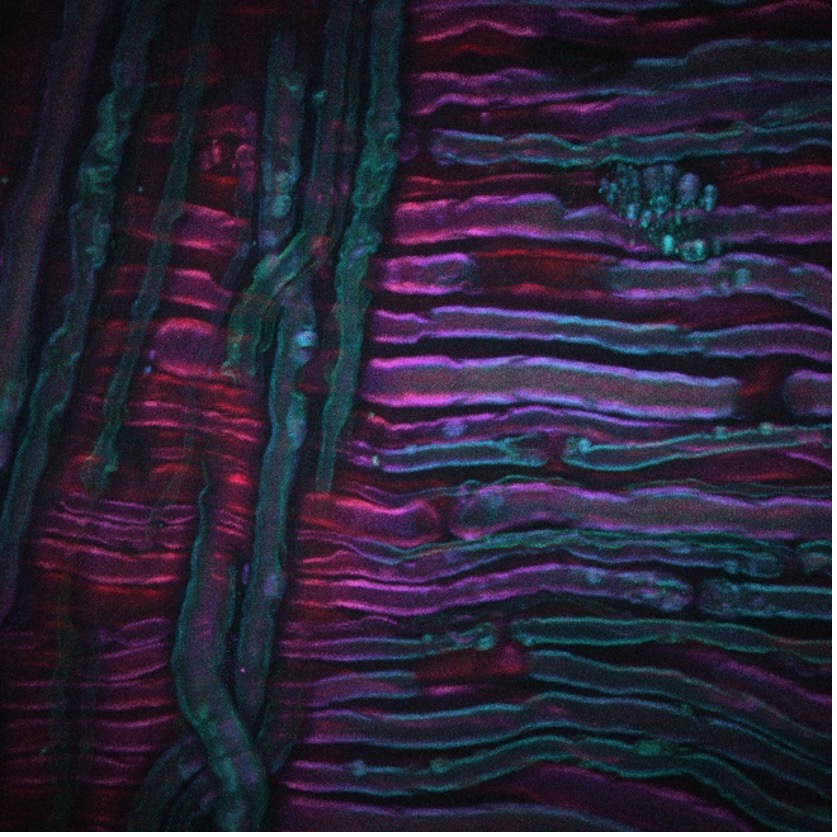
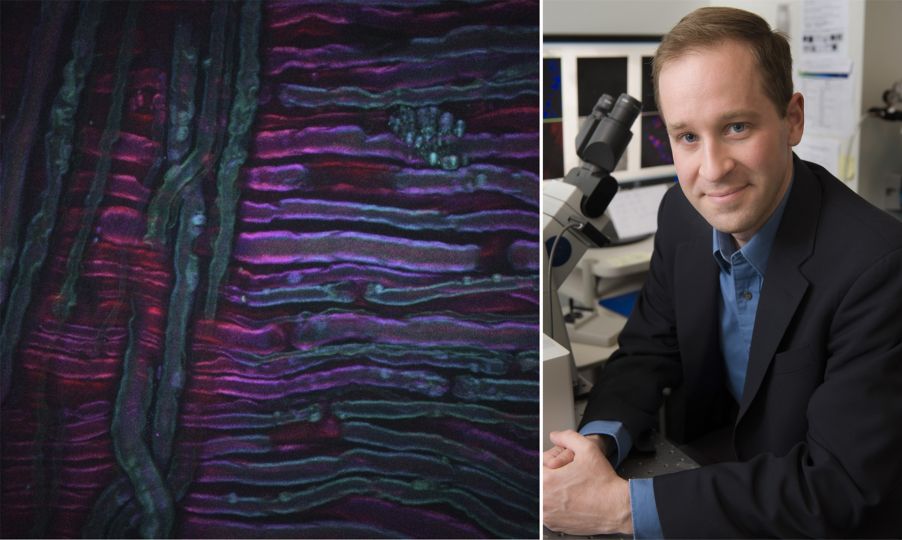
Un ejemplo de la CARS es la imagen anterior adquirida a partir del nervio ciático de una rata sometido a una crioterapia, la cual es una nueva técnica para el tratamiento del dolor que están desarrollando nuestros colaboradores Lilit Garibyan y Rox Anderson, aquí, en MGH. El sistema de procesamiento de imágenes por CARS se afinó en el estiramiento simétrico del grupo CH2 de lípidos insaturados, lo que reveló la distribución de la mielina. Los créditos de la imagen van al Dr. Isaac Pence, investigador de mi equipo, y a la Dr.A Sara Moradi Tuchayi, que sin ella no hubiera sido posible la captura.
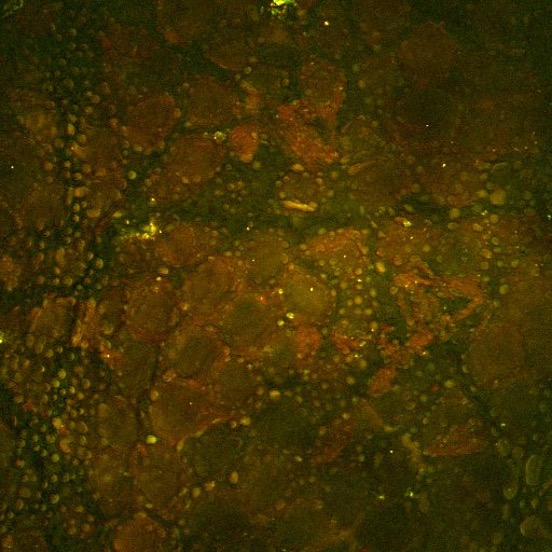
El segundo ejemplo de arriba es una imagen obtenida por SRS del medicamento ruxolitinib (verde, SRS sintonizada en la banda vibratoria del nitrilo), que ha sido administrado con etanol a la superficie de la piel del ratón. Aquí puede verse el fármaco acumulado dentro de las características ricas en lípidos del estrato córneo del ratón mediante la SRS sintonizada en la vibración de estiramiento simétrico del grupo CH2 (rojo). Los créditos de la imagen van al Dr. Amin Feizpour, quien fue investigador en mi equipo.
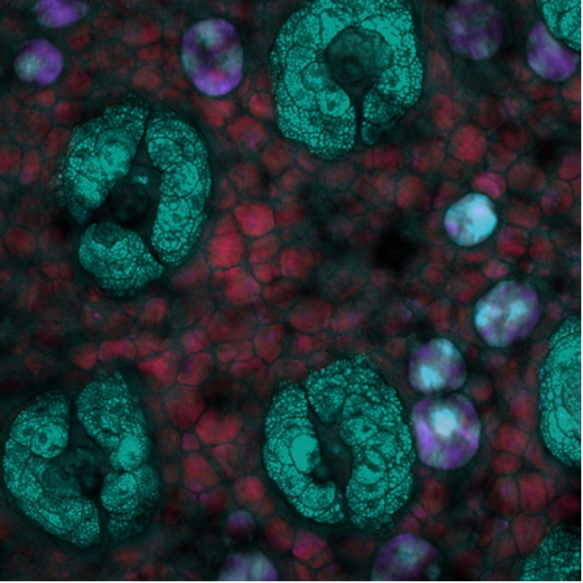
Por último, está esta imagen de profundidad por SRS que fue adquirida a partir de la piel del ratón donde la profundidad se codifica cromáticamente. Aquí, pueden verse estructuras únicas, ricas en lípidos, dentro de la piel del ratón a través de diferentes profundidades gracias al sistema sintonizado para la vibración de estiramiento simétrico del grupo CH2. Los créditos de la imagen van al Dr. Isaac Pence.
P: ¿Puede compartir algún logro destacable?
Dr. Evans: Este año ha marcado algunos hitos para nuestro equipo, tanto a nivel de los programas de microscopía como del estudio de sensores. La revista académica Science Advances publicó nuestro primer estudio de herramientas para la detección de oxígeno en humanos y ahora estamos llevando a cabo tres estudios adicionales en humanos con esta nueva plataforma de detección. También se ha iniciado la colaboración con la empresa 3M para poner en práctica estas herramientas de nuestro laboratorio en productos.
Con respecto a la microscopía, estamos ansiosos de poder publicar nuestro nuevo método llamado dispersión Raman estimulada por muestreo espectral disperso (S4RS), que supera muchas de las barreras a las que nos hemos enfrentado en el procesamiento de imágenes por espectroscopía Raman coherente a través de los últimos años. Este método usa un láser de fibra, sintonizable de forma rápida, para saltar a bandas Raman específicas a través de todo el espectro Raman, en lugar de ajustar toda la extensión. Esto permite una adquisición espectral rápida y químicamente específica en todo el espectro Raman, además de viabilizar el procesamiento de imágenes y la cuantificación de una amplia gama de especies moleculares, como fármacos y metabolitos. En tándem, hemos usado este sistema láser para crear un sistema de procesamiento de imágenes Raman clínicamente coherente, que empezará a funcionar este año para los primeros estudios en humanos.
A pesar de los desafíos causados por el COVID-19, mi equipo ha logrado un trabajo extraordinario al poner en práctica estas tecnologías. No podría estar más orgulloso de lo logrado.
P: En su opinión, ¿cuál podría ser la próxima revolución de la microscopía?
Dr. Evans: Desde mi punto de vista, un gran problema en la microscopía es la avalancha de datos que todos experimentan. Los microscopios multicanal automatizados son magníficos para recopilar grandes cantidades de datos. Se han desarrollado protocolos de procesamiento de imágenes que permiten recolectar múltiples tinciones, fluorocromos, canales espectrales y otros puntos de datos de manera rápida y eficiente.
Pero, lamentablemente, esto crea una problemática de extracción de la información en curso a partir de los masivos conjuntos de datos que han sido adquiridos. Los datos de microscopía son ricos en información. La recopilación de conjuntos de datos a partir de cinco dimensiones es relativamente sencilla, y estos datos son espaciales, espectrales y temporales. A pesar de que es posible clasificar estos datos de forma manual, los conocimientos profundos y el rigor estadístico requieren un análisis computacional de estos complejos datos multidimensionales.
Por tanto, creo que la próxima revolución en microscopía superará estos grandes desafíos planteados por los datos, sin contar que ya es un hecho. Los avances en la visualización de datos, los algoritmos de análisis de imágenes y el aprendizaje automático están desempeñando un papel importante al abordar los desafíos —tanto mediados como grandes— que plantean los datos de microscopía. Ya se ven trabajos neurocientíficos punteros, bajo proyectos de conectomas y atlas cerebrales que muestran lo que podría venir.
Estos programas, sin embargo, representan enormes esfuerzos animados por una multitud de investigadores interdisciplinarios, científicos de datos y programadores que apoyan e incentivan el progreso. En este momento, sin embargo, estos recursos no están disponibles para laboratorios más pequeños. Esto se agrava debido a que la trayectoria de capacitación tradicional de los investigadores en microscopía aún no enseña universalmente las habilidades necesarias para manejar conjuntos de datos de imágenes grandes y complejos. Si bien esta revolución ya está ocurriendo, requerirá nuevas perspectivas en la forma de capacitar a los estudiantes y becarios, así como en la forma de abordar los datos de microscopía con el fin de que estos avances lleguen a los que trabajan en la microscopía.
Esta revolución es particularmente importante para el futuro traduccional de la microscopía, donde las imágenes a microescala desempeñarán en todo un papel cada vez más importante, desde el diagnóstico de enfermedades hasta las terapias personalizadas. Sin contar que ya existen las «píldoras» de Gary Tearney habilitadas para la microscopía, que al ser engullidas proporcionan diagnósticos in situ, análisis de citometría de flujo de imágenes a partir de células derivadas de pacientes, y la detección terapéutica de alto rendimiento a partir de células T con receptores quiméricos de antígenos (CAR-T).
A medida que estas plataformas basadas en la microscopía se expanden a más aplicaciones de pacientes, la avalancha de datos solo incrementará y la necesidad de dominarlos y sobrellevarlos se volverá aún más importante.