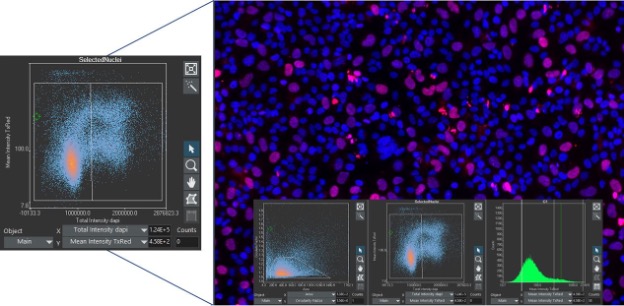
La citometría de flujo es una de las principales técnicas usadas para identificar y segmentar poblaciones celulares debido a su capacidad para evaluar con rapidez grandes poblaciones de células usando marcadores fluorescentes. Sin embargo, la citometría de flujo tiene sus limitaciones y su reconsideración se lleva a través de otras técnicas. Con el avance de las herramientas analíticas de imagen, la citometría de imagen ha surgido como una mejor manera de acceder a una mayor cantidad de información mientras se evalúan grandes poblaciones celulares.
A través de este blog, se explorará la citometría en detalle y se compartirá cómo el campo en expansión de la citometría de imagen proporciona a los investigadores potentes herramientas para mejorar su trabajo.
¿Qué es la citometría de flujo?
Durante décadas, una de las principales herramientas para identificar y analizar los marcadores moleculares en las poblaciones celulares ha sido la citometría. Mediante esta técnica, las células se disocian en una suspensión de célula única y se marcan con anticuerpos de marcado de fluorescencia para poder centrarse en los marcadores de interés. Después, estas células pasan a través de una citometría de flujo a partir de la cual son analizadas de forma individual en función de la expresión de cada marcado, lo que se traduce en la obtención de datos valiosos cuantificables sobre la población celular.
Esta herramienta fundamental permite que los investigadores cuantifiquen la presencia y la intensidad de las proteínas en sus células de interés, lo que posibilita la segmentación e identificación de las poblaciones celulares, así como la clasificación de las células.
Deficiencias de la citometría de flujo
Si bien la citometría de flujo puede proporcionar grandes volúmenes de datos cuantificables a nivel celular, esta técnica presenta deficiencias debido a que la medición debe ejecutarse a partir de células solas en suspensión.
Entre las deficiencias de la citometría de flujo, destacan las siguientes:
- Varias células son cultivadas al mismo tiempo que se adhieren a las placas y los andamios de cultivo celular de tejidos, o a tejidos/estructuras con otras células. Cuando las células se encuentran disociadas de su ambiente, su expresión proteica puede cambiar. Además, los datos podrían perderse a partir de las interacciones proteicas entre las células.
- Es imposible acceder a los datos relativos a la morfología de la célula, o a la ubicación de los marcadores celulares.
- El estrés causado a las células durante la citometría de flujo puede tener efectos en la continuación de los análisis de crecimiento posteriores. Por lo general, grandes cantidades de células no sobreviven al proceso.
- Las herramientas de medición usadas en una citometría de flujo limitan las visualizaciones de los datos cuantitativos en los diagramas. La evaluación visual de las células es improbable.
Debido a estas deficiencias, los análisis de citometría de flujo son siempre complementados con la técnica de tinción inmunohistoquímica en el ambiente celular. Sin embargo, la mayoría de las herramientas analíticas de imágenes no pueden proporcionar el mismo nivel de datos cuantitativos, y las características estructurales de las células individuales no pueden correlacionarse una a una con su análisis mediante la citometría de flujo.
El campo en expansión de la citometría de imagen aborda estos puntos de especial interés mediante el uso de herramientas analíticas de imagen cuyos datos cuantitativos sobre poblaciones celulares son equivalentes a los de la citometría de flujo. Nuestra estación y el software de cribado de alto contenido scanR son ejemplos de herramientas que pueden cubrir estas necesidades.
Beneficios de la citometría de imagen
En la citometría de imagen, las células son procesadas en imagen directamente desde su ambiente de cultivo; estas imágenes seguirán un proceso y una translación hacia análisis cuantitativos en función de los parámetros de interés.
Entre los beneficios de la citometría de imagen, destacan los siguientes:
- Riesgo reducido de cambios en la expresión proteica que pueden ser causados por la disociación.
- Mantenimiento de los datos relativos a la morfología celular y localización proteica, con posibilidad de ser integrados en los análisis cuantitativos. Por ejemplo, es posible determinar la población celular que expresa altos niveles de un marcador dentro del núcleo.
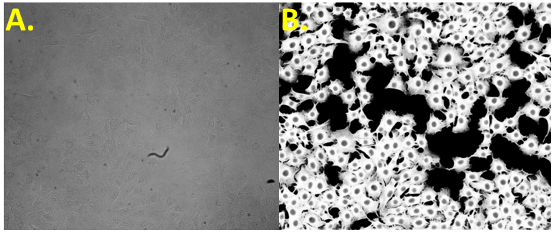
- No se aplica ningún estrés en las células durante el análisis. Aún más, la citometría de imagen puede sacar provecho de la inteligencia artificial (IA) para identificar las células y las características celulares con tinción mínima o ninguna tinción. Esto permite asegurar la continuación del cultivo de las células seleccionadas tras el análisis.
- Las mismas células pueden ser monitoreadas y seguidas con el tiempo. Esta técnica es valiosa en el descubrimiento de drogas, diferenciación de células, etc. Por ejemplo, si un investigador desea ver los efectos de un medicamento en las células primarias de un paciente a lo largo del tiempo mediante la citometría de flujo, las células deberán crecer y ser tratadas en replicas adicionales por cada punto temporal puesto que se requiere la disociación. Dado que las células pueden permanecer en un ambiente de cultivo durante la citometría de imagen, la misma replica puede ser medida a través de múltiples puntos temporales.
Si el investigador está familiarizado con la citometría de flujo, analizar los datos mediante la citometría de imagen a partir del software scanR es una transición fácil, ya que se usan histogramas similares y diagramas de dispersión para proyectar los datos. Tal y como se hace en la citometría de flujo, las poblaciones celulares pueden ser seleccionadas mediante puertas a partir de los gráficos con el fin de llevar a cabo análisis multinivel. A diferencia de la citometría de flujo, cada parámetro evaluado puede relacionarse con la imagen para ser confirmados visualmente; esto se debe a que los datos son recogidos directamente a partir de las imágenes.
Tome en cuenta el siguiente ejemplo: En el software scanR, es posible hacer clic en cualquier punto de datos para visualizar la célula objetivo, o crear una galería de imágenes a partir de una población celular controlada por puertas. Esto agrega un nivel de certeza visual con respecto a que las poblaciones celulares se encuentran segmentadas correctamente y que se han identificado las poblaciones de interés correctas.
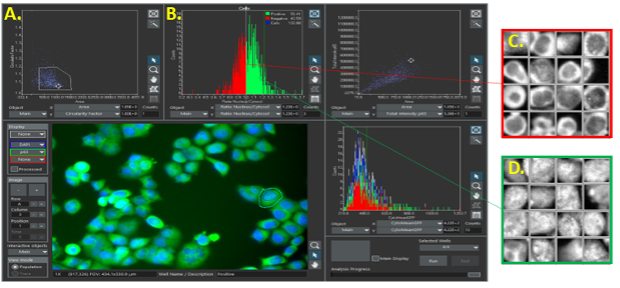
Citometría de imagen con el software scanR. A) Puntos identificados a medida que las células son controladas por puertas y proyectadas posteriormente como histogramas. (B) Las células son separadas en dos poblaciones, cuya visualización puede darse a partir de galerías de imágenes.
(C y D) En resumen, la citometría de imagen con el software scanR saca provecho de las mejores herramientas analíticas de la citometría de flujo y las combina para en beneficio del análisis de imagen. A continuación, vea la tabla que ofrece un resumen de las ventajas:
Comparación de las ventajas que ofrece la citometría de flujo y la citometría de imagen
| Citometría de flujo | Citometría de imagen | |
|---|---|---|
| Estado celular | En suspensión | En ambiente de cultivo |
| Tamaño de conjunto de datos | Ilimitado | Ilimitado |
| Adquisición y análisis simultáneo | ✓ | ✓ |
| Intensidad de fluorescencia | ✓ | ✓ |
| Localización y distribución de la fluorescencia | ✓ | |
| Morfología celular | ✓ | |
| Análisis multinivel | Limitado | ✓ |
| Clasificación celular | ✓ | |
| Capacidad sin marcado | Limitado | ✓ |
El versátil conjunto de herramientas de la citometría de imagen permite a los investigadores cuantificar y evaluar grandes poblaciones celulares en función de características visibles en una imagen —desde la morfología, la ubicación, la intensidad y la localización de fluorescencia, hasta otras— sin requerir la manipulación de las células. Los investigadores pueden reunir resultados más amplios y profundos a partir de sus experimentos, lo que conllevará a una investigación de mejor calidad y mayor eficiencia.
Contenido relacionado
Video: Presentación de la estación de cribado de alto contenido scanR
Análisis avanzado de células vivas mediante sistemas de cribado de alto contenido por IA