Puede que haya debido postergar su investigación debido al cierre de un laboratorio, una licencia planificada o una emergencia repentina. Sin importar cuál sea la situación, volver al trabajo de laboratorio después de un tiempo puede ser abrumador. ¿Cómo organizase, configurar los propios experimentos y alcanzar los objetivos?
A fin de allanar esta transición hacia el laboratorio, se ha creado esta guía de cuatro pasos para que sus experimentos retomen su rumbo.
1. Activación del equipamiento
Si bien este problema puede parecer fútil, encender el equipamiento de manera incorrecta puede sin duda afectar seriamente el rendimiento del sistema. A continuación, se proporcionan algunas pautas generales a seguir:
- Encender primero el/la PC: El/la PC es el «cerebro» de su sistema microscópico; por consiguiente, recuerde encender su PC e iniciar sesión como primer paso.
- Encender todos los componentes del sistema: Según el sistema que esté utilizando, el orden de activación de los componentes puede ser primordial. Por ejemplo, la caja CBH de los sistemas Olympus debe encenderse antes del TPC. Consulte el manual del sistema para obtener instrucciones específicas.
- Activar el software: De encontrar errores durante el inicio del software, ¡estamos aquí para ayudarle! Comuníquese con su representante de ventas local o contáctenos para asistencia técnica.
2. Prepararse al procesamiento de imágenes
Después de haber activado su sistema, reserve un tiempo para preparar, cargar y nivelar adecuadamente su muestra para la adquisición de imágenes. A continuación, se proporcionarán algunos consejos útiles:
Preparación de la muestra
Primero, seleccione el cubreobjetos apropiado. Los cubreobjetos deben contar con un espesor de 1,5 o 0,17 mm (170 µm). Los objetivos de Olympus que están diseñados para cubreobjetos requieren un espesor adecuado a fin de asegurar una buena calidad de imagen. Si el cubreobjetos es demasiado espeso o muy delgado, pueden generarse artefactos ópticos.
Asegúrese de verificar el espesor o grosor del cubreobjetos y utilice portaobjetos de vidrio estándar. En algunos tipos de aplicaciones, se admiten portaobjetos de plástico. No obstante, en las imágenes de fluorescencia, el plástico posee una propiedad elevada de autofluorescencia. Esto crea un fondo intenso en los canales azules y verdes o, a veces, en los canales rojos.
Por otra parte, es importante limpiar tanto el cubreobjetos como el portaobjetos antes de capturar las imágenes. Una buena solución limpiadora es etanol al 70 % con agua destilada. Otra opción es un limpiador óptico, como Sparkle Optical Lens Cleaner del fabricante A. J. Funk and Co.
Durante la limpieza de los componentes ópticos, utilice siempre papel para lentes. Los pañuelos faciales o de laboratorio son abrasivos y pueden dañar las superficies de dichos componentes.
Carga de muestra
A continuación, cargue la muestra preparada siguiendo la orientación correcta para su microscopio. Siempre cargue los cubreobjetos orientados hacia arriba cuando se trata de un microscopio vertical, y hacia abajo en el caso de un microscopio invertido.
Con un microscopio invertido, es importante verificar que su muestra esté bien sellada. Si la muestra no está bien sellada, el líquido puede entrar en contacto con sus objetivos o con el portaobjetivos. Este líquido puede corroer u oxidar los revestimientos ópticos, el adhesivo óptico u otras partes del hardware o la electrónica del microscopio.
Cuando cargue la muestra, preste especial atención a la distancia de trabajo del objetivo. En términos sencillos, la distancia de trabajo es cuán cerca debe estar el objetivo para enfocar la muestra. Las distancias de trabajo pueden variar desde un poco más de 100 µm hasta varios milímetros.
¿Necesita verificar la distancia de trabajo de su objetivo? Consulte las especificaciones inscritas o nuestro catálogo de objetivos en línea.

Figura 1. Los microscopios invertidos requieren que los portaobjetos se carguen orientados hacia abajo. Un error común es cargar portaobjetos con el cubreobjetos hacia arriba en un microscopio invertido, lo cual produce una imagen borrosa. Siempre verifique que las superficies ópticas estén limpias y utilice papel para lentes a fin de limpiarlas.
Nivelación de la muestra
Los investigadores a menudo no necesitan preocuparse por la planitud de la muestra. La platina es fija y plana y tanto el portamuestras como el portaobjetos son planos.
Sin embargo, en aplicaciones más sensibles como la microscopía confocal, TIRF o mosaico, la planitud de la muestra es fundamental. Esto quiere decir que, cuando la muestra está inclinada, pueden aparecer sombras. El sombreado puede provocar artefactos al unir imágenes o cambios en la intensidad según su posición en la imagen.
Una forma de mejorar la planitud de la muestra es por medio de los tornillos niveladores que se encuentran en algunas platinas de inserción. Por lo general, se encuentran en las esquinas de la platina de inserción. La desalineación de los tornillos niveladores es una fuente común de inclinación de la muestra. Si le preocupa la inclinación de la muestra generada por la platina de inserción, retirar completamente sus tornillos es un método válido.
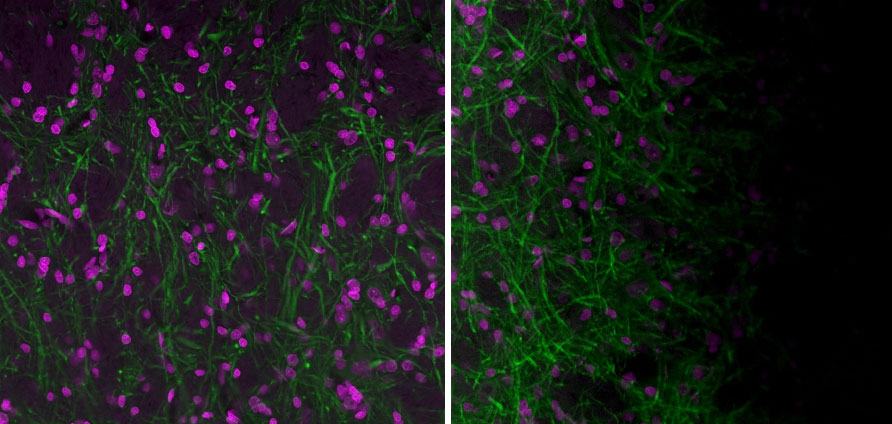
Figura 3. Izquierda: Imagen adquirida por un microscopio confocal de escaneo láser Olympus FV3000 con una óptima alineación y muestra plana. Derecha: Imagen adquirida por un microscopio FV3000 con una óptima alineación y muestra exenta de planitud. A veces es difícil determinar el origen del sombreado. A menudo, una muestra que no presenta planitud en el portamuestras puede causar el artefacto de sombreado. Imágenes adquiridas con un objetivo UPlanXApo de 20X. El magenta es el colorante Hoechst y el verde es el colorante MAP2 (MCA-5H11) con tinción Alexa 488.
Determinar el medio de inmersión
Olympus ofrece cinco principales tipos de objetivos: secos (por aire), inmersión en agua, mojado en agua, inmersión en aceite estándar y en aceite de silicona. Si se utiliza un medio de inmersión incorrecto en el objetivo, la calidad de la imagen se degradará. Además, pueden producirse daños si el aceite ingresa a ciertas partes de un objetivo que no está diseñado para tal uso.
Por dichos motivos, es fundamental conocer el medio de inmersión dedicado a su objetivo. Nuestros objetivos presentan una codificación cromática para poder reconocer fácilmente el medio de inmersión que requieren y su uso correcto.
Por otra parte, es necesario tomar en consideración su flujo de trabajo. Puede que no quiera capturar imágenes en 60X usando aceite de silicona, para luego alternar en un instante a un objetivo de inmersión en agua de 60X. La mezcla de aceite de silicona y agua no dará imágenes nítidas. Además, el portaobjetos tendría que ser retirado y limpiado antes de usar la inmersión en agua.
Por último, asegúrese de utilizar el aceite recomendado por el fabricante de sus objetivos dada su especialización óptica.

Figura 4. Aceite estándar/Aceite de inmersión tipo F (izquierda) y aceite de inmersión de silicona (derecha). Olympus ofrece una variedad de lentes para el aceite estándar y el aceite de inmersión de silicona. El uso del aceite correcto es vital para asegurar el éxito de las imágenes. Evite mezclar estos dos aceites en un cubreobjetos.
3. Adquirir imágenes
Ahora que tiene su muestra preparada, puede iniciar con la etapa de adquisición de imágenes. A continuación, se ofrecen algunos consejos útiles para la captura de imágenes:
Prácticas más adecuadas para adquirir imágenes
Cuando se adquieren imágenes usando la microscopía de fluorescencia confocal o de campo amplio, por lo general, se prefiere aplicar baja iluminación y mayor sensibilidad de detección o ganancia. Esto reduce la irradiación dañina del láser o de la lámpara de arco que provoca el fotoblanqueo y los cambios en la biología.
Ciertos canales iónicos y vías muertas pueden activarse mediante la luz de excitación. Sin embargo, debe aplicarse suficiente iluminación para producir una imagen de calidad adecuada. La alta iluminación puede generar una imagen sorprendente. Tenga en cuenta el equilibrio que debe mantenerse entre la luz de excitación, la luz de detección y el objetivo experimental final.
Collar de corrección
Algunos de nuestros objetivos cuentan con un collar de corrección. Su uso puede resultar confuso sin una capacitación adecuada. Las líneas directrices generales engloban:
- Uso de la marca 0.0 en caso de ningún cubreobjetos o 0.17 para cubreobjetos #1.5.
- Verificación de la marca en el collar de corrección en función de la temperatura activa. Algunos objetivos brindan diferentes escalas en función de la temperatura ambiente o de 37 °C (98,6 °F). Configure el collar de corrección, comience a obtener imágenes y optimícelo mientras mantiene el enfoque para dar brillo a la imagen. Este último paso requiere paciencia y práctica. Si no se logra una optimización, manténgase cerca de las marcas generales del collar de corrección de 0.0 o 0.17 como primer paso.

Figura 5. Tres objetivos de 60X. El objetivo UplanXApo de 60X (derecha) que usa aceite estándar y no posee collar de corrección. El objetivo UplanApo de 60X (izquierda) que usa un collar de corrección configurado a 0.17 (cubreobjetos #1.5). El objetivo UPlanSApo de 60X (centro) que usa aceite de silicona y el collar de corrección determinado a 0.17 (#1.5) en función de 37 °C (98,6 °F). Optimizar la posición del collar de corrección puede ser clave para lograr una imagen nítida.
Alineación del condensador
Si la fluorescencia es su aplicación principal, es posible que el condensador no sea utilizado durante el funcionamiento normal del microscopio. En dicho caso, use las perillas del condensador para alejar el condensador de la muestra.
Si proyecta un procesamiento de imágenes de campo claro, contraste de fase o DIC, el primer paso suele ser verificar la alineación del condensador. En el modo de campo claro, enfoque la muestra y, a continuación, cierre el diafragma del campo para visualizar las hojillas del condensador. Este proceso es más fácil al usar una magnificación de 10X o 20X.
Si las hojillas del condensador no están afiladas o centradas, alinee el condensador con respecto a la altura y centrado a través de la iluminación Köhler. Para encontrar información sobre la alineación del condensador a través de la iluminación de Köhler, visite nuestro Centro de recursos de microscopía.
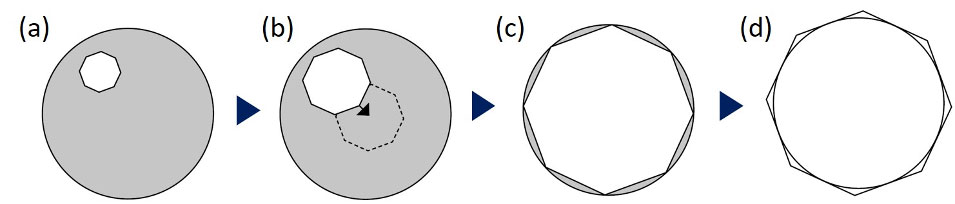
Figura 6. Procedimiento de alineación del condensador: (a) cierre el diafragma del campo, (b) centralice el centro de la hojilla del diafragma, (c) confirme el centro preciso, mediante la inscripción de la hojilla en el borde del campo de visión, (d) luego proceda a la circunscripción de la hojilla.
Tamaños de archivo
Los archivos de microscopios pueden ser bastante grandes. Sin embargo, es posible adoptar ciertas medidas para optimizar el tamaño de los archivos. Por ejemplo, si no necesita datos, la idea de obtener imágenes de todo «por si acaso» puede hacer la vida más difícil.
Prevea lo que necesita entre resolución, profundidad de bits y campo de visión. Evite crear imágenes de lo que posiblemente necesite; el hecho de tener archivos más grandes de lo necesario crea una carga no deseada en el almacenamiento y procesamiento de datos.
Almacenamiento de archivos
Guarde los archivos lo antes posible. Las fallas de PC o disco duro pueden ocurrir en cualquier momento; por lo tanto, guarde sus archivos en más de una ubicación.
Tenga cuidado al utilizar una unidad flash USB o disco duro externo. Estos son propensos a contaminaciones de virus y pueden propagar la contaminación o el software maligno de un(a) PC a otro(a).
Puede que de inmediato la contaminación no sea obvia en un(a) PC dotado(a) con un sistema de procesamiento de imágenes. El sistema puede parecer lento o bloquearse aleatoriamente. Muchos sistemas de procesamiento de imágenes no cuentan con un software antivirus que prevenga un fallo en su rendimiento. Por ello, los/las PC con sistemas de procesamiento de imágenes son más difíciles de contaminar.
Para mitigar estos riesgos, escanee las unidades de almacenamiento externas antes de conectarlas al/a la PC con el sistema de procesamiento de imágenes.
Formatos de archivo
Olympus utiliza formatos de archivo patentados, como OIR, OIF, VSI y OIB. Estos formatos:
- Ofrecen imágenes de resolución completa sin compresión.
- Mantienen la arquitectura de archivos apropiada para el sistema de procesamiento de imágenes de Olympus.
- Registran metadatos provenientes de los parámetros de imagen.
El paquete de procesamiento FIJI/ImageJ es capaz de abrir los archivos Olympus por medio de los complementos adecuados instalados. Se recomienda mantener las imágenes en los formatos de archivo de Olympus mientras sea posible, pero se entiende que a veces es necesario exportar los archivos a TIFF, JPEG 2000 u otros formatos.
Tome note de cualquier compresión o resolución reducida que posiblemente haya podido ocurrir debido a las opciones de archivo de exportación o el tipo de archivo de imagen. Evite el uso de imágenes JPEG: estas imágenes suelen estar comprimidas y a menudo se producen pérdidas de datos.
4. Desactivación del sistema
Desactivar su sistema de forma adecuada es tan importante como iniciar correctamente. Estas son algunas buenas prácticas:
Limpiar el sistema microscópico después de su uso
Al finalizar con el procesamiento de las imágenes, la limpieza no solo es lo más respetuoso que se puede hacerse, sino que también evita daños en el hardware.
Por ejemplo, el aceite estándar para objetivos de inmersión en aceite puede secarse y endurecerse si se deja en los objetivos. El aceite que se ha dejado fuera durante días es difícil de limpiar e incluso puede derramarse sobre otras superficies del microscopio. Conozca cómo se deben limpiar las lentes de objetivos a través del siguiente blog: Seis consejos para limpiar correctamente el aceite de inmersión de sus objetivos.
A menudo, se percibe esmalte de uñas, proveniente de los portaobjetos o reactivos de limpieza cáusticos, en la platina del microscopio o en el área de procesamiento de imágenes. Limpie estas superficies, en especial, donde hayan líquidos u otros residuos visibles. Las superficies que, por lo general, entran en contacto entre sí (las lentes de los oculares, el control del panel táctil y los tonillos de enfoque) son áreas propensas a contaminarse e infectar usuarios en secuencia.
Para reducir cualquier propagación viral, es importante limpiar estas superficies. Se recomienda usar etanol al 70 % con agua destilada sobre el papel para lentes en el caso del controlador del panel táctil y los oculares. Asegúrese de quitar las copas oculares de goma alrededor de los oculares para evitar que el alcohol las dañe. También, se recomienda limpiar la superficie de la platina, la mesa elevadora o la mesa de trabajo con etanol al 70 % y agua destilada junto con Kimwipes o toallas de papel.
Un buen principio orientador es dejar el sistema microscópico mucho mejor de la forma en que lo encontró. Retire cualquier muestra del área del microscopio después de adquirir las imágenes de interés. La mayoría de las muestras se almacenan mejor a: 37 °C (98,6 ° F); temperatura ambiente; 4° C (39,2 ° F); –20 ° C (–4 ° F), o –80 ° C (–112 ° F). La mayoría de los portaobjetos o placas se almacenan para evitar que se rompan y puedan mantenerse en la oscuridad. Algunas muestras deben regresar a la incubadora de cultivos celulares.
Para obtener más consejos de limpieza, consulte nuestra tan apreciada guía:¿Cómo limpiar y esterilizar su microscopio?.
Apagado del sistema microscópico
Apagar el sistema correctamente asegura:
- Un mantenimiento adecuado del hardware
- Un sistema listo para el próximo usuario
Antes de desactivar el sistema, verifique cuándo será usado por el próximo usuario. Si el sistema tuviera que ser usado de inmediato, mejor opte por cerrar su sesión y mantenga todo el hardware restante encendido. No obstante, si debe transcurrir más de una hora para un nuevo uso, se recomienda desactivar el sistema. De esta manera se reducirá el uso de los láseres, las lámparas, los ventiladores y otros componentes que deben reemplazarse y repararse en función de las horas de funcionamiento.
Siempre salga del software antes de apagar los componentes de hardware. Por ejemplo, apagar una caja de control de microscopio antes de salir del software puede generar errores y problemas potenciales para el próximo usuario. Recuerde: el software es como el cerebro del sistema de procesamiento de imágenes.
Guía rápida de solución de problemas para regresar al laboratorio
Si un procesamiento de imágenes le plantea problemas, ¡estamos aquí para ayudarlo! A continuación, se proporcionan algunas soluciones a problemas comunes que un microscopista puede experimentar cuando regresa al laboratorio:
Desafío 1: La imagen se ve borrosa. La imagen está enfoca, pero nunca se ve nítida.
Recomendaciones: Limpie los objetivos, el cubreobjetos y los oculares con papel para lentes usando una solución de etanol al 70 % con agua destilada. Asegúrese de usar los cubreobjetos #1.5. Por último, verifique si está usando el medio de inmersión correcto para el objetivo en cuestión.
Desafío 2: Al cambiar el objetivo, se pierde completamente el enfoque.
Recomendaciones: Verifique que las correcciones parfocales estén configuradas en el TPC o el software cuando estos últimos estén habilitados. Confirme que los objetivos estén completamente atornillados. Compruebe los requisitos de inmersión del objetivo. Esto representa verificar si se está usando el medio de inmersión correcto y no está siendo mezclado con otro medio. No es atípico que se requiera un ajuste de enfoque cuando se alterna de una magnificación baja a un alta. Sin embargo, perder el enfoque cuando se pasa de una magnificación alta a una baja indica a lo mejor un problema de parfocalidad.
Desafío 3: Al observar las imágenes fluorescentes adquiridas, la imagen es clara en un lado y oscura en el opuesto. No creo que esto sea correcto.
Recomendaciones: Primero, verifique si este patrón de brillo en un lado y oscuro en el opuesto permanece al trasladar la platina o la muestra al eje XY. Si el patrón permanece, es probable que la muestra no sea plana. Si la muestra parece plana, puede que el láser o la lámpara de arco estén desalineados. En caso tema de que el problema provenga del láser o la lámpara de arco, comuníquese con nosotros para obtener asistencia antes de intentar alinear la trayectoria de la luz de excitación de fluorescencia. Comuníquese con su representante de ventas local o con el Centro de Asistencia Técnica de Olympus.
Desafío 4: Al abrir las imágenes adquiridas en otro software, las imágenes no aparecen tan llamativas como cuando son abiertas con el software Olympus.
Recomendaciones: ¿Los archivos pueden abrirse en otra instalación del software Olympus? Mantenerse dentro de las soluciones de software de Olympus es la forma más conveniente de preservar la resolución o la información de metadatos. Si el software de análisis requiere el formato TIFF u otro formato de archivo genérico, utilice archivos TIFF sin procesar de resolución completa. A menudo, estos archivos TIFF sin procesar aparecen en negro a menos que se abran con un software de procesamiento de imágenes. Asimismo, algunos softwares de Olympus se interpolan cuando se ha aplicado aumento (zoom) en la imagen. No todos los softwares interpolan los píxeles cuando se aplica suficiente aumento. Por ende, esto puede provocar la diferencia de la imagen entre el software Olympus y, por ejemplo, el FIJI/ImageJ.
Desafío 5: El laboratorio donde trabajo ha usado cubreobjetos #1 durante muchos años, y tenemos muchos más paquetes de estos en laboratorio. ¿Cuán importante es cambiar a los cubreobjetos #1.5?
Recomendación: Los objetivos Olympus están diseñados para los cubreobjetos #1.5 a menos que se trate de lentes bañadas en agua. Se producirán artefactos ópticos si no hay suficiente vidrio entre el objetivo y la muestra. Pero, hasta qué punto puede importar esto dependerá del experimento y de los requisitos de la imagen. No obstante, sus imágenes no se mostrarán tan resueltas como podrían aparecer, y las imágenes no serán óptimas. Se recomienda cambiar o los cubreobjetos #1.5 tan pronto como sea posible.
Contenido relacionado
Guía para la reincorporación en laboratorio
Cinco formas prácticas para acelerar sus experimentos en microscopía
.jpg?rev=4C75)
