Visualización de proteínas de reparación del ADN con el microscopio confocal FV3000
Procesamiento de imágenes de células vivas de células U2OS después de un daño en el ADN inducido por láser
Las roturas de la doble cadena de ADN son una de las formas más perjudiciales de daños en el ADN. En respuesta al daño, las trayectorias de respuesta al daño en el ADN (DDR) en la célula se accionan para provocar la captación de factores de DDR en el punto de rotura así como la señalización del punto de control del ciclo celular y la regulación de las actividades de reparación del ADN. La detección y la reparación inmediatas y fieles del punto de rotura son cruciales para la viabilidad de la célula y para prevenir mutaciones que pueden provocar el desarrollo del cáncer. Por ello, es fundamental comprender los mecanismos implicados en el proceso de reparación del ADN. Para esta aplicación, se usó células de cáncer epitelial de osteosarcoma humano (U2OS) con el fin de estudiar la captación de proteínas de reparación del ADN para daños inducidos por láser, incluyendo los puntos de rotura de la doble cadena de ADN, usando el microscopio confocal FV3000. Las imágenes obtenidas nos permitieron (1) determinar la cinética y los niveles de acumulación de las proteínas de separación captadas en los puntos de rotura, y (2) caracterizar la colocalización de los reguladores transcripcionales endógenos y los factores de trayectoria DDR en los puntos de rotura del ADN.
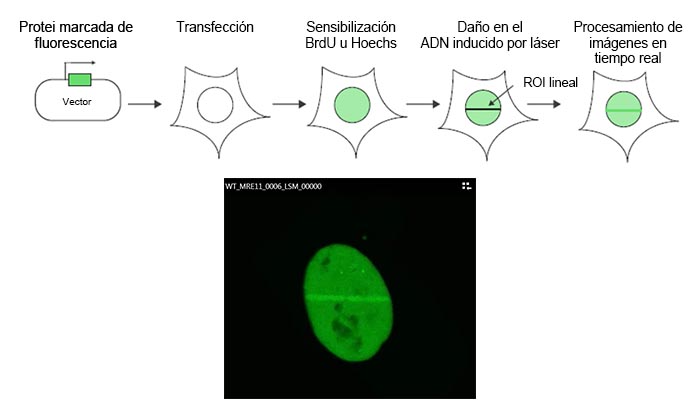
Figura 1: Esquema del protocolo de experimento
El ADN de MRE11 se clona en un vector de expresión marcado con GFP, que después es transfectado a células de U2OS. Después de la sensibilización usando bromodesoxiuridina (BrdU) u Hoechst, el daño en el ADN se induce por medio de un escaneo lineal de la región de interés (ROI) en el núcleo usando el láser de 405 nm del microscopio FV3000. Posteriormente, se ejecuta el procesamiento de imágenes de células vivas con el láser de 488 nm para controlar la cinética de captación de MRE11 en respuesta al daño inducido por láser.
Condiciones de procesamiento de imágenes
Objetivo: objetivo de inmersión en aceite súper corregido 60X (PLAPON60XOSC)
Microscopio: Microscopio confocal de escaneo láser FLUOVIEW FV3000
Láser: 405 nm (estimulación de ROI), 488 nm (GFP, verde)
Procesamiento de imágenes de células vivas para efectuar mediciones cuantitativas
La exposición repetida a la luz láser de excitación durante el transcurso de la imagen de intervalo de tiempo puede generar fotoblanqueo y fototoxicidad, lo que afecta a la capacidad de obtener mediciones de datos cuantitativos del experimento. Conforme a nuestro protocolo, se tenía que equilibrar la estimulación láser potente con un procesamiento de imágenes de células vivas respetuoso para capturar la dinámica de la proteína de reparación cuantificable inmediatamente después del daño en el ADN inducido por láser. Para ello, se usó el microscopio confocal FV3000, que incorpora la tecnología de detección TruSpectral de Olympus, y los detectores GaAsP de alta sensibilidad para minimizar la potencia láser necesaria para el procesamiento de imágenes continuo de nuestras células vivas. Además, hemos usado TruFocus para mantener el enfoque durante todo el experimento de procesamiento de imágenes. Estas tecnologías combinadas permiten obtener datos de intervalo de tiempo precisos que pudimos cuantificar con respecto a la acumulación dependiente de daños del factor DDR MRE11 en puntos de rotura del ADN.
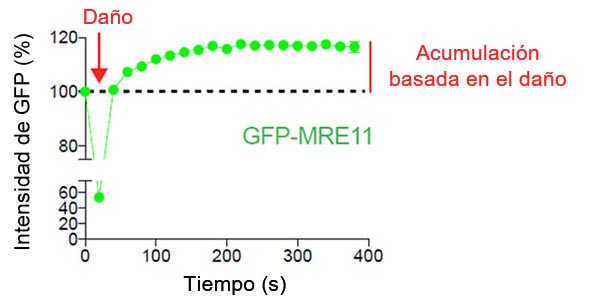 |
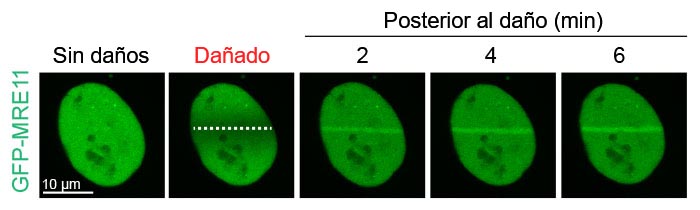
Figura 2: Acumulación de MRE11 basada en el daño en el punto de rotura del ADN
Las células de U2OS que expresaban GFP-MRE11 se sometieron a daños en el ADN inducidos por láser con el láser de 405 nm, seguido de un procesamiento de imágenes de intervalo de tiempo de GFP con el láser de 488 nm. Las células se procesaron durante 6 minutos a intervalos de 20 segundos para visualizar y cuantificar la localización de MRE11 antes y después del daño en el ADN.
El objetivo con súper corrección permite realizar análisis de colocalización precisos
Además de estudiar la cinética del reclutamiento de MRE11 en los puntos de rotura de cadena, también examinamos las respuestas de γH2AX, una proteína histona que se fosforila en las roturas de la doble cadena de ADN y que activa las trayectorias DDR, y CHD4, una proteína que desempeña un papel importante en la regulación transcripcional epigenética. Para llevar a cabo estudios de colocalización precisos, fue importante minimizar la aberración cromática, que puede provocar un desplazamiento lateral considerable de los distintos canales de adquisición. Para minimizar los efectos de la aberración cromática en nuestros estudios de colocalización, se usó el objetivo de aberración cromática súper corregida para obtener imágenes de colocalización fiables con una aberración cromática axial y lateral extremadamente baja. Esto nos permitió determinar que CHD4 y γH2AX colocalizan en puntos de daños del ADN en el núcleos.
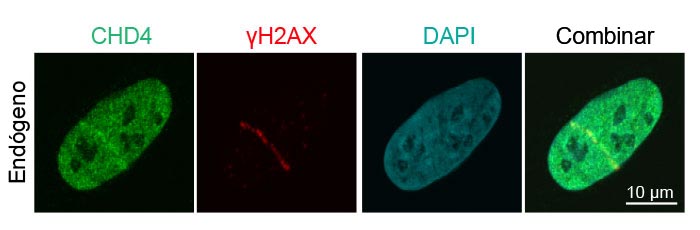
Figura 3: Captación de proteínas de reparación del daño en el ADN endógeno para roturas de la cadena de ADN
Detección de células cancerígenas epiteliales U2OS de osteosarcoma humano de CHD4 endógeno (verde, Alexa Fluor 488) y γH2AX (rojo, Alexa Fluor 594) después de sufrir daños en el ADN inducidos por láser. La imagen combinada muestra la colocalización de CDH4 y γH2AX.
¿Cómo el microscopio confocal FV3000 favoreció a nuestro experimento?
Completo sistema espectral con detectores GaAsP de alta eficiencia que proporciona alta sensibilidad en el procesamiento de imágenes de células vivas
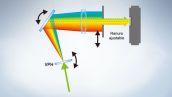
La serie de microscopios FV3000 incorpora la tecnología de detección TruSpectral de Olympus, que difracta la luz por medio de la transmisión a través de la unidad de holograma de fase de volumen. Esta tecnología proporciona una emisión de luz mucho mayor que la de las unidades de detección espectral convencionales con rejillas de tipo reflexión. El detector espectral de alta sensibilidad (HSD) de dos canales del microscopio FV3000 emplea la tecnología TruSpectral con GaAsP PMT y refrigeración de efecto Peltier para lograr una eficacia cuántica alta del 45 % con una alta relación entre señal y ruido. Esta combinación de tecnologías de detección permite una detección potente de alta sensibilidad y minimiza la potencia láser necesaria para realizar una observación del tejido vivo.
Objetivo de súper corrección PLAPON60XOSC2 para análisis de colocalización fiable con baja aberración cromática
Este objetivo de inmersión en aceite minimiza la aberración cromática lateral y axial en el espectro de 405 a 650 nm. Las imágenes de colocalización son adquiridas de manera confiable y las imágenes son medidas con una precisión de posición superior. El objetivo también compensa la aberración cromática y la luz infrarroja cercana de hasta 850 nm. Esto lo hace idóneo para el procesamiento de imágenes cuantitativas.

Objetivo de baja aberración cromática
Aumento: 60X
A. N.: 1,4 (inmersión en aceite)
D. T.: 0,12 mm
Rango de compensación de aberración cromática: De 405 a 650 nm
Mantenimiento de enfoque con el sistema TruFocus de Olympus
El módulo TruFocus usa luz infrarroja de mínima fototoxicidad (clase de láser 1) para identificar la ubicación del plano de la muestra. El modo autoenfoque (AF) en una sola toma permite al usuario definir varias posiciones de enfoque para muestras más profundas, aumentando la eficacia de la adquisición en pila Z en experimentos de múltiples posiciones.
Comentario del Dr. Kyle Miller
Dr. Kyle Miller |
Dr. JaeJin Kim | El procesamiento de imágenes de fluorescencia es una técnica muy utilizada en los estudios de detección y reparación de daños en el ADN que permite analizar la localización y la cinética de los factores de respuesta al daño en el ADN, en puntos con daños en el ADN. La obtención de esta información ha sido fundamental para identificar cómo estos factores detectan y reparan las lesiones en el ADN con una resolución celular única. El microscopio FV3000 ha permitido al Dr. JaeJin Kim y otros técnicos del laboratorio Miller generar daños en el ADN usando la microirradiación láser y estudiar el comportamiento de factor de respuesta al daño en el ADN en células fijas y vivas. La disponibilidad de detectores sensibles, las funciones de enfoque automático y los objetivos con súper corrección han hecho que el microscopio FV3000 sea un instrumento efectivo para realizar estudios en trayectorias de respuesta a daños en el ADN de células cancerígenas humanas. |
Reconocimientos
Esta nota de aplicación has sido preparada con la ayuda de los siguientes investigadores.
Universidad de Texas en Austin, NMS, Dr. Kyle Miller y Dr. JaeJin Kim
Productos usados para esta aplicación
se ha añadido correctamente a sus marcadores
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.

