Revelar los mecanismos reguladores que intervienen en el ensamblaje adecuado de múltiples cilios móviles mediate el procesamiento de imágenes a alta velocidad de células vivas
A través de esta nota de aplicación, se explicará la formación, la motilidad y el ensamblaje de los cilios. Entérese cómo la investigación que aplica el procesamiento de imágenes a alta velocidad de células vivas revela los mecanismos reguladores que intervienen en el ensamblaje adecuado de los cilios móviles.
Descripción general de los cilios
Los cilios son estructuras capilares que tienen una amplia variedad de funciones esenciales en las células animales. Entre estas funciones destacan la locomoción, la detección del entorno y la alimentación. Los cilios poseen aproximadamente un diámetro de 0,2 μm y una longitud de 10 μm.
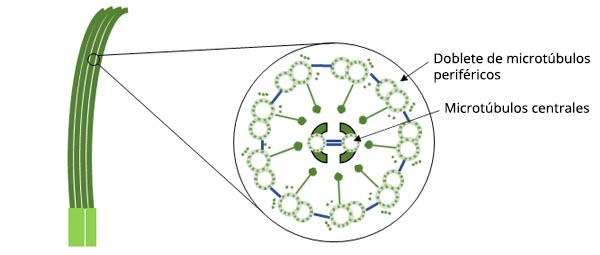
Figura 1. Diagrama esquemático de la estructura de los cilios.
En la locomoción, los cilios actúan como aletas para desplazar la célula. Los paramecios, por ejemplo, son organismos microscópicos que viven en estanques y riachuelos, y están cubiertos de cilios (parecidos a unos remos miniatura) cuya motilidad permite propulsar a estas criaturas a través del agua.
En animales más grandes, los cilios ejecutan funciones más complejas. Proporcionan una fuente de energía para el movimiento, como impulsar el espermatozoide y el óvulo a unirse en la fecundación. Algunos cilios funcionan como antenas para sentir estímulos externos.
La mayoría de las células animales, incluyendo casi todos los tipos de células del cuerpo humano, están recubiertas superficialmente por cilios. Los cilios se dividen en cilios móviles y cilios primarios (inmóviles); la mayoría de los cilios móviles existen en grupos. Las células multiciliadas (MCC, sigla en inglés) son células epiteliales que contienen cientos de cilios móviles cuya función consiste en propulsar el fluido o mucus en una dirección sobre la superficie celular. Están presentes particularmente en los tejidos epiteliales: tejidos delgados que cubren varias superficies y revestimientos en todo el cuerpo. En el tracto respiratorio, las MCC limpian y eliminan la mucosidad y otros irritantes del cuerpo. En la médula espinal y los ventrículos cerebrales de los adultos, éstas transportan el líquido cefalorraquídeo (LCR, sigla en inglés) a través del sistema nervioso central.
Sin embargo, si los cilios no funcionan correctamente, la salud humana puede sufrir varios efectos. Las enfermedades genéticas que engendran anomalías en los cilios humanos se denominan colectivamente «ciliopatías». La lista de ciliopatías continúa alargándose debido a una variedad de enfermedades raras que a menudo afectan múltiples órganos internos del cuerpo. Entender más acerca de cómo se forman, mueven y ensamblan los cilios puede ayudar a los investigadores a aprender más sobre estas enfermedades.
La relación entre los centríolos y los cilios
Los centríolos presentan estructuras cilíndricas que son esenciales para la formación de cilios y centrosomas. En las células, los centríolos suelen encontrarse agrupados de dos en dos (en pares). Alrededor de cada par de centríolos, pueden reunirse determinadas proteínas para formar centrosomas: orgánulos que son responsables del crecimiento y anclaje de los microtúbulos en las células. Los centrosomas actúan como los principales centros organizadores de microtúbulos de la célula y reguladores de la división celular.
A medida que las células copian sus cromosomas antes de la división, los dos centríolos se dividen para desarrollar un centríolo «hija» en cada lado para formar dos centrosomas. A continuación, estos dos centrosomas, compuestos por un par de centríolos «madre» e «hija» y los microtúbulos radiales que los rodean, forman polos de huso mitótico que son responsables de distribuir el material genético (cromosomas) por igual en las dos células «hijas». Tras la división, cada célula «hija» adquiere la misma cantidad de cromosomas y un centrosoma.
Cuando las células están en la fase de no proliferación, el centríolo «madre» se encuentra anclado en la membrana celular y los cilios crecen en su punta. En el momento en que la célula está a punto de proliferar, los cilios se reducirán gradualmente y desaparecerán por completo antes de la división celular. Esto permite que los centrosomas se liberen en el citoplasma para formar husos. De esta forma, el centríolo cumple dos funciones distintas para formar centrosomas y cilios.
Comprender la aparición simultánea de múltiples centríolos nuevos
Los centríolos se duplican una vez por ciclo celular, ¿pero, de dónde proviene la gran cantidad de centríolos en las MCC (como los cilios en los paramecios)? Ya en la década de 1960, los biólogos celulares usaban la microscopía electrónica para observar la rápida expansión de los centríolos durante la formación de las MCC. También, en esta época, se descubrió de improviso que una cantidad superior de centríolos se formaba alrededor de muchas estructuras circulares denominadas deuterosomas.
Décadas más tarde, aún no se llegaba a saber por qué aparecen espontáneamente nuevos centríolos alrededor de los deuterosomas. No fue hasta un estudio en el año 2013, en nuestro laboratorio, que se desveló el misterio. 1 Se descubrió que un par de proteínas homólogas, Deup1 y Cep63, en los animales superiores (vertebrados) regulaban los dos modos de amplificación del centríolo a partir de la formación de novo (es decir, el ensamblaje de centriolos sin centríolos preexistentes) y la formación dependiente del centríolo madre en el proceso de producción de múltiples cilios, respectivamente. Esto esclareció el origen de muchos nuevos centríolos en las MCC.
Ensamblaje preciso de los cilios móviles
Los cilios móviles contienen cientos de componentes proteicos que se sintetizan en grandes cantidades durante la diferenciación de las células multiciliadas. Sin embargo, cuestionamientos científicos importantes quedan aún sin respuesta: ¿son un ensamblaje espontáneo, se organizan de una manera específica, o se almacenan bajo demanda?
Nuestros hallazgos publicados revelan que los materiales fibrogranulares (FGM), grandes cúmulos de gránulos electrodensos a nivel subcelular propios de las MCC, juegan un papel importante como organizadores en la regulación del ensamblaje preciso de los cilios móviles.2
Los gránulos fibrosos son estructuras subcelulares que se presentan sólo en las MCC de los animales superiores (vertebrados). Si bien fueron descubiertos a través de estudios de microscopía electrónica en la década de 1960, su composición y función aún no están claras, salvo por el hecho de que poseen el material/matriz pericentriolar 1 (PCM1). Al combinar la proteómica, la microscopía de superresolución, la microscopía de alta velocidad de células vivas con múltiples técnicas de microscopía electrónica se pudo descubrir lo siguiente:
- Los gránulos fibrosos son orgánulos grandes de carácter líquido, sin membrana y formados por la separación de las fases PCM1, que se adhieren a los deuterosomas y enriquecen su estructura polidrupa gracias a muchas proteínas estructurales de estroma y cilios específicos. Estas proteínas estructurales se localizan en la matriz y los cilios en diferentes etapas de la ciliogénesis.
- La alteración artificial del nivel proteico PCM1 evita que las MCC formen partículas fibrosas y conlleva a una cantidad, un tamaño y una distribución anormales de deuterosomas. Si bien estas células al final formaron la misma cantidad de cilios que las células de control, la estructura de sus cilios y matriz era significativamente defectuosa. Esto dio como resultado anomalías graves en la forma en que se mueven los cilios y en su capacidad de movimiento.
- El análisis en profundidad reveló que los componentes enriquecidos en las partículas fibrosas se localizan con antelación en la matriz, y que la estructura de la base central de microtúbulos de los cilios se amplía significativamente. Esto indicó que se rompió el orden cronológico de su ensamblaje, afectando la precisión y función de la estructura de los cilios móviles.
Por tanto, los gránulos fibrosos llevan a cabo la función de un organizador durante la diferenciación de las MCC, como almacén de componentes asociados a los cilios y para adherirse al deuterosoma y enriquecer la proximidad de la base de los nuevos cilios a fin de asegurar el ensamblaje adecuado de la estructura fina de cilios móviles.
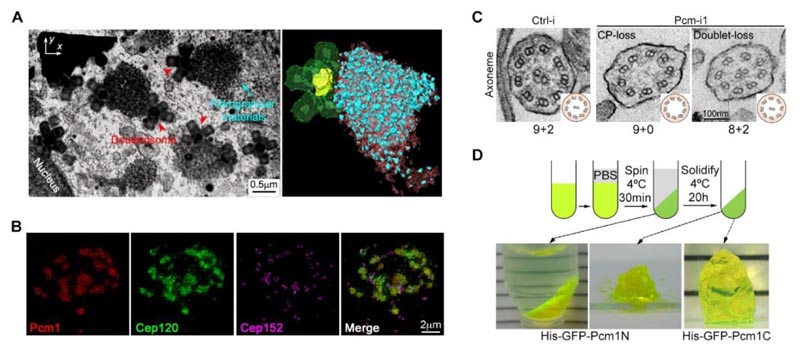
Figura 2. (A) La microscopía electrónica de escaneo con haz de iones focalizados (FIB-SEM, siglas en inglés) mostró la distribución espacial de partículas fibrosas y deuterosomas en células multiciliadas. (B) La estructura de las partículas fibrosas puede enriquecer la proteína Cep120 de la matriz. (C) Alterar el nivel proteico PCM1 conduce a defectos evidentes en la ultraestructura de los cilios en movimiento. (D) Los fragmentos de la PCM1 presentan la propiedad de separación de fases.2
Analizar el ensamblaje correcto de múltiples cilios móviles
En esta investigación, 2 se usó una variedad de tecnologías de procesamiento de imágenes, como la microscopía de superresolución, la microscopía de alta velocidad de células vivas y la microscopía electrónica. El núcleo de esta investigación fue el microscopio de superresolución IXplore™ SpinSR de Evident. A continuación, se proporciona una descripción detallada de la aplicación práctica del sistema IXplore SpinSR con respecto a la investigación que se explica en la presente publicación.
Se llevó a cabo el procesamiento de imágenes de dos canales a partir de células vivas. Se usaron células ependimarias ventriculares de ratón (mEPC, sigla en inglés) infectadas con vectores de adenovirus y lentivirus a fin de expresar el marcador SNAP-Deup1 bajo los promotores GFP-PCM1 y Deup1.
Se observó el comportamiento dinámico del promotor GFP-PCM1 en las células mEPC a través del procesamiento de imágenes in vivo en directo habilitado por el sistema IXplore SpinSR. Puesto que la expresión del marcador SNAP-Deup1 se controló mediante el promotor Deup1, la aparición de puntos positivos SNAP-Deup1 indicó que la célula experimentaba una expansión de centríolo.
El resultado del procesamiento de imágenes mostró lo siguiente:
- Se estableció una clara colocalización entre los deuterosomas marcados con SNAP-Deup1 y los FGM marcados con GFP-PCM1 en las mEPC. Éstos presentan diferentes tamaños, pero se mueven juntos.
- El punto de FGM de mayor tamaño parece envolver completamente el deuterosoma y, a veces, varios deuterosomas se ven confinados a un punto grande de FGM.
- En el momento en que los dos puntos de FGM se encuentran, se produce su fusión gradual en un punto de FGM más grande, donde sus deuterosomas internos se fusionan (Figura 3). Por lo tanto, estos experimentos han demostrado que los FGM tienen propiedades líquidas y se unen fuertemente a los deuterosomas.
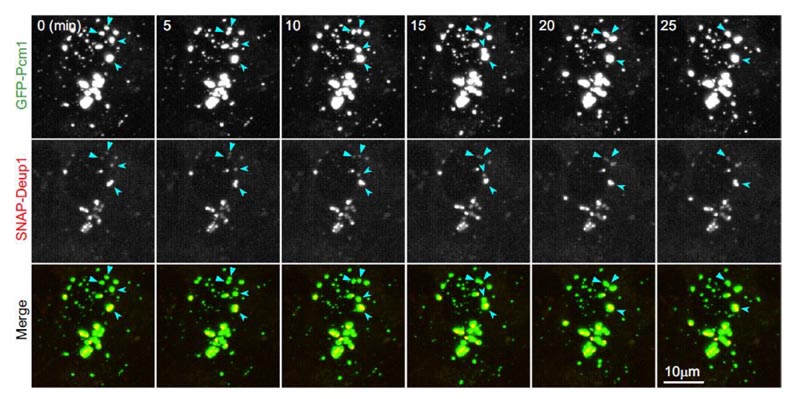
Figura 3. Los FGM en mEPC vivas tienen propiedades líquidas y se unen fuertemente al deuterosoma. El punto de FGM tiene propiedades líquidas y se une al deuterosoma. Las mEPC fueron visualizadas vivas en tiempo real cada cinco minutos el día 3. Los marcadores GFP-PCM1 y SNAP-Deup1 indican los FGM y deuterosomas, respectivamente. Las flechas indican la fusión de los dos FGM en la secuencia de las imágenes.2
Condiciones de procesamiento de imágenes
Sistema: Sistema IXplore SpinSR (modo confocal)
Lente de objetivo: APON60XOTIRF/ A. N. de 1.49
Tiempo de exposición: 100 milisegundos
Duración: Cada cinco minutos durante 65 minutos
Por otra parte, se incubaron células epiteliales traqueales de ratón (MTEC), cultivadas en una placa Transwells con tinción SiR-tubulina de 200 nM, a fin de marcar con fluorescencia sus múltiples cilios. Mediante el uso del procesamiento de imágenes de alta velocidad con el sistema IXplore SpinSR para capturar las trayectorias motoras de las MTEC —positivas al marcador GFP-Centrin1—, se descubrió que los cilios móviles mostraban principalmente una oscilación —semejante a la de una onda regular— en las células de control, mientras que los cilios móviles giraban de forma irregular o perdían por completo su capacidad para moverse en las MTEC alteradas por la proteína PCM1 (Figura 4).
Videos asociados

Figura 4. La supresión de la PCM1 conduce a una motilidad ciliar anormal de las MTEC.2
Condiciones de procesamiento de imágenes
Sistema: Sistema IXplore SpinSR (modo de superresolución)
Lente de objetivo: APON60XOTIRF (A. N. de 1.49)
Tiempo de exposición: 14 milisegundos
Tiempo de adquisición: Intervalo de 15 milisegundos, 3 segundos
¿Cómo el sistema microscópico de superresolución IXplore SpinSR facilitó el experimento?
El sistema de procesamiento de imágenes de superresolución IXplore SpinSR permite observar muestras en directo. Emplea la tecnología confocal de disco giratorio para adquirir imágenes rápidas con una fototoxicidad mínima para las células vivas.
La observación en intervalos de tiempo (tb. lapso de tiempo) es una herramienta común en la investigación biológica para capturar cambios en estructuras y fenómenos intracelulares, mas requiere configuraciones adaptadas a las condiciones de observación necesarias para capturar dichos cambios. El sistema IXplore SpinSR otorga imágenes de superresolución de células vivas que capturan los cambios rápidos y los fenómenos correctos al minimizar la fototoxicidad tanto como sea posible.
También, más allá del rendimiento del hardware, el procesamiento de datos de alta velocidad del sistema IXplore SpinSR permite acceder a imágenes de superresolución a través de una ventana de visualización en vivo.
Características clave:
- Resolución horizontal: 110 nm (combinación de disco Sora)
- Escaneos de alta velocidad
- Procesamiento de imágenes de superresolución multicolor
- Fácil configuración
| AgradecimientosEste artículo fue escrito con la colaboración de Yan Xiumin, Instituto de Biología Celular Bioquímica de Shanghai, Academia de Ciencias de China. |
Referencias bibliográficas:
1. Huijie Zhao et al. «The Cep63 paralogue Deup1 enables massive de novo centriole biogenesis for vertebrate multiciliogenesis» Revista científica Nature Cell Biology, N.º. 15 (Dic. 2013): 1434–1444. doi: 10.1038/ncb2880.
2. Huijie Zhao et. al. «Fibrogranular materials function as organizers to ensure the fidelity of multiciliary assembly» Revista científica Nature Communications, N.º. 12: 1273 (Feb. 2021). doi.org/10.1038/s41467-021-21506-8.
Productos usados para esta aplicación
se ha añadido correctamente a sus marcadores
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.
