Análisis 3D de cocultivo de esferoides cancerígenos con el software NoviSight™
Las imágenes confocales de los esferoides de cocultivos se analizan cuantitativamente usando el software NoviSight para evaluar su propagación celular y determinar la sensibilidad del fármaco en cada célula.
Introducción
La evaluación del rendimiento del fármaco en esferoides cancerígenos tridimensionales es importante porque reflejan el complejo microentorno in vivo del cáncer. Esto permite a los investigadores evaluar la eficacia del fármaco bajo parámetros que se asemejan más al entorno natural del tumor.
Para probar la aplicabilidad del software de análisis 3D de NoviSight a esta aplicación, cocultivamos esferoides cancerígenos de células A549 y células de HeLa. Después, usamos el software NoviSight para analizar los efectos del tratamiento del fármaco tridimensional en estas células. Este estudio demostró que el software NoviSight puede usarse con éxito para clasificar objetos en función de la información que contienen y para analizar los parámetros de cada objeto a fin de evaluar la eficacia de un fármaco.
![]()
Resumen gráfico
 | |
 |  |
Benefits
- Partiendo de las señales, se puede clasificar dos tipos de células y analizar poblacionales.
- La eficacia del fármaco puede analizarse espacialmente separando el área central y el área periférica del esferoide.
Métodos
Preparación de las células
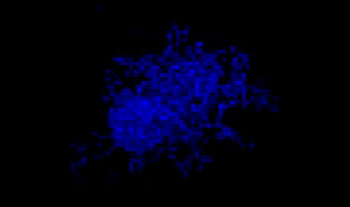
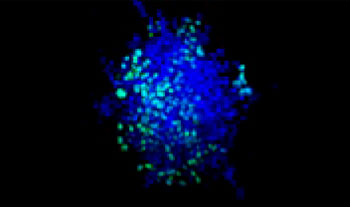
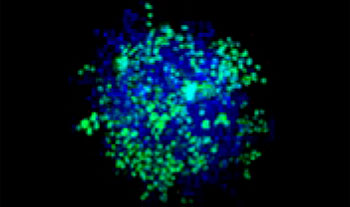
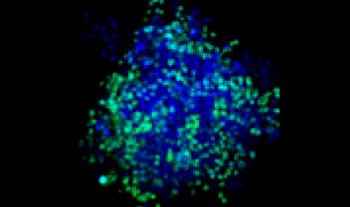
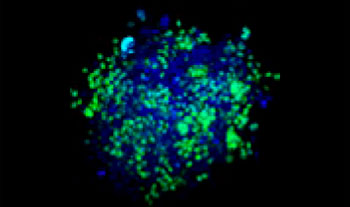
Se mezclaron células de pulmón humano A549 y células de cáncer cervical de HeLa (EGFP expresado en el núcleo) con una proporción variable. La proporción de células de HeLa se corrigió en función de la intensidad de las señales del EGFP (Fig. 1*1). Las células se repartieron en una placa Corning® de 384 pocillos con base redonda (200 células por pocillo) y se dejaron en cultivo durante tres días en DMEM con FBS al 10 %. La placa se centrifugó suavemente para eliminar cualquier burbuja presente en los pocillos.
A549: HeLa-EGFPnls
100:0
| 75:25
| 50:50
| 25:75
| 0:100
|
Figura 1. Esferoides de cáncer cocultivados preparados*1
Preparación de la muestra
Las muestras se trataron con estaurosporina (STS) durante cinco horas con concentraciones que iban de 3,7 nM a 3,75 μM para conseguir una proporción 1:1 de células de A549 y células de HeLa en los esferoides. Usando la diferencia en la permeabilidad de la membrana, pudimos determinar la viabilidad celular tiñendo todos los núcleos con 10 μM de Hoechst33342 (DOJINDO) y el núcleo de la célula muerta con 1 μM de TO-PRO3 (Thermo Fisher Scientific®). Después, lavamos las muestras tres veces con 1x PBS y las fijamos con paraformaldehído al 4 % durante la noche a 4 °C (39.2 °F). Antes de procesar las imágenes, los esferoides se trataron con el reactivo de lavado de tejido SCALEVIEW-S4 (FUJIFILM Wako) durante la noche a temperatura ambiente.
Imagen y análisis
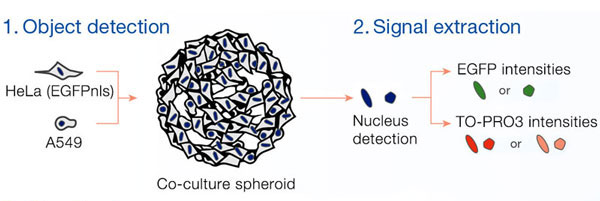
Las imágenes fluorescentes de los esferoides se obtuvieron usando el microscopio de escaneo láser confocal FLUOVIEW® FV3000 con un objetivo súper apocromático de la línea A (UPLSAPO30XS). El collar de corrección del objetivo se ajustó para coincidir con el índice de refracción del líquido de inmersión para proporcionar imágenes de alta calidad y mostrar la morfología 3D. Muchas de las imágenes fueron importadas al software de análisis celular 3D NoviSight™, donde fueron reconstruidas en tres dimensiones. El software NoviSight™ puede reconocer objetos, como el núcleo, y analizar ampliamente las señales contenidas en los objetos.
Resultados
Sensibilidad del fármaco de procesamiento de imágenes en esferoides cocultivados
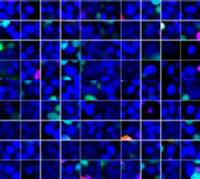
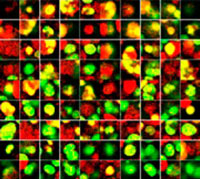
Para visualizar los esferoides cancerígenos cocultivados en profundidad tuvimos que adquirir la transparencia de los esferoides y después visualizarlos en un microscopio de escaneo láser confocal FV3000. El tratamiento con estaurosporina aumentó el número de células muertas de forma supeditada a la dosis (Fig. 2*1). El análisis tridimensional es necesario para determinar qué células están muertas y cuántas células muertas hay en la masa tridimensional.
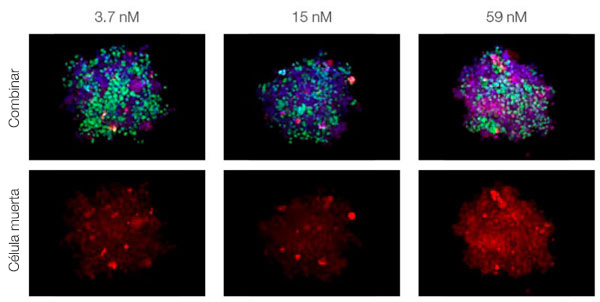
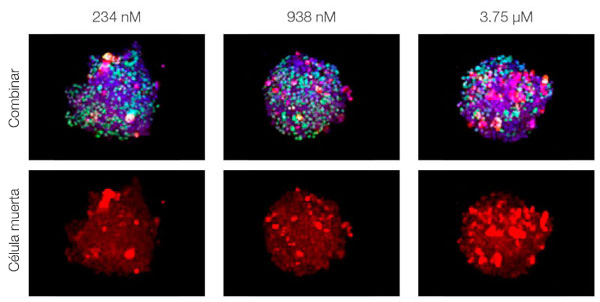
Figura 2. Respuesta del fármaco en esferoides cocultivados*1
Análisis de la sensibilidad del fármaco en esferoides cocultivados
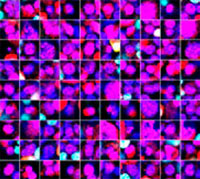
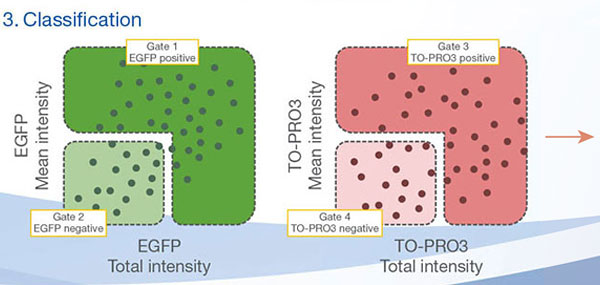
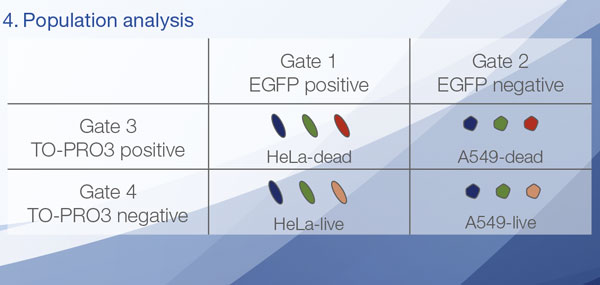
Las señales de Hoechst33342 nos permitieron reconocer el núcleo. Todas las células se clasificaron en dos grupos partiendo de la presencia de una señal EGFP: EGFP positiva (células de HeLa) y EGFP negativa (células de A549). Las células en estos dos grupos se dividieron posteriormente en función de la presencia o la ausencia de señales de células muertas (TO-PRO3, rojo) para un total de cuatro grupos (Fig. 3*1). El porcentaje de células vivas con respecto al total de células para las células de A549 y células de HeLa se calculó y se representó (Fig. 4). Los resultados indicaban que las células de HeLa eran más sensibles a la estaurosporina que las células de A549.
La utilización del software NoviSight™ permitió clasificar los tipos de células contenidas en cada esferoide cancerígeno cocultivado y analizar la respuesta específica del fármaco a cada tipo de célula.
| Galería |
|
|
|
|
| Hoechst | + | + | +*2 | +*2 |
| EGFP | - | - | + | + |
| TO-PRO-3 | - | + | - | + |
Figura 3. El software NoviSight puede clasificar las células en 4 grupos basándose en las señales*1
*2 Las dos galerías de la derecha no muestran las señales de Hoechst
Concentración de estaurosporina
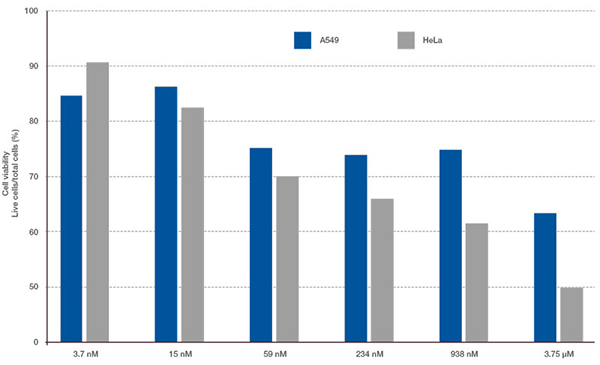
Figura 4. Diferencia en la respuesta del fármaco entre las células de A549 y las células de HeLa
Estrategia de análisis espacial
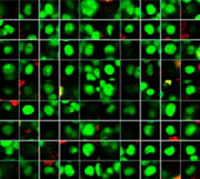
Las imágenes se han capturado en tres dimensiones para un análisis espacial más complejo. Esto permite analizar el comportamiento celular en tejidos heterólogos, como el cáncer. El software NoviSight™ puede definir la región que va a analizarse. Se configuró el software para que analice el centro y la periferia de cada esferoide y se crearon ocho grupos (Fig. 5). Después se analizó la población dentro de estas áreas (Fig. 6). Este método permite un análisis espacial de la eficacia del fármaco en esferoides cancerígenos cocultivados.
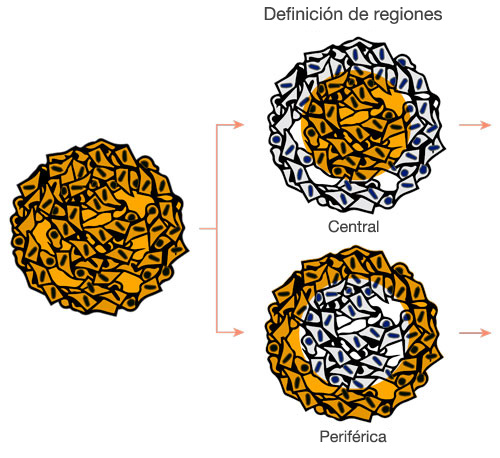 | 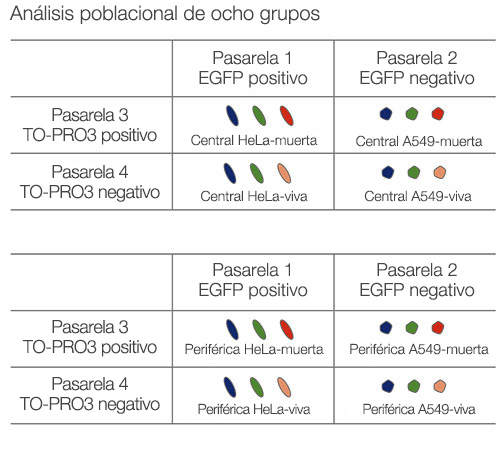 |
Figura 5. Diagrama esquemático del análisis espacial
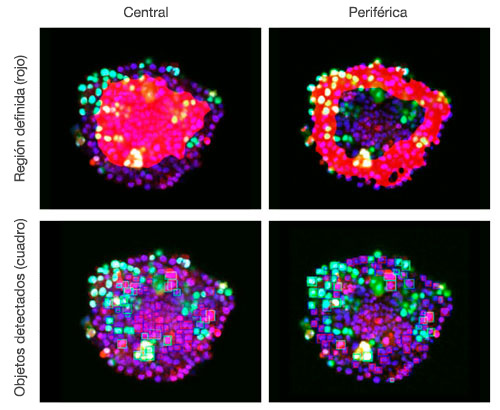
Figura 6. El software NoviSight puede clasificar la sección central y la periferia
Análisis espacial de la eficacia del fármaco
El software NoviSight™ no solo puede contar el número de células muertas, sino que también analiza la eficacia espacial del fármaco. Para demostrar esta funcionalidad, se llevó a cabo un análisis especial de cada célula muerta en los esferoides cocultivados. Se calculó la proporción de cada célula muerta con respecto al número de células en las áreas central y periférica (Fig. 7). En este caso, no había diferencia en la eficacia del fármaco entre estas dos regiones. El número de células muertas en el centro y en la periferia aumentó de forma supeditada a la dosis.
Concentración de estaurosporina
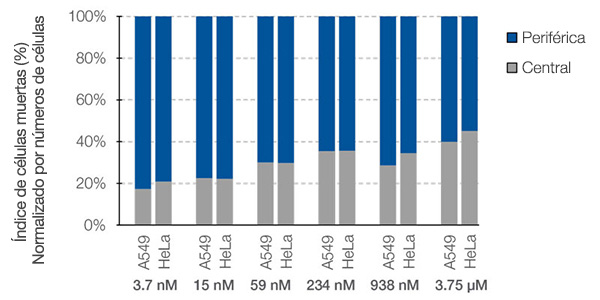
Figura 7. Diferencia en la respuesta del fármaco entre la región central y la periférica.
Conclusión
La utilización del software NoviSight junto con el microscopio de escaneo láser confocal FLUOVIEW® FV3000 permitió clasificar los tipos de células que habían en los esferoides cancerígenos cocultivados y analizar la respuesta específica del fármaco a cada tipo de célula. Cambiando la combinación de los cocultivos, se pudo reproducir el microentorno de los diversos cánceres y evaluar la eficacia de los fármacos anticancerígenos.
Authors
Hiroya Ishihara, Biological Evaluation Technology 2, Research and Development
*1 Si bien estas líneas celulares forman parte de las más importantes para la investigación médica, es imperativo reconocer la contribución de Henrietta Lacks a la ciencia que se produjo sin su consentimiento. Esta injusticia, a pesar de haber dado lugar a descubrimientos clave en inmunología, enfermedades infecciosas y cáncer, también ha generado importantes debates sobre la privacidad, la ética y el consentimiento en la medicina.
Para obtener más información sobre la vida de Henrietta Lacks y su contribución a la medicina moderna, haga clic aquí.
http://henriettalacksfoundation.org/
Productos usados para esta aplicación
se ha añadido correctamente a sus marcadores
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.