Optimización de la adquisición de imágenes para aumentar el rendimiento de los análisis 3D de esferoides cancerígenos
Resumen
A través de esta nota de aplicación, se determinarán los ajustes óptimos de adquisición de imágenes para que un microscopio confocal obtenga imágenes a alta velocidad junto con la calidad necesaria para análisis 3D de esferoides cancerígenos. La evaluación de la eficacia del fármaco de alto rendimiento se llevó a cabo usando la placa de microtejidos 3D InSight™ de InSphero.
・Flujo de trabajo de evaluación de fármacos
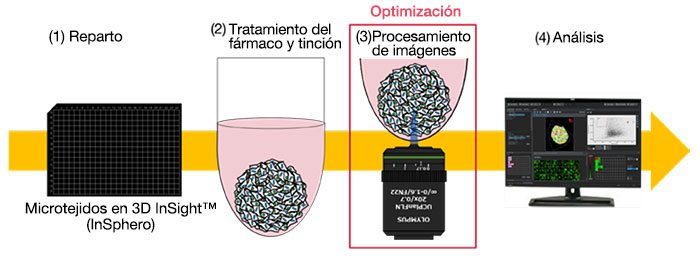
・Optimización de las condiciones de procesamiento de imágenes
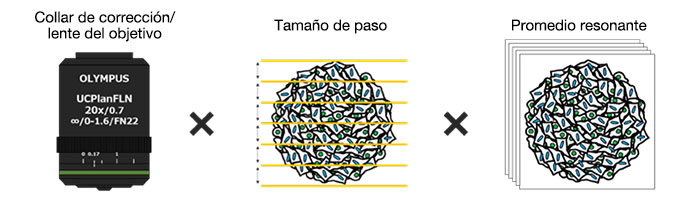
Beneficios
- Optimice los ajustes de adquisición del microscopio FV3000RS para obtener imágenes a alta velocidad con la calidad necesaria para el análisis 3D con NoviSight™.
- El software NoviSight puede analizar objetos con una calidad de imagen baja porque utiliza la información de señal del objeto reconocido basándose en la señal de los núcleos con una alta relación entre señal-ruido.
Introducción
La evaluación del rendimiento del fármaco en esferoides cancerígenos tridimensionales es crucial ya que reflejan el complicado microentorno in vivo del cáncer. Esto permite a los investigadores evaluar la eficacia del fármaco bajo condiciones que se asemejan más al entorno natural del tumor.
Sin embargo, la obtención de segmentos ópticos para una gran cantidad de muestras puede requerir mucho tiempo. Para agilizar este flujo de trabajo, hemos determinado los ajustes de adquisición de imagen óptimos para que el microscopio confocal FLUOVIEW™ FV3000RS obtenga imágenes a alta velocidad con la calidad necesaria para análisis 3D con NoviSight™.
La optimización de las condiciones de adquisición, como el collar de corrección de la lente, el tamaño de paso en la dirección de profundidad y los tiempos promedios, permitió la captura de secciones ópticas de 252 muestras de microtejidos 3D de InSight™ en una placa de 384 pocillos de Akura™ (InSphero) en 56 minutos y 23 segundos. El software NoviSight permitió analizar varias imágenes de muestras adquiridas a alta velocidad con el microscopio confocal FV3000RS.
Métodos
Preparación de muestras
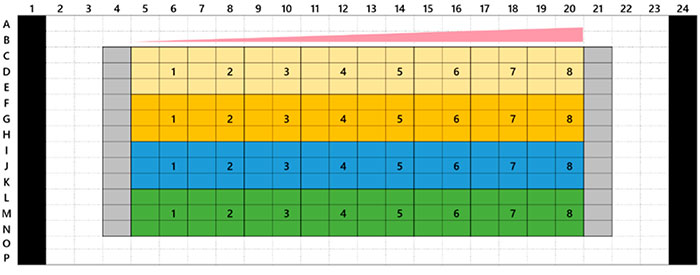
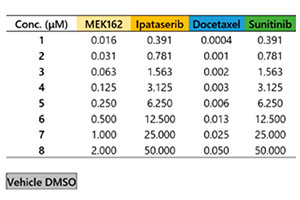
Microtejidos tumorales 3D de InSight™ en una placa Akura™ de 384 pocillos proporcionada por InSphero. El HCT-116 de línea celular etiquetada con proteína fluorescente verde (carcinoma colorrectal humano) se agregó junto con fibroblastos NIH3T3-RFP. En cada compuesto de referencia, el tratamiento duró 7 días (con una dosis en el día 0 y otra dosis en el día 4). La Figura 1 muestra la disposición de la placa y la lista de compuestos de ensayo. Después del tratamiento con el fármaco, se lavaron las muestras tres veces con una solución salina amortiguadora de fosfatos 1x (PBS) y se fijaron con una solución de paraformaldehído al 4 % durante la noche a 4 °C (39,2 °F). A continuación, se lavaron las muestras con la solución PBS 1x, fueron teñidas con 1 μM TO-PRO-3 (Thermo Fisher Scientific) en una solución de TritonX-100 al 0,1 %, fueron incubadas con el reactivo de lavado SCALEVIEW-S4 durante la noche a 37 °C (98,6 °F).
|
|
Fig. 1: Disposición de la placa y lista de compuestos de ensayo
Procesamiento de imágenes y análisis
Para evitar que se produzcan interferencias de RFP y TO-PRO-3 en este experimento, las imágenes se tomaron en modo secuencial (lo que tarda el doble).
En el análisis, las señales fluorescentes de todas las células (TO-PRO-3) nos permitieron reconocer el núcleo. Todas las células se clasificaron como HCT-116 o NIH3T3 a partir de las señales de proteínas fluorescentes rojas (RFP) y GFP.
Resultados
Optimización del collar de corrección de la lente del objetivo
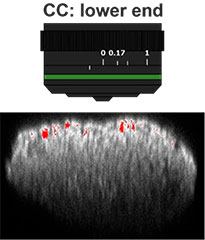
En primer lugar, se optimizó el collar de corrección de la lente del objetivo (CC) para obtener imágenes en 3D con altos niveles de resolución y contraste. Para este procesamiento de imágenes se utilizó el objetivo UCPLFLN20X con una larga distancia de trabajo y una apertura numérica (A. N.) alta. La posición con el mejor contraste fue ajustada y se cambió el título del dial empezando por el extremo inferior. Se halló que CC= 0,17 era la condición óptima (Fig. 2). Por consiguiente, se ajustó el CC a 0,17 para observar la placa Akura™ de 384 pocillos con un objetivo UCPLFLN20X.
|
|
|
|
Fig. 2: Optimización del collar de corrección de la lente del objetivo (barra de escala=100 μm)
Optimización del tamaño de paso del eje Z
A continuación, se examinó el efecto del tamaño de paso del eje Z en el reconocimiento de objetos y el análisis en el software NoviSight™. Los resultados indican que la precisión de reconocimiento disminuyó en proporción al tamaño del paso (Fig. 3). El tamaño del paso mínimo (1,28 μm), que es la mitad de la resolución de profundidad, se utilizó a modo de referencia. Después de la clasificación, los números de células no mostraron una diferencia significativa entre el tamaño de paso mínimo (1,28 μm) y 3 μm (Prueba t de Student). El tamaño del núcleo es de unos 10 μm, por lo que pueden tomarse unas tres imágenes para cada núcleo usando este tamaño de paso.
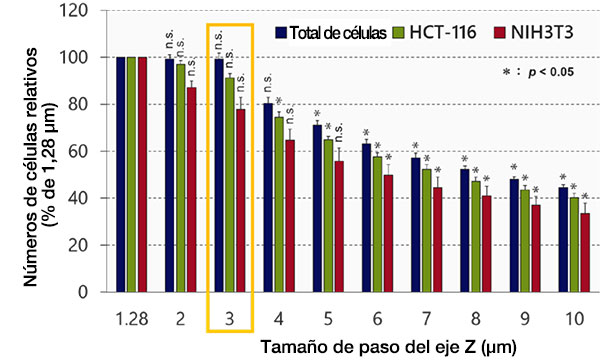
Fig. 3: Optimización del tamaño de paso
Optimización de los tiempos medios (modo de escaneo resonante)
La calidad de imagen del escaneo resonante del microscopio FV3000RS depende del número de tiempos promedios. Se optimizó el número de tiempos promedios para obtener la calidad de imagen necesaria en el análisis de NoviSight. El software NoviSight utiliza la señal de fluorescencia para reconocer el objeto del análisis, por lo que no es necesario usar una imagen de alta resolución. En este experimento, se utilizaron núcleos con una alta relación señal-ruido para el reconocimiento de objetos, por lo que solo fue necesario obtener información de intensidad en otros canales (GFP/RFP). Al comparar la precisión de reconocimiento del escáner galvanométrico con la imagen promedio del escáner resonante, se detectó que la precisión de reconocimiento era casi la misma que el control, incluso cuando no se promediaba (prueba t de Student) (Fig. 4). En este experimento, se demostró que la calidad de imagen era suficiente para el análisis NoviSight sin calcular el promedio.
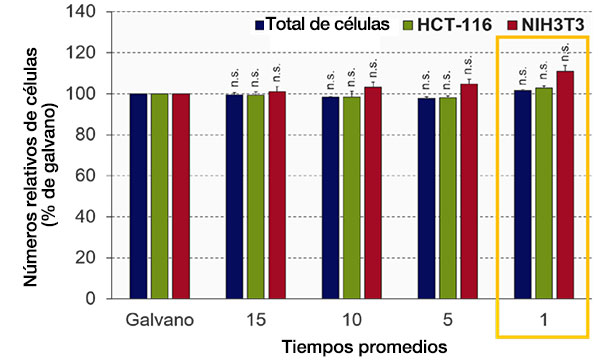
Fig. 4: Optimización de los tiempos promedios
Procesamiento de imágenes en condiciones optimizadas
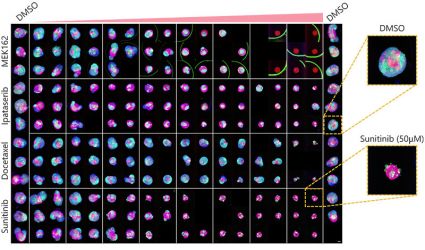
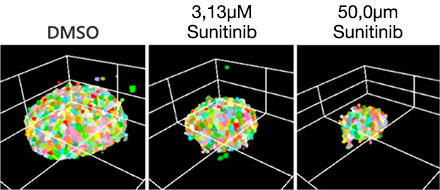
La optimización de las condiciones anteriores (Fig. 5A) permitió capturar 252 muestras de microtejidos en 3D InSight™con placas Akura™ de 384 pocillos (InSphero) en 56 minutos y 23 segundos (Fig. 5B). Los resultados muestran que todos los fármacos inhiben el crecimiento del esferoide de forma supeditada a la muestra. Además, el tratamiento con altas concentraciones de Sunitinib, un fármaco de blanco molecular que inhibe el factor de crecimiento endotelial vascular (VEGF) redujo considerablemente la intensidad de la proteína fluorescente verde (GFP), lo que indica que solo afecta a las células cancerígenas (HCT-116 etiquetado con GFP).
(A)
| (B) Fig. 5: Condiciones óptimas y resultados de procesamiento de imágenes (barra de escala=100 μm) |
Análisis
Después de detectar las células (Fig. 6A), resulta más sencillo confirmar el número total de células en cada esferoide usando un mapa térmico en el software NoviSight™ (Fig. 6B). Después de la clasificación, se calculó el porcentaje de número de células relativo y se muestra un gráfico (Fig. 6C). Los resultados del análisis indicaron que Sunitinib afectó al crecimiento de las células cancerígenas (HCT-116, IC50=1,46 μM). Se pudo evaluar el fármaco en 3D gracias al procesamiento de imágenes a alta velocidad usando el sistema FV3000RS bajo condiciones optimizadas.
(A)
| (B)
|
(C)
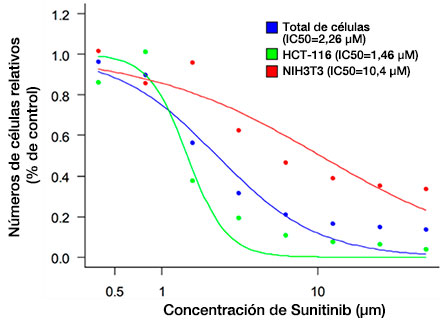
Fig. 6 Three-dimensional efficacy drug evaluation
Conclusión
Se visualizaron 252 muestras de microtejidos en 3D InSight™ en placas Akura™ de 384 pocillos (InSphero) usando el microscopio confocal FV3000RS bajo condiciones optimizadas a fin de procesar imágenes con un alto rendimiento. Este estudio demuestra que el procesamiento de imágenes puede completarse en una hora y además puede dar cabida al análisis 3D de NoviSight. El ajuste de la combinación de colorantes y el tamaño de la muestra puede mejorar aún más el rendimiento.
Author
Hiroya Ishihara, Biological Evaluation Technology 2, Research and Development
Takashi Sugiyama, Biological Evaluation Technology 2, Research and Development
Productos usados para esta aplicación
se ha añadido correctamente a sus marcadores
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.